гематоксилиновые шары в головном мозге
ЗЕРНИСТЫЕ ШАРЫ
ЗЕРНИСТЫЕ ШАРЫ — макрофаги мозга, фагоцитирующие продукты распада нервной ткани и транспортирующие их к подпаутинному (субарахноидальному) и периваскулярным пространствам. Впервые описаны в 1841 г. Глюге (G. Gluge); термин «зернистые шары» предложен Нисслем (F. Nissl). Роль и значение 3. ш. в процессах рассасывания при распаде нервной ткани охарактеризованы в работах Ниссля, Альцгеймера (A. Alzheimer), Мерцбахера (L. Merzbacher).
По поводу происхождения 3. ш. существуют различные точки зрения. Считалось, что основным их источником является микроглия, к-рую относили к ретикулоэндотелиальной системе (см.). Авторадиографические и электронно-микроскопические исследования коры головного мозга в области травмы у экспериментальных животных не обнаружили клеток нейроглии, которые можно считать источником макрофагов. Согласно этим данным, 80% 3. ш. в веществе мозга формируется из моноцитов крови или перицитов мелких внутримозговых сосудов; клетки нейроглии составляют 20% в образовании макрофагов мозга.
Процесс появления 3. ш. прослежен в области очагов некроза (см.) коры головного мозга при травмах. Первые макрофаги [трансформированные моноциты по Китамуре (Т. Kitamura)] обнаруживаются вокруг очага некроза через 24 часа с момента травмы. Окончательно сформированные 3. ш. в значительном количестве появляются в очаге некроза через 48 час. с момента травмы и наблюдаются в течение многих месяцев. Часть 3. ш. распадается на месте образования, другие переносят фагоцитированные продукты распада к периваскулярным и субарахноидальному пространствам.
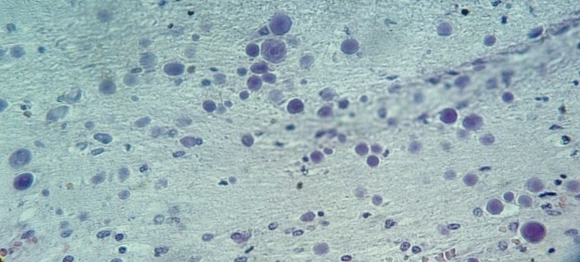
3. ш. выявляются при всех методах комбинированных окрасок срезов (гематоксилин-эозин, метод Ван-Гизона, метод Маллори). При окраске по Нисслю (см. Ниссля метод)— это крупные клетки округлой или многоугольной формы, с сотовидной цитоплазмой; перекладины сот или решеток тонкие, ядра маленькие, многоугольные, располагаются эксцентрично (рис.). В цитоплазме 3. ш. содержатся различные продукты, образующиеся при распаде вещества мозга— липиды, продукты распада миелина, различные пигменты (гемосидерин при кровоизлияниях, меланин при некрозе в области черной субстанции и т. д.), определяющиеся гистохимическими методами исследования (см.).
Кроме 3. ш., возникающих при распаде нервной ткани, описаны липидные включения в шаровидных клетках коры головного мозга новорожденных — так наз. физиологические 3. ш. Р. Вирхов считал, что их появление свидетельствует об энцефалите. По мнению многих авторов, эти клетки транспортируют простейшие липиды.
Гематоксилиновые шары в головном мозге
В течение последних десятилетий сосудистая патология головного мозга приобретает все большую значимость и является одной из наиболее актуальных медицинских и социальных проблем из-за широкой распространенности, высокой летальности и инвалидизации.
Одной из самых тяжелых форм проявлений острого нарушения мозгового кровообращения (ОНМК) является церебральный инсульт. По механизму развития инсульты разделяют на ишемические и геморрагические. В структуре инсульта в мире кровоизлияние в мозг составляет от 10 до 20 случаев на 100 000 населения в год [5]. В России частота геморрагического инсульта составляет 57 на 100 тысяч жителей в год [7], причем в последние годы отмечается увеличение удельного веса геморрагического инсульта в общей структуре ОНМК, на долю которого приходится около 20 % всех видов инсульта. Выделено пять основных этиопатогенетических групп геморрагических цереброваскулярных заболеваний, среди которых церебральный васкулит артерий крупного и среднего калибра сифилитического происхождения занимает скромное место.
В настоящее время уже не вызывает сомнения, что инфицирование центральной нервной системы (ЦНС) при сифилисе происходит в течение нескольких недель или месяцев после заражения. [8]. Поражение ЦНС при этом связано с проникновением бледной трепонемы в оболочки и вещество головного и спинного мозга. Изначально она попадает сюда по периневральным щелям спинномозговых корешков из регионарных лимфатических узлов. Гематогенным путем бледная трепонема проникает в спинномозговую жидкость при уже имеющемся повреждении гематоэнцефалического барьера. Наряду с оболочками в воспалительный процесс вовлекаются и сосуды нервной системы. К настоящему времени доказано, что токсины бледной трепонемы являются вазотропными ядами, способными поражать артериальные и венозные сосуды разного калибра. Поражение сосудов головного мозга при менинговаскулярном сифилисе (МВС) является одной из причин инсульта [2, 3, 9, 10].
Широкое использование антибиотиков, неблагоприятные экологические и социальные условия, снижение иммунитета, рост алкоголизма, наркомании привели к тому, что нейросифилис в течение последних десятилетий приобрел ряд особенностей, изменилась его клиническая картина, произошло структурное перераспределение клинических форм [1, 4]. При этом наряду с асимптомными формами все чаще стал регистрироваться менинговаскулярный нейросифилис [6], в том числе с выраженными клиническими проявлениями и тяжелым течением.
Приведем клинический случай из нашей практики.
В отделение нейрохирургии 31.05.10 г. из центральной районной больницы (ЦРБ) по экстренным показаниям была госпитализирована больная С. 39 лет с диагнозом: ОНМК по геморрагическому типу от 23.05.10, паренхиматозно-субарахноидальное кровоизлияние, левосторонний выраженный гемипарез до плегии в ноге на фоне гипертонической болезни.
Из анамнеза установлено, что заболевание началось остро с появления интенсивной головной боли и потери сознания. Машиной скорой помощи 23.05.10 г. больная была доставлена в терапевтическое отделение ЦРБ, где проводился курс консервативной гемостатической терапии. После консультации с нейрохирургом регионального сосудистого центра была переведена в краевую клиническую больницу 31.05.10 г.
При поступлении общее состояние больной тяжелое, анамнез по поводу наличия фоновых заболеваний собрать не удалось.
Живот мягкий, не вздут. Физиологические отправления не нарушены.
Клинический диагноз: ОНМК по геморрагическому типу (23.05.10) с образованием гематомы правой гемисферы головного мозга, грубый центральный левосторонний гемипарез до плегии в ноге.
В связи с тяжелым состоянием пациентки в день поступления в экстренном порядке ей была проведена пункционная аспирация и дренирование внутримозговой гематомы правой гемисферы головного мозга по жизненным показаниям.
Последний раз больная являлась на прием к дерматовенерологу в декабре 2008 г. При обследовании: РМП 3+; ИФА положительный.
На основании анамнеза, клинических данных, а также данных, полученных при проведении нейровизуализационного и лабораторного обследования, больной был поставлен диагноз: Ранний нейросифилис, инсультообразное течение. ОНМК по геморрагическому типу с образованием внутримозговой гематомы правой гемисферы головного мозга.
В послеоперационном периоде проводилась базисная терапия, включающая препарат цефтриаксон в суточной дозе 2 грамма.
Несмотря на проводимую комплексную терапию, в состоянии пациентки наблюдалась отрицательная динамика, сопровождающаяся развитием полиорганной недостаточности, развилась острая почечная недостаточность.
Выписка из протокола вскрытия.
По вскрытию черепа твердая мозговая оболочка умеренно напряжена, серо-перламутровая. Мягкая мозговая оболочка со слабой инъекцией полнокровных сосудов. Борозды и извилины головного мозга умеренно сглажены, уплощены. Сосуды основания мозга, доступные исследованию, тонкие, гладкие, блестящие. В толще правого полушария теменно-височной области очаг размягчения вещества мозга неправильной округлой формы 3,0×2,7 см, содержащий жидкую густую кровь с мелкоточечными «ржавыми» геморрагиями по периферии. Симметрично в левом полушарии мозга расположен очаг размягчения 2,5×2,2 см, где вещество мозга в виде детрита буровато-ржавого цвета. В остальных участках вещество мозга без очаговых изменений.
Патогистологическое исследование головного мозга: распространенные артерииты с выраженным периваскулярным отеком (рис. 1); муфтообразные периваскулярные инфильтраты, представленные преимущественно плазмоцитами и лимфоцитами; смешаные фибриновые тромбы в мелких артериолах (рис. 2).
Рис. 1. Гистологический препарат головного мозга.
Периваскулярный отек (продольный срез сосуда)
Рис. 2. Гистологический препарат головного мозга. Периваскулярная муфтообразная лимфоплазмоцитарная инфильтрация. Тромб в просвете сосуда
Рис. 3. Гистологический препарат головного мозга. Продуктивный эндартериит
Продуктивный эндартериит (рис. 3), очаги ишемического повреждения мозга с мелкоточечными геморрагиями, гемосидерофагами, кариопикнозом, кариолизисом, образованием «гематоксилиновых» шаров, слабой глиальной реакцией по периферии.
31 мая была выполнена пункционная аспирация и дренирование гематомы. Затем возник отек, набухание головного мозга с развитием дислокационного синдрома, который и послужил непосредственной причиной смерти.
Особенностью данного клинического наблюдения является несвоевременное определение этиологического фактора ОНМК.
Рецензенты:
Ремнев А.Г., д.м.н., профессор, зав. диагностическим отделением Учреждения Алтайского краевого Совета профсоюзов Санаторий «Барнаульский», г. Барнаул;
Михайлов В.П., д.м.н., профессор, главный научный сотрудник отдела нейрохирургии ФГУ «Новосибирский НИИ травматологии и ортопедии» Минздравсоцразвития РФ, г. Новосибирск.
Гематоксилиновые шары в головном мозге
Процессы, протекающие в головном мозге, вероятно, относятся к самым сложным для изучения. Патологические изменения, происходящие в его структурах, являются наиболее труднодиагностируемыми, несмотря на наличие современного оборудования и обширных познаний врачей в данной области. Болезнь Фара относится к редким и малоизученным заболеваниям, которые затрагивают преимущественно базальные ганглии, мозжечок и полушария головного мозга.
Болезнь Фара – идиопатическая неатеросклеротическая симметричная интрацеребральная кальцификация коры полушарий, базальных ганглиев и зубчатых ядер мозжечка, связанная с отложением солей кальция и железа в стенках мелких артерий и артериол, а также в вещество головного мозга. Морфологически кальцификаты обнаруживаются симметрично в различных структурах: коре мозга, белом веществе, подкорковых ганглиях, внутренней капсуле, мозжечке, стенках мелких артерий, реже вен [1].
Характерно наличие периваскулярных мелких кальциевых конгломератов. Наиболее массивная кальцификация выявляется в подкорковых отделах. Микроскопически кальцификаты отличаются типичной структурой, представленной нитями толщиной 140–400 мкм [2].
Впервые синдром (или болезнь) Фара был диагностирован в конце 1930 г. немецким врачом-неврологом Карлом Теодором Фаром. Это редкое дегенеративное заболевание, его распространенность составляет, как было сказано ранее, порядка 1 случая на 1 млн населения. При этом мужчины болеют приблизительно в 2 раза чаще.
Разнообразие симптоматики данного заболевания объясняет сложность постановки диагноза. Клинически болезнь может протекать как совершенно бессимптомно, так и с яркими экстрапирамидными нарушениями в виде мышечной ригидности, тремора, судорог, схожими с таковыми при болезни Паркинсона [3, 4]. Для больных характерны гиперкинезы, головокружения, шаркающая походка. Именно схожесть с другими распространенными заболеваниями затрудняет своевременное выявление данной патологии [5, 6].
На современном этапе развития системы здравоохранения с увеличением доступности компьютерной томографии в рутинной неврологической практике диагностика феррокальциноза постепенно увеличивается, однако, по литературным данным, в большинстве случаев обнаружение кальцинатов является находкой, а не диагностической необходимостью.
Этиология болезни Фара установлена не до конца. Возможными причинами считают гормональные нарушения при патологии щитовидной и паращитовидной желез, что ведет к дисбалансу ионов кальция и фосфора: чаще всего – первичный или вторичный гиперпаратиреоз, реже – псевдогиперпаратиреоз при продукции паратгормона опухолевой тканью (при бронхогенном раке, раке молочной железы); при локализации опухоли в костной ткани (множественная миелома, метастазы в кости). Еще одним из механизмов возникновения предполагают дыхательный алкалоз, компенсируемый фосфатной буферной системой: внутриклеточная концентрация фосфатов увеличивается, в то время как в плазме крови возникают относительная гиперкальциемия и абсолютная гипофосфатемия [7, 8].
Указывается, что гипоксия мозга при гипертонической болезни и атеросклерозе церебральных артерий может приводить к локальному увеличению концентрации ионов кальция в веществе мозга и вызывать петрификацию нейронов базальных ганглиев, но, по мнению авторов, данная гипотеза является исключительно теоретической, а на практике – безосновательной.
Также предполагают возможность генетического характера патологии с локализацией нарушений в четырнадцатой (локус 14q13), второй (локус 2q37) хромосомах, хромосомном участке q21.1-q11.23 восьмой хромосомы. Были установлены варианты, когда болезнь наследовалась аутосомно-доминантным и Х-сцепленным путем [9]. Важно отметить, что имели также место и случаи, в которых семейный характер патологии не прослеживался.
Имеется описание дебюта болезни Фара у пациентки на фоне пневмонии, вызванной SARS-CoV-2 (COVID-19) [10].
Диагностировать болезнь Фара позволяет проведение биохимического анализа крови. Производятся определение электролитов крови: кальция, фосфора, железа, натрия; определение уровня паратгормона; ПЦР-исследования для выявления токсоплазмы, цитомегаловируса и других инфекционных агентов, способных вызывать воспалительные изменения тканей мозга с образованием кальцификатов.
Ключевое значение в диагностике болезни Фара имеют инструментальные методы исследования – УЗИ щитовидной и паращитовидных желез, компьютерная томография и рентгенография.
Лечение заболевания проводят только симптоматически. При симптомах паркинсонизма назначают предшественники дофамина (леводопу), при гиперкинезах – холинолитики (циклодол), в случае эпилептических состояний – барбитураты (фенобарбитал) и бензодиазепины (феназепам, лоразепам, клоназепам). С целью улучшения обменных процессов применяют стимуляторы тканевого метаболизма (глютаминовую кислоту, никотинамид), цитопротекторы (рибофлавин, янтарную кислоту).
В работе нами был проанализирован случай диагностики болезни Фара по результатам аутопсии. Пациентка женского пола М., 1949 года рождения, поступила в ГБУЗ СГКБ № 1 им. Н.И. Пирогова с жалобами на общую слабость, головокружение, мышечные спазмы, тошноту, рвоту, повышенную температуру. При поступлении состояние средней тяжести. При осмотре кожные покровы бледные, видимые слизистые физиологической окраски, зев гиперемирован. Дыхание везикулярное, ЧДД – 12 в минуту, ЧСС – 79 в минуту, пульс ритмичный, АД – 135/75 мм рт. ст., температура 37,4°C. Пациент в сознании, на контакт идет, внимание рассеянное, лицо симметричное, походка неуверенная, наблюдается тремор верхних конечностей. В отделении проведено обследование в полном объеме.
Результаты анализов на ВИЧ, гепатиты B и C отрицательны. В общем анализе крови отклонений от нормы не выявлено. В ходе биохимического анализа крови обнаружены следующие изменения: гипергликемия (глюкоза – 9,2 ммоль/л), гиперкальциемия (кальций – 3,1 ммоль/л), гипокалиемия (калий – 3,2 ммоль/л).
Компьютерная томография головного мозга: геморрагический инсульт в области базальных ядер справа и слева, двусторонняя симметричная кальцификация базальных ганглиев, таламусов, зубчатых ядер и белого вещества больших полушарий.
Макроскопическая картина центральной нервной системы по результатам аутопсии
Кости свода и основания черепа целые. Твердая мозговая оболочка не напряжена, гладкая, сероватая. Мягкая мозговая оболочка отечная, полнокровная. Полушария мозга симметричны. Мозг весом 1410 г. Борозды незначительно углублены. Сосуды основания мозга с единичными атеросклеротическими бляшками на интиме, стенозирующими просвет до 20%. В области базальных ядер головного мозга справа – участок дрябловатой ткани мозга диаметром 1 см с единичными кровоизлияниями диаметром до 1 мм. Выражено полнокровие мелких сосудов. Желудочки мозга незначительно расширены, эпендима гладкая, в просвете прозрачный ликвор. На миндалинах мозжечка следы давления краев большого затылочного отверстия. Во всех других отделах анатомический рисунок строения вещества головного мозга хорошо выражен, с четкой границей и обычным соотношением серого и белого вещества. Ткань мозга на разрезе влажная, блестящая; в области базальных ядер – издает характерный хруст – звон.
Гистологическое исследование головного мозга
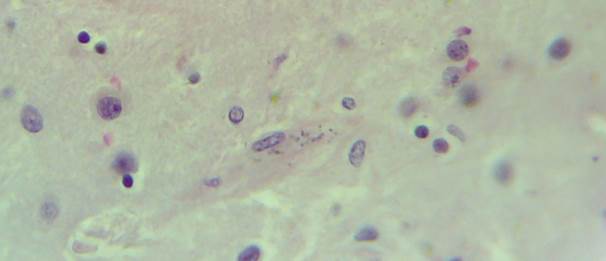
В микропрепарате коры головного мозга – многочисленные зернистые шары (рис. 1).
В микропрепаратах базальных ганглиев – неравномерное кровенаполнение, диапедезные кровоизлияния вокруг сосудов (рис. 2А), умеренный периваскулярный и перицеллюлярный отек (рис. 2А-Б).
Стенки сосудов деформированные (рис. 3А), со множественными консолидированными (рис. 3А) и пылевидными (рис. 3Б) кальцинатами в виде концентрических преимущественно равномерно распределенных колец между адвентицией, средней оболочкой и пограничной мембраной глии.
Рис. 1. Препарат коры головного мозга пациента женского пола, страдавшего болезнью Фара, умершего от геморрагического инсульта. Многочисленные зернистые шары. Окраска гематоксилин-эозином. Увеличение х200
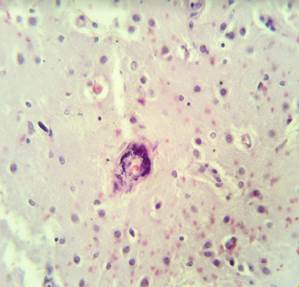
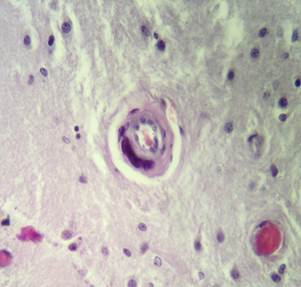
Рис. 2. Препарат базальных ядер пациента женского пола, страдавшего болезнью Фара, умершего от геморрагического инсульта. А – диапедезные кровоизлияния вокруг кальцинированных сосудов с деформированной стенкой, умеренный перицеллюлярный отек. Б – кальцинированный сосуд, умеренный перицеллюлярный и периваскулярный отек. Окраска гематоксилин-эозином. Увеличение х200
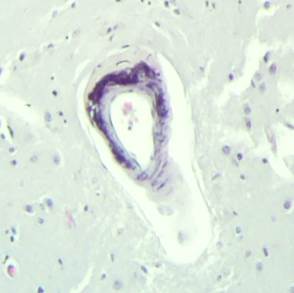
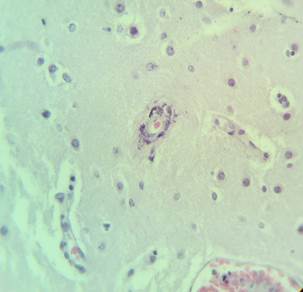
Рис. 3. Препарат базальных ядер пациента женского пола, страдавшего болезнью Фара, умершего от геморрагического инсульта. А – консолидированные кальцинаты в стенке сосуда, выраженный периваскулярный отек. Б – пылевидные кальцинаты в стенке сосуда, умеренный перицеллюлярный и периваскулярный отек. Окраска гематоксилин-эозином. Увеличение х200
Кальцинаты обнаружены в артериях мелкого и среднего калибра, а также в единичных венах (рис. 4А-Б). В веществе мозга и перинейронально имеются кальцинаты в форме различных по размерам глыбок округлой формы (рис. 4Б – крупные кальцинаты, рис. 5 – пылевидные кальцинаты в веществе мозга). Отдельные нейроны кальцинированы.
Со стороны сердечно-сосудистой системы определена концентрическая гипертрофия миокарда (масса сердца 360 г, толщина стенки левого желудочка 1,7 см, правого – 0,4 см, гистологически – гипертрофия мышечных волокон, диффузное разрастание мелких полос соединительной ткани), атеросклероз аорты и ее ветвей, стенозирующий атеросклероз коронарных артерий (III стадия, 3-я степень, стеноз до 30% правой и левой коронарных артерий).
В правом надпочечнике макроскопически определяется округлое образование диаметром 1,2 см, на разрезе равномерного желтовато-оранжевого цвета, гистологически – светлоклеточная аденома надпочечника.
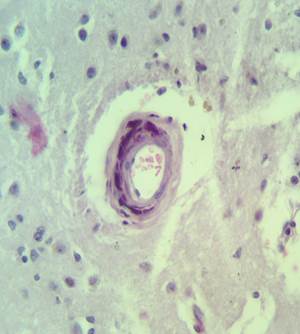
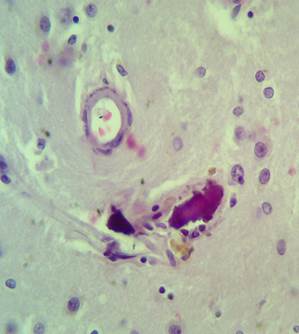
Рис. 4. Препарат базальных ядер пациента женского пола, страдавшего болезнью Фара, умершего от геморрагического инсульта. А – консолидированные и пылевидные кальцинаты в стенке сосуда, выраженный периваскулярный и умеренный перицеллюлярный отек. Б – пылевидные кальцинаты в стенке сосуда, крупный перинейрональный кальцинат, слабый перицеллюлярный и периваскулярный отек. Окраска гематоксилин-эозином. Увеличение х250
Рис. 5. Препарат базальных ядер пациента женского пола, страдавшего болезнью Фара, умершего от геморрагического инсульта. Пылевидные кальцинаты в веществе головного мозга. Окраска – гематоксилин-эозином. Увеличение х400
При анализе данного клинического случая мы склонны считать болезнь Фара и артериальную гипертензию важнейшими сочетанными нозологическими единицами, безусловно повлиявшими на танатогенез. Повышение давления в кальцинированных сосудах мелкого калибра, не обладающих должной эластичностью, приводит к развитию очаговых кровоизлияний.
В связи с разнообразной неспецифической неврологической симптоматикой, а часто и полным отсутствием каких-либо проявлений болезнь Фара остается одним из малоизученных нейродегенеративных заболеваний.
Разработанные и в целом доступные методы диагностики позволяют выявлять феррокальциноз пациентов, однако ограниченность серьезных генетических и лабораторных методов диагностики, низкая приверженность к назначению компьютерной томографии пациентам без клиники острого нарушения мозгового кровообращения объясняют позднюю выявляемость данной патологии; наличие специфической макроскопической и микроскопической картины обусловливает выявление болезни Фара почти исключительно по данным аутопсии.
Начальные проявления недостаточности кровоснабжения мозга (лечение, профилактика, трудоспособность)
Проблема профилактики и лечения ранних форм сосудистых заболеваний мозга имеет большое социальное и экономическое значение. Они не только являются серьезным фактором риска развития мозгового инсульта — одной из ведущих причин инвалидизации и смертности на
Л. С. Манвелов, кандидат медицинских наук
В. Е. Смирнов, доктор медицинских наук, профессор
НИИ неврологии РАМН, Москва
Диагноз «начальные проявления недостаточности кровоснабжения мозга» (НПНКМ) устанавливается в соответствии с «Классификацией сосудистых поражений головного и спинного мозга», разработанной НИИ неврологии РАМН [4], если у больного с признаками общего сосудистого заболевания (вегетососудистая дистония, артериальная гипертония (АГ), атеросклероз) имеются жалобы на головную боль, головокружение, шум в голове, нарушение памяти, снижение работоспособности. Причем основанием для данного диагноза может быть только сочетание двух и более из пяти перечисленных жалоб, которые должны отмечаться не реже одного раза в неделю на протяжении не менее трех последних месяцев
Проблема профилактики и лечения ранних форм сосудистых заболеваний мозга имеет большое социальное и экономическое значение. Они не только являются серьезным фактором риска развития мозгового инсульта — одной из ведущих причин инвалидизации и смертности населения, но и сами по себе существенно ухудшают качество жизни, а нередко и снижают трудоспособность.
Вторичная профилактика, в проведении которой нуждаются больные начальными проявлениями недостаточности кровоснабжения мозга (НПНКМ), включает мероприятия по предупреждению как обострений основных сердечно-сосудистых заболеваний, так и сосудистых поражений мозга.
Лечебно-профилактические мероприятия при НПНКМ можно схематично разделить на следующие виды: режим труда, отдыха и питания; лечебная физкультура; дието-, физио- и психотерапия; медикаментозное лечение и профилактика. Чаще всего назначают диету № 10 с учетом антропометрических данных, результатов исследования особенностей обмена.
Терапию больных НПНКМ следует проводить по трем основным направлениям:
У больных НПНКМ на ранних стадиях формирования основного сосудистого заболевания для компенсации состояния иногда бывает достаточно рационального трудоустройства, соблюдения режима труда, отдыха и питания, отказа от курения и злоупотребления алкоголем, использование средств, повышающих физиологические защитные силы организма. При выраженных формах заболевания необходима комплексная терапия с широким использованием медикаментозных средств.
Следует проводить терапию, направленную на ликвидацию очагов инфекции: одонтогенной; хронических тонзиллита, гайморита, пневмонии, холецистита и др. Больные сахарным диабетом должны получать адекватное противодиабетическое лечение.
Если лечение проводится нерегулярно, то риск развития острых нарушений мозгового кровообращения, а также дисциркуляторной энцефалопатии значительно увеличивается. Так, по нашим данным, основанным на семилетнем проспективном наблюдении 160 больных АГ с НПНКМ (мужчины 40-49 лет), преходящие нарушения мозгового кровообращения (ПНМК) развивались в 2,6, а мозговой инсульт — в 3,5 раза чаще у не лечившихся или лечившихся нерегулярно, чем у лечившихся регулярно и соблюдавших врачебные рекомендации.
Медикаментозные методы лечения и профилактики обострений основного сосудистого заболевания
Вегетососудистая дистония. Терапия проводится в соответствии с принципами деления вегетативных расстройств по симпатикотоническим и ваготоническим проявлениям.
При повышенном симпатическом тонусе рекомендуют диету с ограничением белков и жиров, теплые ванны, углекислые ванны. Применяют центральные и периферические адренолитики, ганглиоблокаторы. Назначают альфа-адреноблокаторы: пирроксан, редергин, дигидроэрготамин, и бета-адреноблокаторы: анаприлин, атенолол, тенормин, обладающие сосудорасширяющим и гипотензивным действием.
В случаях недостаточности симпатического тонуса показаны диета, богатая белками; солевые и радоновые ванны, прохладный душ. Эффективны препараты, стимулирующие центральную нервную систему: кофеин, фенамин, эфедрин и др. Улучшают симпатическую активность настойки лимонника по 25-30 капель в день, пантокрина — 30-40 капель, женьшеня — 25-30 капель, заманихи — 30-40 капель, препараты кальция (лактат или глюконат по 0,5 г три раза в день); аскорбиновая кислота — 0,5-1,0 г три раза; метионин — 0,25-0,5 г два-три раза в день.
При повышении парасимпатической активности рекомендуют малокалорийную, но богатую белками диету, хвойные ванны (36оС). Используют средства, повышающие тонус симпатической системы. Применяют препараты белладонны, антигистаминные, витамин В6.
При слабости парасимпатической системы положительный эффект оказывают: пища, богатая углеводами; кофе; крепкий чай; сульфидные ванны низкой температуры (35оС). Повышают парасимпатический тонус холиномиметические препараты, ингибиторы холинэстеразы: прозерин по 0,015 г внутрь и по 1 мл 0,05%-ного раствора в инъекциях, местинон по 0,06 г., препараты калия: хлорид калия, оротат калия, панангин. Иногда применяют малые дозы инсулина.
Разделение синдрома вегетососудистой дистонии по характеру проявлений (преобладание симпатической или парасимпатической активности) не всегда возможно. Поэтому в практике нашли широкое применение препараты, воздействующие на оба периферических отдела вегетативной нервной системы, обладающие как адрено-, так и холиномиметической активностью: беллоид, белласпон, препараты эрготамина.
Артериальная гипертония. Лечебно-профилактические мероприятия при АГ прежде всего должны быть направлены на устранение или коррекцию факторов риска, способствующих развитию заболевания, таких как психоэмоциональные перенапряжения, курение, злоупотребление алкоголем, избыточная масса тела, малоподвижный образ жизни, сахарный диабет.
Необходимо ограничить употребление поваренной соли до 4-6 г в сутки (1/2 чайной ложки), а при тяжелой АГ — даже до 3-4 г.
В настоящее время для медикаментозного лечения АГ наиболее эффективными считаются пять классов гипотензивных препаратов: бета-блокаторы, ингибиторы ангиотензин-превращающего фермента (АПФ), диуретики, антагонисты кальция и альфа-блокаторы. В докладе Комитета экспертов ВОЗ даны рекомендации по выбору первоначального препарата для лечения АГ, представленные в табл.
Эффективны комплексные гипотензивные средства: бринальдикс, адельфан-эзидрекс, трирезид К и др. Однако они обладают побочными негативными действиями своих ингредиентов: резерпина, тиазидовых диуретиков и гидралазинов. Эти средства можно применять в период обострения АГ, но в дальнейшем необходимо подобрать индивидуальную схему поддерживающего лечения. Терапию при злокачественной форме АГ нужно начинать в стационаре.
Не следует многократно повышать дозу первоначально действенного препарата, если он перестает надежно контролировать уровень АД. Если назначенное лекарство оказалось малоэффективным, его нужно заменить. Лучше добавить небольшие дозы другого гипотензивного средства, чем увеличивать дозу первого. Эффективность лечения повышается при использовании следующих комбинаций препаратов:
Если у больных с умеренной и тяжелой АГ АД не снижается в течение месяца комбинированного лечения двумя или тремя препаратами, ее принято считать резистентной. Причины резистентности весьма разнообразны: нерегулярный прием лекарств, назначение недостаточно высоких доз, неэффективная комбинация препаратов, прием прессорных средств, увеличение плазмы крови, наличие симптоматической гипертонии, избыточное потребление поваренной соли и алкоголя. Известен эффект «белого халата» (повышение АД у больного в присутствии врача или медицинской сестры), который может создать впечатление резистентности. Наиболее серьезными причинами резистентности к терапии являются увеличение плазмы крови в ответ на снижение АД, заболевания почек и побочные действия лекарств. У ряда больных резистентной гипертонией положительный эффект дают применение петлевых диуретиков, комбинации ингибиторов АПФ и антагонистов кальция.
Считается, что гипотензивный эффект достигнут при стойком снижении АД у больных мягкой АГ (140-179/90-104 мм рт. ст.) до нормального или пограничного уровня (ниже 160/95 мм рт. ст.), а при умеренной и выраженной АГ (180/105 мм рт. ст. и выше) — на 10-15% от исходных показателей. Резкое снижение АД при атеросклеротическом поражении магистральных сосудов головы, которое встречается у 1/3 больных АГ, может ухудшить кровоснабжение мозга.
После подбора терапии больного приглашают на осмотры до тех пор, пока не будет достигнуто адекватное снижение АД. Это позволяет убедиться, что АД удерживается на оптимальном уровне, а факторы риска находятся под контролем. Постепенное и осторожное снижение АД существенно уменьшает побочные явления и осложнения гипотензивной терапии.
При достижении стабильного снижения АД больного следует приглашать на повторные осмотры с интервалом 3-6 мес. Гипотензивная терапия, как правило, проводится неопределенно долго. Однако после длительного адекватного контроля уровня АД допускается осторожное снижение дозы или отмена одного из комбинируемых препаратов, особенно у лиц, строго придерживающихся рекомендаций по немедикаментозному лечению.
Атеросклероз. Для лечения больных атеросклерозом необходимо прежде всего выявить высокий уровень холестерина сыворотки крови (ХС) и провести мероприятия по его коррекции.
Основные препараты, используемые при лечении больных НПНКМ
Особая роль принадлежит средствам, обладающим сочетанным действием на кровоснабжение и метаболизм мозга, а также на центральную гемодинамику и реологические свойства крови. Применяют кавинтон (винпоцетин) по 0,005 г; циннаризин (стугерон) — 0,025 г; ксантинола никотинат (теоникол, компламин) — 0,15 г; пармидин (ангинин) — 0,25-0,5 г; сермион — 0,005-0,03 г; танакан — 0,04 г — три-четыре раза в день.
В случаях повышения тонуса мозговых сосудов при спастическом типе РЭГ рекомендуют спазмолитические и вазоактивные средства. Целесообразно назначение эуфиллина по 0,15 г три раза в день. В результате, как правило, улучшается общее состояние больных, уменьшаются или проходят головные боли, головокружение, отмечаются положительные изменения реографических и допплеросонографических показателей. Больным с неустойчивым тонусом сосудов назначают беллоид, белласпон, грандаксин. При гипотонии сосудов мозга и признаках венозной недостаточности рекомендуют стимулирующие препараты: элеутерококк, заманиху, корневище левзеи, пантокрин, дуплекс, женьшень, настойку китайского лимонника, алоэ — и венотонизирующие: троксевазин, эскузан, анавенол, венорутон.
В связи с тем что сосудистому заболеванию мозга нередко предшествуют или к нему присоединяются нарушения сердечной деятельности, больным по показаниям назначают средства, улучшающие коронарный кровоток, противоаритмические, сердечные гликозиды. При функциональных расстройствах сердечной деятельности у больных НПНКМ благоприятное действие оказывает боярышник в виде жидкого экстракта по 20-30 капель четыре раза в день.
В настоящее время из средств, положительно влияющих на реологические свойства свертывающей и противосвертывающей системы крови, лучше всего изучен и наиболее широко применяется аспирин. В качестве основного недостатка этого препарата отмечается раздражающее действие на желудочно-кишечный тракт. Поэтому его рекомендуют принимать однократно в суточном количестве не более 1 мг на 1 кг веса. С этой целью применяют также трентал по 0,1 г, дипиридамол — 0,25 г и метиндол — 0,025 г три раза в день. Кроме того, указанные средства предупреждают дестабилизацию клеточных мембран нейронов при ишемии мозга, подавляют отек и набухание эндотелия, увеличивают приток крови к мозгу, облегчают венозное кровообращение и оказывают спазмолитическое действие, что в результате определяет их эффективность для вторичной профилактики и лечения сосудистых заболеваний мозга. Антиагрегантным действием обладает и ряд других препаратов: папаверин, но-шпа, альфа- и бета-адренергические блокаторы и др.
При нарушениях памяти, внимания, для повышения психической и двигательной активности рекомендуется лечение ноотропилом (пирацетамом) по 0,4 г, энцефаболом (пиридитолом) по 0,1 г, аминалоном по 0,25-0,5 г два-четыре раза в день, инъекциями церебролизина по 5,0 мл внутривенно или внутримышечно и другими средствами подобного действия.
При наличии проявлений неврозоподобного синдрома назначают транквилизаторы: хлозепид (элениум, напотон) по 0,005-0,01 г три-четыре раза, сибазон (седуксен, реланиум) — 0,005 г один-два раза, феназепам — 0,00025-0,0005 г и мезапам (рудотель) — 0,005 г два-три раза в день; седативные средства: препараты валерианы, пустырника, настойку пиона и др.
Из методов физической терапии чаще всего используется электрофорез лекарственных средств по рефлекторно-сегментарному (воротниковому) трансорбитальному методу Бургиньона, а также по общей методике воздействия как обычным, так и биполярным способом. Отмечены благоприятные результаты при лечении электрофорезом 10%-ного раствора ацетилсалициловой кислоты и 7,5-10%-ного раствора оротата калия из среды 40-50%-ного универсального растворителя — димексида по методике общего воздействия: продольно на позвоночник с наложением электродов на воротниковую, межлопаточную и пояснично-крестцовую области — на курс 8-12 процедур.
Новым методом лечения является электрофоретическое введение стугерона в форме трансцеребрального рефлекторного йонофореза 0,5%-ного его раствора. У больных с цефалгиями перед этим целесообразно провести три-четыре процедуры эндоназального электрофореза 0,1%-ного раствора дигидроэрготамина.
Для больных с нарушениями венозного оттока предложен метод трансцеребрального электрофореза 5%-ного раствора троксевазина. Комбинированное применение электрофоретического и перорального введения стугерона и троксевазина позволяет воздействовать на все звенья сосудистой системы мозга: артериальный тонус, микроциркуляцию и венозный отток.
При головных болях, вегетативных нарушениях применяется электрофорез йода по методу воротникового воздействия, а при невротических состояниях и гипостении — электрофорез новокаина. Биполярный электрофорез йода и новокаина рекомендуют при неврастеническом синдроме, наклонности к головокружениям, болях в области сердца. При нарушениях сна, повышенной общей возбудимости используют электрофорез брома и йода, диазепама или магния по методике Вермеля, электросон. Положительное воздействие оказывает электрофорез далларгина на рефлексогенные зоны С-4 — T-2 и T-8 — L-2.
Следует подчеркнуть, что лекарственная терапия имеет ряд ограничений: побочные действия, аллергические реакции, привыкание к препаратам, снижение их эффективности при длительном применении. Кроме того, нужно учитывать возможность полной нечувствительности больных к тому или иному препарату. Поэтому большое значение имеет использование немедикаментозных методов лечения.
Немедикаментозные методы профилактики и лечения при НПНКМ
В комплекс лечения включают диетотерапию, активный двигательный режим, утреннюю гигиеническую гимнастику, лечебную физкультуру, плавание в бассейне, спортивные игры. При избыточной массе тела проводят подводный душ-массаж. При сопутствующем остеохондрозе шейного отдела позвоночника — массаж воротниковой зоны.
Успешно применяются воздействие переменным низкочастотным магнитным полем, синусоидальные модулированные токи на рефлексогенные зоны и мышечные группы шейной, воротниковой и поясной областей, верхних и нижних конечностей с учетом суточных биоритмов.
В практическое здравоохранение все шире внедряются методы рефлексотерапии: иглоукалывание, прижигание, электроакупунктура, воздействие лазерным излучением. У больных НПНКМ в результате лечения этими методами значительно улучшается общее состояние, уменьшаются или исчезают субъективные нарушения, отмечается положительная динамика показателей РЭГ и ЭЭГ, что объясняется нормализующим влиянием рефлексотерапии на обменные процессы, повышением физического и психического тонуса, устранением вегетососудистых нарушений. При повышенном тонусе церебральных вен рекомендуют курс СВЧ-облучения (8-12 сеансов) на рефлексогенные зоны и точки акупунктуры.
Как универсальный компонент патогенетической терапии при сосудистых заболеваниях нервной системы рассматривают гипербарическую оксигенацию, которая позволяет добиться стабилизации патологического процесса, сократить сроки лечения и улучшить прогноз. В процессе баротерапии улучшаются общее состояние больных, сон, память, уменьшаются явления астенизации, психоэмоциональные нарушения, головные боли, головокружения, вегетативные расстройства.
Стойкий клинический эффект и длительные ремиссии наблюдались у больных НПНКМ, получавших комплексное лечение с включением гипербарической оксигенации, иглорефлексотерапии и лечебной физкультуры.
Рекомендуют широкое использование бальнеотерапии.
Как в качестве самостоятельного метода, так и в комплексе с другими видами физиотерапии и лекарственными средствами применяется гидроаэроионотерапия. Целесообразно использовать оксигенотерапию в виде кислородных коктейлей, что оказывает общее стимулирующее действие и улучшает функциональное состояние нервной системы. Сочетание аэроионотерапии и оксигенотерапии дает больший клинический эффект: улучшаются самочувствие, память, исчезают головные боли, уменьшаются вестибулярные и эмоционально-волевые нарушения. Эти методы лечения можно использовать не только в стационаре, но и в поликлинике.
Предложен способ тренирующей терапии прерывистым гипоксическим воздействием: ингаляцией воздушно-азотной смеси, содержащей 10% кислорода.
При неврозоподобном синдроме, который выявляется у значительного числа больных НПНКМ, рекомендуется психотерапия. Ее важнейшими задачами являются выработка у больных правильного отношения к заболеванию, адекватной психологической адаптации к окружающей среде, повышение эффективности медицинской и социальной реабилитации. Психотерапия предполагает активное участие больного во всех ее этапах и должна начинаться уже с первого приема. В случаях выраженного проявления церебрастении успешно применяется гипнотерапия. Эффективно использование аутогенной тренировки. Наилучшие результаты достигаются при сочетанном лечении транквилизаторами и антидепрессантами с психотерапией и аутогенной тренировкой.
Большое значение имеет комплексная поэтапная терапия больных НПНКМ, которая включает лечение в стационаре, санаторно-курортное лечение и амбулаторно-поликлиническое наблюдение. Санаторно-курортное лечение наиболее целесообразно проводить в санаториях сердечно-сосудистого или общего типа, не меняя климатического пояса, поскольку из-за снижения адаптационных возможностей больные НПНКМ значительное время тратят на акклиматизацию, что укорачивает период активного лечения, снижает стойкость его эффекта, а в некоторых случаях даже ухудшает состояние.
Основным лечащим и диспансерным врачом у больных НПНКМ должен быть участковый (цеховый) врач-терапевт. На невропатолога возлагаются обязанности консультанта этих пациентов. Диспансерное наблюдение и курсовое лечение, продолжительность которого составляет 1-2 месяца, должны осуществляться не реже двух раз в год (обычно весной и осенью).
Трудоспособность
Больные НПНКМ, как правило, трудоспособны. Однако иногда они нуждаются в облегченных условиях труда, которые рекомендует ВКК: освобождение от ночных смен, дополнительных нагрузок, коррекция режима труда. Больные направляются на ВТЭК в случаях, когда условия работы противопоказаны им по состоянию здоровья. Они не могут трудиться в кессоне, при измененном атмосферном давлении, в горячих цехах (сталевар, кузнец, термист, повар), при постоянном значительном психоэмоциональном или физическом перенапряжении. Если перевод на другую работу связан со снижением квалификации, то устанавливается III группа инвалидности.