химия терапия при опухоли головного мозга
Злокачественные опухоли головного мозга
Злокачественные новообразования центральной нервной системы очень агрессивны, быстро растут и разрушают ткань мозга. При их обнаружении операцию по удалению опухоли желательно проводить как можно раньше, до развития тяжелого необратимого неврологического дефицита.
Нейрохирурги клиники НАКФФ проводят сложнейшие операции при глиобластомах и других новообразованиях ЦНС высокой степени злокачественности. Врачи могут безопасно удалить даже глубоко залегающие опухоли, так как перед вмешательством они выявляют функционально важные зоны мозга, чтобы не повредить их во время операции.
Какие бывают злокачественные опухоли мозга
Самые распространенные опухоли мозга – это глиомы и менингиомы. Первая группа развивается из мозговой ткани, вторая – из оболочек мозга. Большинство менингиом – доброкачественные, и только 1% приходится на менингиомы третьей, самой высокой степени злокачественности. В то же время большинство глиом – злокачественные.
Самая частая опухоль этого типа – глиобластома. Для глиом выделяют 4 степени злокачественности новообразований, и глиобластома имеет четвертую, самую высокую степень. Проблема её лечения заключается в том, что она часто располагается в глубине мозга, и до неё трудно добраться. К тому же, опухоль не имеет четкой границы: она врастает в окружающие здоровые ткани.
Даже самые агрессивные новообразования обычно не дают метастазов за пределы центральной нервной системы. Но они распространяются в пределах мозга, а при росте разрушают окружающие здоровые ткани.
На практике нейрохирургу, который оперирует взрослых пациентов, среди всех злокачественных новообразований чаще всего приходится сталкиваться с глиобластомой или метастатическими опухолями рака другой локализации. Большинство других образований встречаются очень редко или имеют доброкачественную природу.
Как лечат опухоли мозга?
Чаще всего для лечения опухолей мозга используют три метода:
Самый эффективный способ лечения – хирургическая операция. Два других способа имеют множество недостатков, поэтому применяются как дополнительные методики или у пациентов с противопоказаниями к операции.
Проблема медикаментозного лечения состоит в том, что большинство препаратов плохо проникают через гематоэнцефалический барьер. К тому же, успехи лечения далеко не самые выдающиеся. При глиобластоме стандартный препарат для химиотерапии увеличивает продолжительность жизни человека в среднем на 10 недель.
Методы лучевой терапии часто позиционируются как альтернатива операции. Пациентов впечатляют и названия процедур: Кибернож, Гамма-нож. Складывается впечатление, что опухоль «вырезается» из головы радиацией, быстро и безболезненно. Но правда заключается в следующем:
В силу этих причин лучевая терапия всё же не считается основным радикальным методом лечения злокачественных новообразований мозга и не может использоваться как альтернатива операции. Облучение должно дополнять, а не замещать нейрохирургический метод лечения. Если лучевая терапия применяется вместо, а не в дополнение к операции, то такие случаи связаны исключительно с глубоким залеганием опухоли, до которой нельзя добраться из-за угрозы тяжелого неврологического дефицита, или наличием медицинских противопоказаний к операции.
Преимущества хирургического вмешательства:
Как проводят операцию?
Нейрохирургические операции по удалению злокачественных опухолей – сложные и высокотехнологичные. Врачу важно удалить новообразование полностью, и при этом не повредить функционально значимые зоны мозга.
Процедуры, определяющие успех операции, часто начинаются ещё до её начала. Врачи проводят тщательное обследование пациента, особенно при глубоком залегании опухоли. Они определяют границы опухоли при помощи ПЭТ или функциональной МРТ. Затем требуется выявление функционально значимых зон, чтобы обойти их, рассекая мозговую ткань. Для этого используется функциональное картирование и электрофизиологическое исследование. При необходимости исследования могут быть выполнены прямо во время операции.
Операция проводится под стереотаксическим контролем. Стереотаксис позволяет врачу идеально ориентироваться внутри черепа пациента. Классический вариант подразумевает использование жесткой рамы, которую фиксируют винтами к надкостнице. В последние годы получили распространение системы безрамного стереотаксиса.
Важнейшая задача нейрохирурга, определяющая успех операции, состоит в полном удалении опухоли. Но для этого её нужно отличить от здоровой ткани. Выглядят они практически одинаково. Чтобы найти границы новообразования, используется флуоресцентная диагностика и лазерная спектроскопия. Врач использует вещество, которое поглощается патологическими клетками и заставляет их светиться.
Немецкое исследование с участием 350 пациентов показало, что без флуоресцентной диагностики только у 1 из 3 пациентов глиобластому удается удалить полностью, а при её использовании – в 2/3 случаев. Вероятность отсутствия рецидива опухоли в течение 6 месяцев после операции увеличивается в 2 раза.
Хирургия головного мозга
(495) 506 61 01
Химиотерапия при опухолях головного мозга
Химиотерапия является одним из трех основных методов лечения злокачественных опухолей. Принцип химиотерапии заключается в том, что пациенту назначаются особые цитотоксические препараты, которые губительно действуют на быстроразмножающиеся клетки, к которым и относятся опухолевые клетки. К химиопрепаратам относится много групп химических веществ, каждая из которых обладает своим механизмом действия, конечной целью которого является разрушение клеток опухоли.
Такая особенность опухолевых клеток, как усиленный метаболизм и размножение ввиду генетических мутаций в них, играет важную роль в применении цитостатиков. Это делает их чувствительными к химиопрепаратам. Однако, кроме опухолевых клеток в организме имеются и другие здоровые клетки, которые также характеризуются повышенным метаболизмом и усиленным размножением. Это клетки эпителия, а также клетки костного мозга, которые отвечают за кроветворение и иммунную систему. Химиопрепараты влияют, таким образом, не только на опухоль, но и на здоровые ткани, что приводит к известным побочным реакциям.
Обычно, химиотерапия при опухолях мозга проводится курсами, которые чередуются перерывами. Эти перерывы нужны для организма как передышка, чтобы он мог восстановиться. Следует отметить, что химиопрепараты применяются каждый для определенных типов опухолей и поэтому химиотерапия назначается обычно после оперативного вмешательства, которое позволяет определить гистологический тип опухоли мозга. Если же химиотерапия проводится без предварительной операции на мозге, то для определения гистологического типа опухоли делается т.н. стереотаксическая биопсия мозга. При этом химиотерапия может проводиться различными способами, который выбирает лечащий врач.
При системном введении химиопрепарата пациент получает лекарство внутривенно или перорально в виде таблеток. Такой способ характеризуется наибольшим риском побочных эффектов. При регионарном введении химиопрепаратов лекарственное средство вводится непосредственно в артерии, которые кровоснабжают область расположения опухоли.
При интратекальном способе химиопрепарат вводится путем люмбальной пункции в цереброспинальный ликвор. Таким образом, цитостатик действует непосредственно на ткань мозга. Этот способ используется при данном расположении опухолей. В случае, когда химиопрепарат вводится непосредственно в ткань опухоли, говорят об интерстициальном методе химиотерапии.
В химиотерапии опухолей мозга также применяется т.н. конвекционный методе доставки препарата в опухоль. При этом в саму ткань опухоли или окружающие мягкие ткани имплантируется тонкий пластиковый катетер, через который постоянно медленно вводятся необходимые химиопрепараты, обычно в течение нескольких дней.
Обычно при химиотерапии используется схема, в которой применяется несколько цитостатических препаратов в определенной дозе в течение определенного времени.
Среди химиопрепаратов, которые применяются в лечении опухолей мозга, широкое применение на сегодня нашли такие средства, как Темозоломид и Кармустин, а также препараты на основе платины цисплатин (Платинол) и карбоплатин (Параплатин). Кроме указанных средств, исследователи сегодня изучают возможность применения и других цитостатиков для лечения опухолей мозга.
Среди побочных эффектов химиотерапии опухолей мозга можно отметить все те эффекты, которые встречаются при химиотерапии других видов злокачественных опухолей.
Как уже было сказано, химиопрепараты губительно действуют на клетки с усиленным метаболизмом и быстрым ростом. К таким клеткам относятся не только опухолевые клетки, но и клетки здоровых тканей: клетки эпителия ЖКТ и волосяных луковиц, а также клетки костного мозга, который относится к кроветворной системе. Дело в том, что эпителий в организме у нас постоянно обновляется, а клетки костного мозга так же постоянно обновляют состав форменных элементов крови. С этим-то и связаны все побочные эффекты химиотерапии.
В костном мозге происходит созревание форменных элементов крови: эритроцитов, лейкоцитов и тромбоцитов. Эти клетки характеризуются интенсивным развитием, в результате чего их созревание во время химиотерапии страдает. Возникает анемия, лейкоцитопения и тромбоцитопения. Это проявляется слабостью, быстрой утомляемостью, плохим аппетитом, шумом в ушах. Кожа становится бледной.
Лейкоцитопения ведет к снижению защитных сил организма и иммунитета. Могут легко присоединяться всякие инфекции. Профилактика инфекционных осложнений химиотерапии заключается в соблюдении пациентом личной гигиены и контакта с инфекционными больными. При развитии инфекции у таких больных в обязательном порядке используются антибиотики. В случае возникновения апластической анемии применяются т.н. эритропоэтины, которые стимулируют созревание эритроцитов в костном мозге. Для стимуляции роста белых клеток крови используются т.н. колониестимулирующие факторы, среди которых известен такой препарат, как филграстим.
При снижении уровня тромбоцитов отмечается повышенная кровоточивость. На коже возникают т.н. петехии в виде мелкоточечной сыпи. При выраженной тромбоцитопении проводятся трансфузии тромбоцитарной массы.
Кроме влияния на указанные ткани и клетки, цитостатики влияют на эпителий органов ЖКТ, что проявляется тошнотой, рвотой, чувством дискомфорта в животе, вздутием и диареей.
Химиопрепараты негативно влияют и на репродуктивную систему как женщин, так и мужчин, приводя к вторичному бесплодию. У женщин химиотерапия может привести к появлению симптомов менопаузы в виде приливов жара, сухости во влагалище и нарушений менструального цикла.
Химиотерапия оказывает неблагоприятное воздействие и на функцию почек, а также печени. Для снижения негативных эффектов на эти органы при химиотерапии рекомендуется пить больше жидкости, чтобы быстрее вывести токсические вещества из организма.
(495) 506-61-01 — где лучше оперировать головной мозг
Кибер-нож в лечении опухолей головного мозга
На базе нейрохирургической клиники Аахенского Университета с 1998 года применяется специальная методика гамма-кобальтового облучения для лечения опухолей и сосудистых новообразований головного мозга. Подробнее
Национальный Онкоцентр Им. Сураски является интегральной частью крупнейшей муниципальной мед. клиники Сураски и предоставляет передовое лечение опухолей мозга всех видов.Подробнее
Химия терапия при опухоли головного мозга
а) Общие рекомендации по химиотерапии опухоли головного мозга:
• Перед началом лечения должны быть проверены гематологические показатели, а также функция печени и печек.
• При наличии инфекции химиотерапия не проводится.
• Для женщин: исключить беременность; для мужчин и женщин: консультации в отношении контрацепции.
• Пациент должен лечиться у специалиста с опытом работы в химиотерапии.
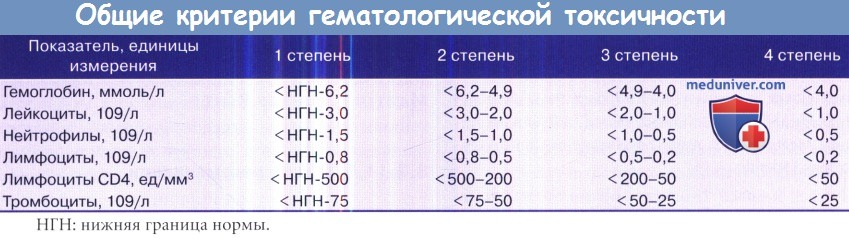
• При расчете токсичности обращаться к общим критериям побочных эффектов, в таблице ниже приведены данные о гематологической токсичности.
• Доза определяется с учетом площади поверхности тела (ППТ). У пациентов с расчетной поверхностью тела >2,1 ППТ следует воспринимать как 2,1.
1. Протокол лучевого лечения с адъювантной и сопутствующей терапией темозоламидом глиом высокой степени злокачественности (протокол EORTC 26981). Лечение состоит из двух этапов: сопутствующей лучевой и химиотерапии темозоломидом, затем шесть циклов классического режима химиотерапии темозоломидом по 1-5 раз в день в течение четырех недель.
I. Темозоламид в сопутствующей фазе. Лучевая терапия (ЛТ) 60 Гр (30×2 Гр) в сочетании с темозоломидом (ежедневно в дозе 75 мг/м 2 ). Предполагаемая продолжительность: шесть недель; сопутствующий прием темозоломида не должен превышать семи недель.
• Прием темозоломида за один час до начала сеанса ЛТ в будние дни. В выходные дни и другие дни без ЛТ прием темозоломида продолжается и проводится в первой половине дня.
• Рекомендуется за час до первой и второй дозы темозоломида прием противорвотного средства (например, 8 мг ондансетрона, 1 мг гранисетрона). При сопутствующей химиолучевой терапии с низкими дозами ТМЗ противорвотная профилактика необходима лишь изредка.
• Продолжительность лечения:
— При впервые диагностированной глиоме после сопутствующей химиолучевой терапии не более шести циклов адъювантной терапии.
— При рецидиве заболевания до прогрессирования заболевания или 12 циклов.
• С первого по пятый день стандартного лечения темозоломидом рекомендуется прием противорвотных средств, так как тошнота и рвота могут быть очень серьезными, особенно в первый и второй дни. Так как 5-НТ 3-антагонисты могут вызвать запор, рекомендуется давать ондансетрон (8 мг) или гранисетрон (1 мг) один или два раза в день 1-3 дня, только при необходимости и с приемом за один час до темозоломида.
• Перед каждым циклом лечения темозоломидом должен быть получен общий анализ крови (ОАК) (за 72 ч). Контроль проводится на 21 день первого цикла или после увеличения дозы.
• Снижение дозы на один уровень (обычно примерно на 21-й день) в случае гематологической токсичности 3 или 4 класса или в начале следующего цикла при задержке более трех недель из-за токсичности.
• Лечение прекращают в случае 3-й степени кардиотоксичности, 4-й степени гематологической токсичности или 3-й степени негематологической токсичности в дозе 100 мг/м 2 в день (500 мг/м 2 за цикл), или негематологической токсичности 4-го класса (за исключением тошноты и рвоты).
• Следующий цикл может начаться, если уровень нейтрофилов > 1,5 х 10 9 /л и/или тромбоцитов >100х 10 9 /л в 29 день = 1-й день следующего цикла, и при отсутствии негематологической токсичности (за исключением алопеции):
— В противном случае — задержка следующего цикла до возникновения указанного состояния.
— Если вопрос не решен в течение трех недель, следует прекратить лечение.
IV. Альтернативные режимы дозирования темозоламида:
• Используются и некоторые другие схемы темозоломида с более плотной дозировкой в течение нескольких дней каждые четыре недели. Наиболее часто используются:
— Неделя через неделю: чередуется одна неделя ежедневного приема и одна неделя отдыха.
• Уровни дозировки: 100 мг/м 2 ежедневно, 125 мг/м 2 ежедневно, 150 мг/м 2 ежедневно.
— Три недели через неделю: три недели ежедневного приема, затем одна неделя отдыха.
• Используется дозировка: 75 мг/м 2 ежедневно, 100 мг/м 2 ежедневно.
• Тошнота и рвота часто менее выражены, чем при стандартном режиме дозирования.
• Усталость, недомогание и т. д., могут быть более выраженными, усиливаясь после новых циклов.
• Лимфопения является побочным эффектом всех таких режимов. Рекомендуется мониторинг CD4+, с профилактикой ПЦП если CD4+ ниже 200/мм 3 (и продолжение до восстановления уровня > 200/мм 3 ).
• Начать с низкой дозы, если перед этим проводилась химиотерапия.
• Уменьшить дозировку и начать новый цикл в соответствии с приведенными рекомендациями в течение 1-5 дней 4 раза в неделю.
• Рассмотреть возможность перехода на стандартное лечение в случае изнурительных общих симптомов.
• Рекомендуемая продолжительность лечения при рецидивирующих опухолях: до одного года.
в) PCV химиотерапия опухоли головного мозга:
• Каждый курс стандартной химиотерапии PCV состоит из:
— CCNU (ломустин), 110 мг/м 2 перорально в первый день с противорвотными средствами (метоклопрамид или домперидон, в случае необходимости ондансетрон или аналогичные средства).
— Прокарбазин (натулан), 60 мг/м 2 внутрь в течение 14 дней каждого цикла на 8-21 дни.
— Винкристин, 1,4 мг/м 2 на 8 и 29 день каждого цикла (максимум 2 мг).
• Полный курс терапии повторяется каждые шесть недель (42 дня), максимум шесть циклов.
• Эффективность винкристина была поставлена под сомнение, и многими врачами этот препарат не включается в схему.
• Токсичность проявляется в основном кумулятивной миелосупрессией, тошнотой, алопецией, повышенной утомляемостью, потерей аппетита, нарушением функции печени и полинейропатией (винкристин).
— Прокарбазин может вызвать аллергическую реакцию кожи.
— Прием тирамин-содержащих продуктов, таких как красное вино, сыр, бананы во время лечения прокарбазином, может вызвать гипертонический криз (эффект моноаминоксидазы). Пациенты должны быть предупреждены о дисульфирам-эффекте после приема алкоголя (головная боль, слабость и потливость).
• Тошнота и рвота, вызванные схемой PCV, как правило, контролируются обычными противорвотными средствами, такими как домперидон или метоклопрамид.
• Контроль показателей:
— Гематологические параметры на 1, 8 и 43 сутки (= 1-й день следующего цикла).
— Биохимический анализ перед началом каждого цикла.
• Модификации дозировки:
— Если схема используется после предыдущей химиотерапии темозоломидом в сочетании с облучением: уменьшить дозу CCNU и прокарбазина на 25%.
— При снижении лейкоцитов 9 /л или тромбоцитов 9 /л в первый день:
• CCNU задерживается на одну неделю.
В случае последующей лейкопении 9 или тромбоцитопении 9 лечение откладывается еще на неделю. Если лейкопения или тромбопения сохраняются после этого, необходимо прекратить химиотерапию.
• В случае задержки цикла на две недели из-за токсичности снизить дозировку CCNU и прокарбазина на 25%.
— Уменьшить дозу CCNU и прокарбазина на 25% в случае 3/4 класса лейко- или гранулоцитопении, или в случае 3/4 класса тромбоцитопении.
— В случае уровня лейкоцитов 9 /л или тромбоцитов 9 /л на 8-й день:
• Винкристин и прокарбазин откладывают на одну неделю. В случае стойкой лейкопении ( 9 ) или тромбоцитопении ( 9 ) лечение откладывается еще на неделю. Если гематологические нарушения сохраняются и далее, лечение прекращается.
— Уменьшить дозу CCNU и прокарбазин на 25% в случае 3 степени гематологической токсичности и 2 или 3 степени негематологической токсичности.
— Прекращение лечения в случае:
• 3 степени кардиотоксичности.
• 4 степени гематологической токсичности или 3 степени негематологической токсичности, несмотря на снижение дозы.
• Любой негематологической токсичности 3 степени (за исключением тошноты и рвоты).
— В случае аллергической реакции кожи прием прокарбазина должен быть прекращен.
— Винкристин отменяется в случае 2 степени нейротоксичности.
— В связи с кумулятивной миелосупрессией CCNU продолжение лечения при маргинальных гематологических нарушениях приведет к более высокой токсичности в последующих циклах.
— Как правило, печеночные нарушения постепенно уменьшаются.
г) BCNU (кармустин) для химиотерапии опухоли головного мозга. 60 мг/м 2 в 1-3 дни каждые 8 недель:
• Наиболее распространенной схемой для BCNU (кармустина) является 130-200 мг/м 2 каждые 6 недель, но 8-недельный прием в дозе 80 мг/м 2 оказался эффективным в исследовании на 40 пациентах с глиомами высокой степени злокачественности. Исследование пациентов с мультиформной глиобластомой с предварительным лечением темозоломидом (в комбинации химиолучевой терапии) показало значительную гематологическую токсичность при такой дозировке и снижении дозировки до 60 мг/м 2 в 1-3 день восьминедельного цикла.
• Основные побочные эффекты: гематологическая токсичность, токсическое поражение печени, тошнота и легочная токсичность.
• BCNU вводят внутривенно с первого по третий день в дозе 60 мг/м 2 /день (доза на цикл 180 мг/м 2 ) каждые 8 недель. Назначают противорвотные средства (метоклопрамид, домперидон).
• Противопоказания: заболевания легких в анамнезе, так как возможно действие на функцию легких; необходимо оценить функцию по диффузионной емкости оксида углерода, которая должна быть выше 60% прогнозируемого значения.
• Контроль показателей:
— Гематологические параметры на 21, 28, 35, 42, 65 сутки (= первый день следующего цикла).
— Биохимический анализ перед началом каждого цикла.
• Модификации дозировки:
— В случае количества лейкоцитов 9 /л или тромбоцитов 9 /л в первый день—задержка до восстановления.
• Если гематологическая токсичность не регрессирует в течение двух недель или повторяется токсичность 2 степени в ходе последующего цикла, следует прекратить лечение.
— В случае гематологической токсичности 3-й степени дозировка для следующего цикла снижается на 25%.
— В случае гематологической токсичности 4 степени дозировка для следующего цикла снижается на 50%.
— При негематологической токсичности:
• Не начинать следующий цикл, пока вся токсичность (за исключением алопеции) не регрессирует до 1 степени или менее.
• При печеночной токсичности 2 степени дозировка следующего цикла снижается на 25% после возвращения к нормальным показателям.
• При печеночной токсичности 3 степени дозировка следующего цикла снижается на 50% после возвращения к нормальным показателям.
• В случае легочной токсичности 3 или 4 степени лечение следует прекратить.
• В случае любой негематологической токсичности 4 степени или непеченочной токсичности 3 степени (за исключением тошноты, рвоты и алопеции) лечение необходимо прекратить.
• Если негематологическая токсичность не восстанавливается в течение первого месяца или если негематологическая токсичность повторяется в последующем цикле до степени >2, следует прекратить лечение.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Мифы и правда о химиотерапии
Миф 1: химиотерапия малоэффективна
В поддержку этого мнения ссылаются на цитируемое в интернете исследование профессора Гарвардского университета Джона Кэрнса, якобы опубликованное в «Scientific American» и в «Журнале клинической онкологии» в 2004 году, о том, что на самом деле химиотерапия помогает лишь 2,3-5% случаев (комментарий об источнике см. в конце нашего материала). Зато именно «химия» вызывает «сопротивление опухоли, которое выражается в метастазах».
Чтобы говорить об эффективности химиотерапии «при раке», надо уточнить, что понятие «онкология» включает в себя множество разных заболеваний.
Есть нейробластома у детей или хорионкарцинома матки. Их можно полностью излечить именно с помощью химиотерапии. Излечение означает, что у человека нет рецидивов в течении 5 лет.
Есть опухоли, высокочувствительные к химиотерапии – саркома Юинга, рак предстательной железы, рак мочевого пузыря. С помощью химиотерапии они поддаются контролю — возможно излечение, как минимум, можно добиться длительной ремиссии.
Есть промежуточная группа – рак желудка, рак почки, остеогенная саркома, при которых уменьшение опухоли от химиотерапии происходит в 75-50% случаев.
А есть рак печени, поджелудочной железы. Эти опухоли малочувительны к лекарственной терапии, но к ним сейчас применяют другие методы лечения – оперируют или облучают. И еще есть рак крови – понятие, которым пациенты называют острые лейкозы и лимфомы. Они вообще развиваются по другим законам.
Даже при запущенной стадии рака с метастазами, прогноз очень сильно зависит от того, какой у вас конкретно подтип опухоли. Например, гормоночувствительный подтип рака молочной железы даже с метастазами контролю поддается очень хорошо. Поэтому делать какие-то выводы о «химиотерапии при раке в целом» — некорректно.
В последнее время подход к лечению онкологических пациентов всё больше индивидуализируется. Совсем давно говорили: «У вас рак – какой ужас!», — потом: «У вас рак определенного органа – это плохо». А сейчас врач внимательно посмотрит на «паспорт» опухоли из гистохимических и иммунногенетических маркеров и характеристики опухоли, которую пациенту выдали при гистологическом исследовании (такое изучение опухоли теперь входит в стандарты обследования) и в зависимости от этого выберет тактику лечения.
Я не нашла подтверждающей информации, что врачи с такими именами (они есть, но они не онкологи) высказали такое мнение.
Сегодня Россия, как Европа и США, переходит к стандартам доказательной медицины. В этой системе все доказательства оцениваются по определенной шкале. И меньше всего доверия — аргументам из серии «профессор Иванов (или профессор Смит) сказал». Более серьезный уровень аргументов – метаанализы, то есть объединение нескольких, уже проведенных маленьких исследований в одно, когда их результаты складывают и считают вместе.
Химиотерапия – это лечение. И, как у всякого лечения, у нее бывают побочные эффекты. Они бывают от любых лекарств, они бывают после хирургических операций. Сама химиотерапия тоже бывает разной в зависимости от цели. Предоперационную химиотерапию применяют до хирургической операции, чтобы максимально уменьшить размер опухоли и сделать хирургическое вмешательство максимально щадящим.
Цель постоперационной «химии» – убрать отдельные опухолевые клетки, которые еще могут циркулировать в организме.
А бывает химиотерапия паллиативная. Ее применяют, когда опухоль запущена, со множественными метастазами, и вылечить больного невозможно, но возможно затормозить дальнейшее прогрессирование и попытаться контролировать опухоль. В этом случае химиотерапия призвана подарить пациенту время, но, как правило, она сопровождает его до конца. И тогда может создаться впечатление, что пациент умер не от рака, а от «химии», хотя это не так.
Кроме того, при предоперационной или послеоперационной «химии» часто врачи наблюдают пациента не только в тот момент, когда он получает капельницы с препаратами, но и между курсами. Поэтому смертельные случаи от побочных эффектов редки.
Миф 3: химиотерапия непоправимо «сажает» печень, кровь, нервы
Главный механизм действия химиопрепаратов – воздействие на механизм деления клетки. Клетки раковых опухолей очень быстро делятся, поэтому, воздействуя на деление клеток, мы останавливаем рост опухоли.
Но, помимо опухоли, в организме много других быстро делящихся клеток. Они есть во всех системах, которые активно обновляются, — в крови, в слизистых. Те химиопрепараты, которые воздействуют не выборочно, действуют и на эти клетки.
Основные осложнения химиотерапии:
— падение показателей крови
— поражения печени
— изъязвление слизистых и связанные с этим тошнота и понос
— выпадение и ломкость ногтей.Такой эффект объясняется тем, что цитостатическая химиотерапия действует не только на клетки опухоли, но на все быстроделящиеся клетки организма.Также у отдельных препаратов, которые оказывают на организм токсичное действие, бывают специфические осложнения. (Часть препаратов химиотерапии сделана на основе платины – это тяжелый металл).
Токсичные препараты химиотерапии могут вызвать ряд неврологических симптомов – головные боли, бессонницу или сонливость, тошноту, депрессию, спутанность сознания. Иногда возникает ощущение онемения конечностей, «мурашки». Эти симптомы проходят после прекращения действия препарата.
После химиотерапии у пациента ожидаемо падают показатели крови. Обычно пик падения приходится на седьмой-четырнадцатый день, потому что «химия» как раз подействовала на все клетки, которые были в периферической крови, а новые костный мозг выработать еще не успел. Падение происходит в зависимости от препарата, который применялся; одни из них действует преимущественно на тромбоциты, другие – на лейкоциты и нейтрофилы, третьи – на эритроциты и гемоглобин.
Химиотерапевтическое лечение проходит циклами. В зависимости от схемы химиотерапии, человек может получить, например, три дня капельниц химиотерапии, а следующие будут через 21 день. Этот промежуток называется «один цикл», он дается специально, чтобы организм пациента восстановился.
Перед каждым новым сеансом химиотерапии состояние пациента контролируют, смотрят, что было с ним в этот промежуток – делают клинический и биохимический анализ крови. Пока человек не восстановился, новый цикл лечения не начинается.
Если кроме снижения показателей крови до определенного уровня в промежуток между «химиями» ничего плохого не происходило — кровь восстановится сама. Чрезмерное падение тромбоцитов создает угрозу кровотечения, пациенту с такими показателями делают переливание тромбоцитарной массы. Если упали лейкоциты, которые отвечают за иммунитет, а человек заразился какой-то инфекцией, начался кашель, насморк, поднялась температура, — сразу назначают антибиотики, чтобы инфекция не распространилась. Обычно все эти процедуры делаются амбулаторно.
В перерывах между курсами химиотерапии пациента ведет онколог из районного онкодиспансера или поликлиники.
Перед самым первым циклом химиотерапии пациенту должны объяснить все возможные осложнения, рассказать про каждый препарат и его воздействие; и пациент может проконсультироваться со своим онкологом. Взвешивание рисков – отправная точка химиотерапии. Врач и пациент выбирают между повреждением, которое может принести химиотерапия, и преимуществом, которое может за ней последовать, — а именно – продление жизни порой на десятки лет.
Это – ключевой момент в принятии решения о необходимости применения химиопрепаратов: если мы понимаем, что при назначении того или иного лекарства процент успеха будет ниже, чем побочные эффекты, применять его просто нет смысла.
Миф 4: метастазы вырастают из «стволовых клеток рака», которые «химия» все равно не убивает
Причины возникновения метастазов у разных опухолей очень разные, как именно возникают метастазы, мы пока не знаем. Единственное, что мы знаем – «стволовых клеток рака» не бывает.
Опухоль в разных своих фрагментах и клетки метастазов – это очень неоднородное образование, там все клетки разные, они быстро делятся и быстро мутируют. Но в любом случае химиотерапия воздействует на все метастазы, где бы они ни были. Исключение – метастазы в головном мозге, куда проникают не все препараты. В этих случаях назначают особое лечение, либо особое введение препаратов – в спинномозговой канал. Бывают даже такие опухоли, у которых нельзя найти первичный очаг, — то есть, все, что мы видим в организме – это метастазы. Но лечение все равно назначают, и оно, во многих случаях, успешно проводится.
Миф 5: химиотерапия – метод, поддерживаемый фарминдустрией
Якобы давно есть препараты эффективнее, безвреднее и дешевле, но о них не говорят, боятся обвалить фармрынок.
Этот миф существует и по поводу других заболеваний, особенно это касается ВИЧ.
«Альтернативные препараты», которые принимают онкологические пациенты, в лучшем случае оказываются безобидными травками, от которых нет заметного действия. Увы, бывает хуже. Например, иногда пациенты начинают пить чудодейственные лекарства на основе смеси разных масел, а ведь масло – это очень тяжелый продукт для печени. В итоге пациент буквально вызывает у себя воспаление печени, и мы не можем начать цикл химиотерапии, потому что «химия» на печень тоже воздействует. И хорошо, если пациент хотя бы рассказывает нам, что он принимал, и мы можем понять, что так ухудшило ситуацию. Но лечение в итоге откладывается, эффективность его понижается. Кроме того, ряд новых лекарств для лечения, например, рака молочной железы, сейчас основан на растительных компонентах. Например, препарат трабектедин содержит специальным образом обработанную вытяжку из морских тюльпанов. Так что иногда препараты, которые пациенты принимают в ходе официального лечения, сами по себе – «природные».
Что до «гигантских денег фарминдустрии», часть препаратов химиотерапии, например, метотрексат, — это очень старые, давно разработанные лекарства, они стоят буквально копейки. Никаким «обвалом» или «подъемом отрасли» уменьшение или увеличение их производства не грозит.
В любом случае препараты для лечения онкологических заболеваний пациенты в России получают бесплатно.
Новые лекарства при раке
В последнее время в дополнение к цитостатикам – препаратам химиотерапии, которые действовали на весь организм целиком, появились новые препараты. Это – новое поколение препаратов химиотерапии – таргетные препараты и лекарства, основанные на принципиально ином принципе действия – иммунопрепараты.
Таргетный препарат – это лекарство, воздействующее не на весь организм, а адресно на клетки опухоли. При этом важно – молекулы конкретного таргетного препарата могут присоединиться к рецепторам клетки только определенного вида опухоли. Конкретный подтип опухоли определяется генетическим анализом во время молекулярно-генетического исследования.
Иммунопрепараты воздействуют на иммунную систему организма и иммунные механизмы опухоли в её ядре. В результате в организме активизируется собственный иммунитет, который начинает бороться с раковыми клетками.
Сравнительно новый метод — гормонотерапия, но здесь круг показаний еще уже – опухоль должна быть гормоночувствительная. Считается, что на гормонотерапию лучше всего реагируют опухоли молочной железы и предстательной железы, хотя и здесь гормоны можно использовать только при определенных показаниях.
Кстати, с гормонотерапией связан еще один миф: чаще всего она используется в форме таблеток, и пациенты считают, что таблетки – это «не лечение» при такой болезни, как рак.
Можно ли обойтись без химиотерапии
Катерина Коробейникова. Фото: Ольга Молостова
Без химиотерапии, одними гормонами иногда лечат, например, рак молочной железы. Хотя понятно, что гормоны тоже небезобидны, от них бывают свои осложнения.
Вместе с тем надо понимать: мы изобретаем новые препараты, но и раковые клетки мутируют и к ним приспосабливаются. Даже у пациента, которому раньше лечение без «химии» помогало, опухоль может спрогрессировать и стать нечувствительной к лекарствам, которые сдерживали ее рост. В этом случае химиотерапия применяется как экстренное лечение.
Например, пациентка с раком молочной железы долгое время принимает гормоны, и опухоль не растет. Внезапно она чувствует слабость, появляются метастазы в печени. В этом случае мы проводим несколько циклов химиотерапии, возвращаем организм в состояние, когда опухоль вновь начинает реагировать на гормоны, и тогда пациентка возвращается к прежней схеме лечения.
Совсем без химиотерапии на нынешнем уровне развития онкологии мы не обойдемся. Но при этом развивается «сопроводительное лечение» — вместе с химиотерапией пациент получает целый набор лекарств, ослабляющих тошноту, ускоряющих восстановление клеток крови и нормализующих стул. Так что неприятные побочные эффекты химиотерапии удается значительно ослабить.
Сомнительный источник
Об исследовании «профессора Гарвардского университета Джона Кэрнса», которое озвучивает миф 1: химия малоэффективна, я слышу впервые. Единственный практикующий врач по имени Джон Кернс, которого удалось найти в интернете, — это невролог-радиолог, который занимается проблемами головного мозга, а про химиотерапию вообще ничего не писал.Возможно, речь идет о британском враче Джоне Кернсе (John Cairns), с 1991 года на покое – он 1923 года рождения. Кернс — автор книг «Рак: Наука и Общество» (1978) и «Вопросы жизни и смерти: взгляды на здравоохранение, молекулярную биологию, рак и перспективы человеческого рода» (1997). Годы работы Джона Кернса говорят о том, что он ссылался на статистику выживаемости 1970-1980-х годов, и публиковаться в научных журналах в начале 2000-х не мог.Если речь идет об этом Джоне Кернсе, то мы можем говорить лишь об устаревших исследованиях в онкологии: с 1970-х годов эффективность лекарств сильно изменилась.«Журнал клинической онкологии» в число современных авторитетных изданий не входит.