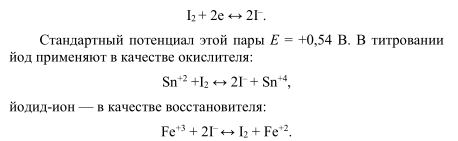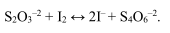какой индикатор применяется в методе йодометрии
Оксидиметрия. Перманганатометрия. Йодометрия. Хроматометрия
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Оксидиметрия
Основные понятия методов оксидиметрии
К методам окислительно-восстановительного титрования (оксидиметрия) относятся все титриметрические методы, в основе которых лежат окислительно-восстановительные реакции. Рабочим раствором является либо раствор окислителя, либо раствор восстановителя, а анализируемым раствором в первом случае — восстановитель, во втором — окислитель.
В зависимости от рабочего раствора в оксидиметрии применяют следующие основные методы:
Эквивалентная молярная масса Mэ окислителя и восстановителя зависит от числа принимаемых или отдаваемых электронов Mэ = Мм / n,
где Мм — молярная масса окислителя или восстановителя;
n — число электронов.
Проведение оксидиметрии возможно только в том случае, если:
1) скорость реакции достаточно велика;
2) можно определить точку эквивалентности.
В зависимости от условий реакции ЕО/В рассчитывается по уравнению Нернста:
В оксидиметрии существуют два типа индикаторов.
Второй тип индикаторов. Происходит изменение окрашивания раствора при изменении потенциала редокс-индикато. Дифениламин ↔ дифенилбензидин. При значении потенциала Е ≥ 0,79 В цвет раствора меняется с бесцветного на синий.
Перманганатометрия
Перманганатометрическим методом объемного анализа называют метод, основанный на окислении различных веществ перманганатом калия (KMnO 4 ). В зависимости от условий, в которых протекает реакция окисления-восстановления, ионы MnO 4 – могут принимать различное число электронов. В кислой среде:
То есть здесь более низкое значение потенциала. Но титрование в этой среде используют гораздо реже, чем в кислой среде. Изменение окрашивания малиновый — коричневый (трудно определить переход в окрашивании раствора). Перманганатометрию используют для определения:
Для метода применяют 0,02–0,05 н растворы перманганата калия (более концентрированные растворы окрашены более интенсивно, менее концентрированные — менее устойчивы при хранении). Необходимо устанавливать титр раствора перманганата через 10 ч после приготовления раствора. Титр устанавливают по оксалату натрия Na2C2O4. Раствор хранят в темных склянках в темном месте.
Молярная масса эквивалента нитрита равна половине его молярной массы. Ход анализа отработан десятилетиями и выполняется по методике, которая учитывает все нюансы.
Йодометрия
Йодометрия — титриметрический (объемный) метод определения веществ, основанный на окислительно-восстановительных реакциях с участием йода иили йодида калия. В основе всех йодометрических реакций лежит реакция:
Проводят йодометрию с индикатором крахмалом, который добавляют перед началом титрования (интенсивное синее окрашивание). Если используют йодид, то титрование проводят непрямым методом. К анализируемому раствору добавляют избыток йодида, затем образующийся йод титруют раствором тиосульфата натрия с образованием тиотионат-иона:
Хроматометрия
Хроматометрией называется метод объемного анализа, основанный на использовании раствора бихромата калия в качестве стандартного. Бихромат калия способен окислять многие неорганические и органичские вещества сульфиты, дитионаты, гексацианоферрат (II), арсениты, иодиды, спирты, гидрохинон, глицерин, аскорбиновую кислоту, тиомочевину и др. В качестве примера ниже приведена используемая в объемном анализе реакция окисления — восстановления, протекающяя с участием бихромата и гексацианоферрата (II)
Индикаторы. Йодометрия. Рабочие растворы
Виды и область применения химических индикаторов. Йодометрия как один из распространенных методов количественного анализа. Рабочие растворы метода йодометрии, основная реакция метода. Факторы, влияющие на точность результатов йодометрического титрования.
| Рубрика | Химия |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 10.12.2017 |
| Размер файла | 248,6 K |
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru
Министерство науки и образования Российской Федерации
образовательное учреждение высшего образования
Ивановский Государственный Химико-Технологический Университет
Факультет: неорганической химии и технологии
Кафедра: неорганической химии
«Индикаторы. Йодометрия. Рабочие растворы»
студент 1 курса 35 группы
Бодров Александр Андреевич
Фомина Надежда Александровна
Издревле люди пытались изучить свойства химических реакций. Для этого они придумали различные методы, это и йодомерия и, конечно же, различные индикаторы.
Существуют также химические индикаторы для самых различных специальных целей, например, для определения дозы облучения.
По технике применения различают внутренние и внешние индикаторы. Более распространенные внутренние индикаторы непосредственно вводят в титруемый раствор. Внешние индикаторы применяют тогда, когда нельзя использовать внутренние. С помощью внешних индикаторов полноту оттитрования проверяют в пробах (каплях), последовательно отбираемых из титруемого раствора на часовое стекло или фарфоровую пластинку. химический индикатор йодометрия титрование
Индикаторы позволяют быстро и достаточно точно контролировать состав жидких или газообразных сред, следить за изменением их состава, или за протеканием химической реакции.
Для определения состава газовых сред используют индикаторные бумажки и индикаторные трубки.
Индикаторы различают по типу реакции титрования, для регистрации окончания которой их применяют.
2. Универсальные индикаторы — смесь нескольких индикаторов, приобретающих различную окраску при нескольких значениях рН, что позволяет судить о величине рН по всему диапазону шкалы. Индикаторы выбирают с помощью теоретических кривых титрования.
3. Редокс-индикаторы, Ох— и Red-формы которых имеют различный цвет
4. Металлоиндикаторы (металлохромные) используют в комплексонометрическом титровании. Это органические красители, которые образуют окрашенные комплексы с ионами металлов. Краситель и его комплекс различаются по окраске. Избыток титранта разрушает комплекс, в результате краситель выделяется в свободном виде и окрашивает раствор в свой цвет в КТТ (МЭ). Адсорбционные индикаторы
6. Хемилюминесцентные индикаторы излучают собственный свет в процессе окислительно-восстановительных реакций, при реакциях нейтрализации. Удобны при титровании сильноокрашенгшх растворов. К ним относятся люминол, лофин, люцигении, силоксен.
Основная реакция метода
Приготовление раствора титранта
Рабочим раствором называется раствор, с помощью которого проводится титриметрическое определение, т. е. это раствор, которым титруют. Чтобы проводить определение с помощью рабочего раствора, надо знать его точную концентрацию.
Стандартные растворы йода готовят из фиксаналов или навесок кристаллического йода.
Поэтому навеску кристаллического йода растворяют в небольшом объеме КI (масса КI должна быть в 2-3 раза меньше массы навески йода), затем добавляется дистиллированная вода до необходимого объема. Точная концентрация полученного раствора определяется с помощью стандартного раствора натрия тиосульфата.
Из-за летучести йода и способности йодид-ионов окисляться кислородом воздуха, особенно на свету, приготовленный раствор рекомендуется хранить в прохладном месте, в темной, плотно закрытой посуде.
Стандартные растворы натрий тиосульфата обычно готовят из фиксанала или из навески кристаллического Na2S2O3·5 Н2О.
При хранении концентрация растворов Na2S2O3 изменяется вследствие взаимодействия его с СО2 и О2, растворенными в Н2О, а также в результате частичного разложения под действием попадающих в раствор тиобактерий.
Точная концентрация растворов Na2S2O3 устанавливается по навескам х.ч. калий дихромата K2Cr2O7 или кристаллического свежвозогнанного йода.
Определение состояния эквивалентности
Точка эквивалентности при йодометрическом титровании может определяться:
Факторы, влияющие на точность результатов йодометрического титрования
Достоверность результатов йодометрического титрования зависит от ряда факторов:
— от значения кислотности среды титруемого раствора,
— момента введения индикатора.
Рассмотрим влияние каждого из перечисленных факторов отдельно.
Результаты анализа сильно зависят от значения рН титруемого раствора. Оптимальным является титрование нейтральных или умеренно кислых растворов.
В щелочной среде (рН>7,5) точность анализа снижается из-за параллельных процессов:
а) диспропорционирование йода:
Оба процесса нарушают стехиометрию взаимодействия йода с тиосульфатом и искажают результат анализа.
Следствием этой реакции является, увеличение концентрации титранта, что также сказывается на результате титрования.
Избыток I2 оставшегося после окончания реакции оттитровывается титрантом восстановителем, а именно раствором Na2S2O3 до состояния эквивалентности, т.е. до обесцвечивания крахмала:
Содержание аскорбиновой кислоты рассчитываем по известным формулам, например ч/ з сложный титр:
1. Определяем объем избытка йода:
В медико-биологической и санитарно-гигиенической практике обратное титрование используется для определения количественного содержания в воздухе или в воде ряда токсичных восстановителей: формальдегида, сероводорода, оксида серебра (1V). Также определяется содержание анальгина, фурацина, метионина, пенициллина, соединений ртути (1) в лекарственных препаратах.
Йодометрическое определение окислителей
Определение окислителей проводят по методу заместительного (косвенного) титрования. Раствор, содержащий окислитель, обрабатывают неконтролируемым избытком калия иодида, а выделившийся при этом йод (I2) в количестве, эквивалентном содержанию окислителя, оттитровывают до состояния эквивалентности титрантом-восстановителем (растворNa2S2O3).
В этом случае при анализе протекают две основные реакции:
а) к окислителю добавляют избыток KI, выделившийся йод оттитровывается по второй реакции:
Йодометрическое определение содержания озона (О3) в воздухе. Определенный объем воздуха, содержащий О3, пропускают через подкисленный раствор иодида калия
O3 + 6H + +6e = 3 H2O ¦1 Z= 6 f= 1/6
Выделившийся I2, количество, которого строго эквивалентно количеству О3, содержащемуся в воздухе, оттитровывают стандартным раствором Na2S2O3:
Аналогичным образом определяется содержание хлора в воде и в воздухе, содержание растворенного в воде кислорода, концентрацию арсенатов, содержание KMnO4 в техническом препарате, никотиновой кислоты в растворах для инъекций и др.
Применение йодометрического метода в медицине
1. Определение количества аскорбиновой кислоты, формальдегида.
2. В клиниках определяют сахар в крови и фермент пероксидазу.
3. Определяют активный хлор в белильной извести.
4. Остаточный хлор в питьевой воде.
В заключении можно сказать, что йодометрический способ исследования растворов является очень точным и довольно удобным методом. Стоит отметить, что данный метод применим даже в медицине.
1. Вайс е.Ф., Салмина а.Б. Общая и неорганическая химия Учебное пособие, для студентов 1 курса, обучающихся по специальности 060301-Фармация (заочная форма обучения) Красноярск 2013
Размещено на Allbest.ru
Подобные документы
Классификация методов титраметрического анализа. Сущность метода «нейтрализации». Приготовление рабочих растворов. Расчет точек и построение кривых кислотно-основного и окислительно-восстановительного титрования. Достоинства и недостатки йодометрии.
курсовая работа [383,9 K], добавлен 17.11.2013
Суть окислительно-восстановительного титрования. Реакции, используемые в редоксиметрии, требования к ним. Кривые титрования в редоксиметрии. Индикаторы, которые используются в редоксиметрии. Перманганатометрия, дихроматометрия, йодометрия, йодиметрия.
презентация [3,0 M], добавлен 05.12.2016
Систематический анализ, реакции и анализ смеси катионов. Анализ анионов и сухой соли. Гравиметрический метод анализа, метод нейтрализации, процентное содержание кислот. Методы окислительно-восстановительного титрования, перманганатометрия и йодометрия.
лабораторная работа [64,8 K], добавлен 19.11.2010
Классификация методов окислительно-восстановительного титрования. Индикаторы окислительно-восстановительного титрования. Перманганатометрия, йодометрия и дихроматометрия. Окраска окисленной и восстановленной формы. Фиксирование точки эквивалентности.
реферат [24,7 K], добавлен 23.02.2011
Характеристика воды как важнейшей составляющей среды нашего обитания. Исследование ее общей карбонатной жесткости и окисляемости методами нейтрализации и перманганатометрии. Применение метода йодометрии для определения содержания остаточного хлора в воде.
курсовая работа [60,3 K], добавлен 05.02.2012
Йодометрия



2. Титрант, среда, индикаторы, уравнения.
Иодометрией называют титриметрический метод в основе которого лежат реакции:
Окислитель реагирует с избытком иодида калия КI в кислой среде. При этом выделяется количество иода эквивалентное количеству окислителя. Выделившийся иод титруют раствором тиосульфата натрия точно известной концентрации. Таким образом можно рассчитать количество определяемого окислителя, которое эквивалентно количеству тиосульфата, пошедшего на титрование иода. Следовательно, рабочим раствором в этом методе является раствор тиосульфата натрия Na2S2O3
Исходным веществом для установки титра Na2S2O3 служит дихромат калия К2Сг2О7.
Большинство окислителей нельзя титровать непосредственно тиосульфатом натрия, так как невозможно фиксировать точку эквивалентности. Поэтому для определения окислителей методом иодометрии применяют косвенный метод — титрование заместителя. Вначале проводят реакцию между окислителем и иодидом калия в кислой среде. Для подкисления применяют серную кислоту или хлороводородную. Реакция протекает по уравнению:
Выделившийся свободный иод титруют раствором тиосульфата натрия:
Индикатором в методе иодометрии служит раствор крахмала. Это чувствительный и специфический индикатор, образующий с иодом адсорбционное соединение синего цвета. Однако употребление этого индикатора имеет некоторые особенности. Во-первых, раствор крахмала необходимо прибавлять в самом конце титрования, когда иода остается очень мало, и титруемый раствор будет иметь светло-желтую окраску. Если прибавить крахмал раньше, когда иода в растворе еще много, то титрование будет осложнено тем, что образующееся соединение иода с крахмалом очень медленно реагирует с тиосульфатом. Вторая особенность обусловлена тем, что в данном случае мы титруем не до появления окраски (как это обычно бывает), а до исчезновения окраски. Поэтому вблизи точки конца титрования необходимо прибавлять раствор не более чем по одной капле, после каждой капли тщательно перемешивать раствор и ждать 3—5 с. Если не соблюдать оба эти условия, раствор очень легко перетитровать.
Для проведения определений окислителей иодометрическим методом нужно соблюдать ряд условий.
1) Чтобы реакция между окислителем и иодидом калия протекала практически до конца, ее нужно проводить в кислой среде.
2) Титрование ведут на холоду, так как при нагревании иод может частично улетучиться, а также потому, что с повышением температуры понижается чувствительность крахмала как индикатора.
3) Титрование нельзя проводить в сильнощелочной среде, так как иод реагирует со щелочью. Необходимо следить за тем, чтобы рН раствора не превышал 9.0.
5) Скорость реакции между иодидом калия и окислителем недостаточно велика, поэтому к титрованию выделившегося иода приступают не сразу, а по истечению некоторого времени после прибавления окислителя.
Йодометрия: сущность метода, общая характеристика, область применения. Условия проведения йодометрических определений
I2 + 2е 
Т.к. стандартный окислительно-восстановительный потенциал пары невелик − E 0 (I2 /2I − ) = 0,54 В, йод является относительно слабым окислителем, а ионы I − – сравнительно сильным восстановителем.
С помощью метода йодометрии можно определять:
а) путем прямого титрования анализируемого раствора раствором йода:
б) путем обратного титрования, Используется, если скорость взаимодействия восстановителя с йодом невелика. В этом случае к раствору восстановителя добавляют избыток титрованного раствора I2, а спустя некоторое время не вступивший в реакцию йод титруют раствором тиосульфата натрия:
Проводить определение, титруя раствор окислителя йодидом калия KI нельзя, т.к. невозможно фиксировать конец титрования. Поэтому пользуются методом замещения: к анализируемому раствору окислителя добавляют избыток раствора KI:
2 MnO4 − + 10 I − + 16 H + = 5 I2 + 2 Mn 2+ + 8 Н2О. (2.11)
В результате реакции выделяется йод в количестве, эквивалентном количеству окислителя; йод титруют раствором тиосульфата натрия по уравнению (2.10).
К достоинствам метода йодометрии можно отнести следующие:
1. Большая точность по сравнению с другими методами окислительно-восстановительного титрования.
2. Растворы йода окрашены, и титрование можно проводить без индикатора. Желтая окраска ионов I3 − при отсутствии других окрашенных продуктов отчетливо видна при очень малой концентрации (5∙10 −5 н.).
3. Йод хорошо растворяется в органических растворителях, поэтому метод широко применяется для титрования в неводных средах.
Недостатки метода, вызывающие ошибки при выполнении йодометрических определений:
1. Потери йода из-за его летучести. Поэтому титрование проводят на холоду и по возможности быстро. При необходимости оставить раствор на некоторое время для завершения реакции, его хранят под притертой пробкой.
2. Окисление ионов йода кислородом воздуха в кислой среде.
3. Йодометрическое титрование нельзя проводить в щелочной среде вследствие диспропорционирования йода.
4. Относительно медленные скорости реакций с участием йода.
5. В процессе хранения стандартные растворы йода и тиосульфата изменяют свой титр. Чтобы избежать ошибок, необходимо периодически проверять титр йода по тиосульфату, а титр тиосульфата по дихромату калия.
Фиксируют конечную точку титрования в методе йодометрии с помощью специфического индикатора – крахмала, который образует с йодом комплексно-адсорбционное соединение синего цвета. Эта реакция очень чувствительна, она позволяет легко обнаруживать йод при концентрации 10 −5 н. Т.к. соединение йода с крахмалом очень прочное, крахмал следует добавлять в конце титрования, когда окраска раствора становится бледно-желтой. Если вводить крахмал раньше, то очень много йода будет связано с крахмалом. При титровании йод с трудом освобождается из соединения с крахмалом, и результат титрования окажется неточным.
При проведении йодометрических определений следует соблюдать следующие условия:
1. Т.к. стандартный окислительно-восстановительный потенциал пары I2/2I − невелик, многие йодометрические определения не доходят до конца. Поэтому для количественного протекания реакций необходимо создавать специальные условия (вводить комплексообразователи, осадители, буферные добавки и т.д.).
2. Йод – вещество летучее, поэтому титрование проводят на холоду. Кроме того, при увеличении температуры снижается чувствительность крахмала как индикатора (при 50 0 С индикатор в 10 раз менее чувствителен, чем при 25 0 С).
3. Растворимость йода в воде мала, поэтому определение окислителей необходимо проводить в присутствии большого избытка KI, который образует с йодом растворимое нестойкое комплексное соединение:
KI + I2 
4. Скорость реакции между окислителями и KI обычно невелика, поэтому к титрованию выделившегося йода обычно приступают спустя некоторое время.
5. Йодометрическое титрование нельзя проводить в щелочной среде, т.к. протекает побочная реакция:
I2 + 2 OH − = IO − + I − + Н2О (2.13)
Образующийся гипойодит является более сильным окислителем, чем йод, он окисляет тиосульфат до сульфата:
Поэтому во избежание побочных реакций титрование проводят при рН не более 9.
6. В кислых растворах йодиды постепенно окисляются кислородом воздуха:
Свет ускоряет эту реакцию, поэтому реакционную смесь хранят в темноте.
Рабочими растворами метода йодометрии являются растворы йода и тиосульфата натрия.
Титрованный раствор йода можно приготовить исходя из точной навески химически чистого кристаллического йода, который очищают от примесей путем возгонки.
Однако, очистка йода представляет собой очень трудоемкую операцию. Кроме того, титрованный раствор в процессе работы с ним и при длительном хранении меняет свой титр вследствие летучести йода, и периодически его нужно проверять. Поэтому обычно готовят раствор I2 приблизительно нужной концентрации (0,05–0,1 н.) растворением навески йода в растворе KI (40 г/л). Точную концентрацию полученного раствора устанавливают по раствору тиосульфата натрия (реакция 2.10).
Тиосульфат натрия Na2S2O3·5Н2О является неустойчивым веществом. Оно легко реагирует с углекислым газом и кислородом воздуха:
Поэтому готовят приблизительно 0,1 н. раствор тиосульфата, растворяя навеску соли в свежепрокипяченой воде (для удаления СO2). Хранить готовый раствор Na2S2O3 рекомендуется в темных бутылях, защищенных от двуокиси углерода трубкой с натронной известью. В дальнейшем титр раствора начинает медленно уменьшаться, поэтому его необходимо периодически проверять.
Для установки концентрации тиосульфата предложено много различных стандартных веществ, например твердый химически чистый йод, йодат калия KIO3, бромат калия KBrO3, дихромат калия и др. На практике чаще всего пользуются дихроматом калия K2Cr2O7.
В качестве стандартного в-ва используют K2Cr2O7, но т.к он с тиосульфатом взаимодействует не стехеометрично используют метод замещения. К подкисленному раствору KJ добавляют раствор дихромата и спустя 5-10 мин выделившийся йод титрую тиосульфатом по уравнению