какой металл горит синим пламенем
Цветное пламя: проба на окрашивание пламени
Для химика пламя не только источник тепла, но и инструмент химического анализа. Давно известно, что некоторые химические соединения, введенные в пламя, придают ему характерную окраску. В этом можно убедиться, если в любое пламя внести кусочек поваренной соли.
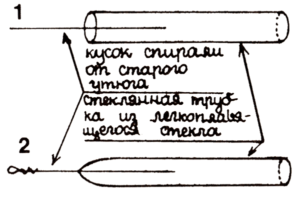
Возьмите кусок нихромовой проволоки (например, из старого утюга) длиной 10 см и выпрямите. Для опыта понадобится еще стеклянная трубка из легкоплавкого стекла. Надо заплавить проволоку в стеклянную трубку при помощи газовой горелки. Потом на конце проволоки сделайте маленькую петельку, как показано на рисунке.
Можно поступить не совсем спортивно и заменить стеклянную трубку корковой пробкой из винной бутылки.
При подведении определенного количества воздуха пламя газовой горелки становиться голубым и не коптит. Отчетливо видны в нем две части. Внутренняя часть называется восстанавливающей. Она голубого цвета и имеет сравнительно низкую температуру. Внешняя часть бесцветная — окисляющая. Температура этой части пламени равно около 1300 °С.
Растворите в нескольких миллилитрах воды, налитых в пробирку щепотку хлористого натрия. Очищенную проволоку погрузите в раствор, а потом введите в окисляющую часть пламени.
Какой великолепный эффект! Пламя в одно мгновение меняет окраску на интенсивно желтую. А теперь проверьте, содержит ли натрии вода, которую вы пьете (этот металл придает пламени желтый цвет). Результат анализа будет положительным. Можете проверить, содержат ли натрий другие вещества. Окажется, что натрий «пронырливый» металл, везде он есть, пламя всегда будет более или менее желтым.
Если вы уже знаете, как меняет окраску пламени натрий, проверьте «поведение» других металлов. Возьмите образцы солей кальция, стронция, бария, калия и меди. Лучше всего взять хлориды или нитраты. Если у вас их нет, возьмите другие соли, но помните, что сначала проволоку нужно очистить в пламени и соляной кислоте. После такой очистки опять опускайте проволоку в раствор анализируемого вещества, а затем вводите в окисляющую часть пламени.
При анализе твердых субстанций раскаленную проволоку опускают в анализируемое вещество, которое прилипает к ней и затем сплавляется в пламени горелки, образуя перл. Перл на мгновение опускают в соляную кислоту. Образующиеся при этом хлористоводородные соединения летучие и быстро испаряются с проволоки в пламени, окрашивая его в характерный цвет.
Вероятно вы удивитесь, когда начнете исследовать калий, так как цвет пламени будет такой же как в ходе анализа натрия, и лишь время от времени через желтое пламя будут проскакивать розовые отблески калия. Это потому, что натрий, содержащийся в воде, употребляемой для растворения образца, не позволяет калию показать себя в полной красоте. В пламени идет „борьба” между натрием и калием, в которой натрий побеждает. Если хотите, можете помочь победить калию. Наблюдайте через так называемое синее кобальтовое стекло. Это стекло представляет собой фильтр, который задерживает цвет натрия, пропуская цвет калия. Вы, наверное, огорчитесь, что в вашей лаборатории нет кобальтового стекла. Но не падайте духом, вместо него можно взять раствор метилового фиолетового. А если его тоже нет, растворите в воде несколько капель синих чернил. Если будете наблюдать пламя через этот раствор, увидите фиолетовую вспышку, свидетельствующую о наличии калия.
А теперь сопоставьте результаты работы:
Металл Цвет пламени
Медный факел
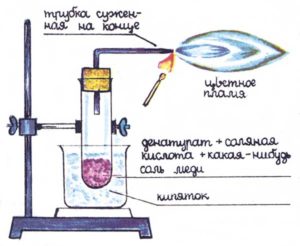
Зная, что некоторые металлы окрашивают пламя, сделайте медный «факел». Это необыкновенно интересный опыт. Соберите аппаратуру, показанную на рисунке.
Всыпьте в пробирку несколько криеталликов какой-либо соли меди, например, CuSO4 (медный купорос), и добавьте до 1/3 высоты пробирки денатурат и несколько капель разбавленной соляной кислоты Закупорьте пробирку пробкой, через которую проходит трубка, изогнутая под прямым углом и суженая на конце. Поместите пробирку в химический стакан с горячей водой, денатурат начнет испаряться, увлекая с собой соль меди. Приставьте к выходу трубки горящую спичку: пары денатурата зажгутся, а пламя приобретет зелено-синий цвет. Эффект опыта необыкновенно красив, если его наблюдать в темной комнате.
А теперь модифицируйте опыт, взяв вместо соли меди ранее употреблявшиеся химические соединения, окрашивающие пламя. А если у вас есть бура или борная кислота, проверьте, как окрашивает пламя бор. Борную кислоту можно купите в аптеке. И еще одно: не заливайте пробирку более чем на 1/3 высоты. И ни в коем случае не нагревайте пробирку горелкой!
Цветные свечи
Чтобы получить свечи с разноцветным пламенем надо добавить в расплавленный парафин соль металла, окрашивающего пламя в той или иной цвет.
Синяя свеча. Покрасить парафин в синий цвет можно стеаратом меди. Эту соль получают смешивая растворы сульфата меди и хозяйственного мыла. Пламя свечи тоже будет синим, благодаря ионам меди.
Зеленая свеча. В качестве пигмента используется зеленый оксид хрома (III). Он получается при термическом разложении бихромата аммония (опыт с вулканом). Цвет пламени тоже будет зеленым.
Желтая свеча. Желтый хромат натрия окрасит парафин и пламя свечи в желтый цвет.
Красная свеча. Парафин подкрашивают любым красным пигментом, например гуашью. Чтобы пламя было красным надо добавитькакую-либо соль стронция или лития.
Проба на окрашивание пламени
Присутствие металлов можно идентифицировать по цвету пламени, образующегося при их горении.
При совершении электроном квантового скачка с одной разрешенной орбитали на другую (см. Атом Бора) атом испускает свет. А поскольку энергетические уровни атомов двух элементов различны, свет, испускаемый атомом одного элемента, будет отличаться от света, испускаемого атомом другого. Это положение лежит в основе науки, которую мы называем спектроскопией (см. Открытие Кирхгофа—Бунзена).
На этом же положении (что атомы разных элементов испускают свет разной длины волны) основана проба на окрашивание пламени в химии. При нагревании в пламени газовой горелки раствора, содержащего ионы одного из щелочных металлов (то есть одного из элементов первой колонки периодической системы Менделеева), пламя окрасится в определенный цвет в зависимости от того, какой металл присутствует в растворе. К примеру, ярко-желтый цвет пламени выдает присутствие натрия, фиолетовый — калия, а карминно-красный — лития. Происходит это окрашивание пламени так: столкновение с горячими газами пламени переводит электроны в возбужденное состояние, из которого они возвращаются в исходное, одновременно испуская свет характерной длины волны.
Это свойство атомов объясняет, почему лес, прибитый к океанскому берегу, так высоко ценится для топки каминов. Долгое время находясь в море, бревна адсорбируют большое количество разных веществ, и при горении бревен эти вещества окрашивают пламя во множество разных цветов.
Цвет пламени
Нетрудно догадаться, что оттенок пламени определяется химическими веществами, сгорающими в нем, в том случае, если воздействие высокой температуры высвобождает отдельные атомы сгораемых веществ, окрашивая огонь. Чтобы определить влияние веществ на цвет огня, проводились различные эксперименты, о которых поговорим ниже.

Исследования минералов для определения их состава проводятся с использованием бунзеновской горелки. Цвет ее пламени ровный и бесцветный, он не мешает ходу опыта. Бунзен изобрел горелку в середине XIX века.
Он и придумал метод, позволяющий определить состав вещества по оттенку пламени. Подобные эксперименты ученые пытались проводить и до него, но они не обладали бунзеновской горелкой, бесцветное пламя которой не мешало ходу эксперимента. Он помещал в огонь горелки разные элементы на проволоке из платины, так как при внесении этого металла пламя не окрашивается. На первый взгляд метод кажется хорошим, можно обойтись без трудоемкого химического анализа. Достаточно лишь поднести элемент к огню и увидеть из чего он состоит. Но вещества в чистом виде можно встретить в природе крайне редко. Обычно в них в большом количестве содержатся различные примеси, которые изменяют окраску пламени.
Бунзен пытался выделить цвета и оттенки различными методами. К примеру, с помощью цветных стекол. Допустим, если смотреть через синее стекло, не будет виден желтый цвет, в который огонь окрашивается при горении наиболее часто встречающихся солей натрия. Тогда становится различимым лиловый или малиновый оттенок искомого элемента. Но даже такие ухищрения приводили к верному определению состава сложного минерала в очень редких случаях. Большего такая технология не смогла добиться.
В наши дни такую горелку используют только для пайки.
Цветное пламя
Цвет пламени при горении соединений, содержащих металлы — стронций, литий, кальций, натрий, железо, молибден, барий, медь, бор, теллур, таллий, селен, мышьяк, индий, цезий, рубидий, калий, свинец, сурьма, цинк. Цвет пламени спирта
Про спирт: хотя чистый этиловый спирт горит синим пламенем, а метиловый спирт горит зелёным пламенем — технические присадки поменяют цвет в соответствии с таблицей ниже, что не позволяет достоверно отличить метиловый спирт от этилового по цвету пламени, да и остальные способы малонадежны. Не пейте неизвестно какой спирт — вероятность умереть, если это метанол, выше 80%.
| Металл, входящий в соединение | Цвет пламени |  |
| Стронций Sr | Темно-красный | |
| Литий Li | Малиновый | |
| Кальций Ca | Кирпично-красный | |
| Натрий Na | Желтый | |
| Железо Fe | Светло-желтый | |
| Молибден Mb | Желто-зеленоватый | |
| Барий Ba | Желтовато-зеленый | |
| Медь Cu | Ярко-зеленый или сине-зеленый | |
| Бор B | Бледно-зеленый | |
| Теллур Te | Зеленый | |
| Таллий Tl | Изумрудный | |
| Селен Se | Голубой | |
| Мышьяк As | Бледно-синий | |
| Индий in | Сине-фиолетовый | |
| Цезий Cs | Розово-фиолетовый | |
| Рубидий Rb | Красно-фиолетовый | |
| Калий K | Фиолетовый | |
| Свинец Pb | Голубой | |
| Сурьма Sb | Зелено-синий | |
| Цинк Zn | Бледно сине-зеленый |
Видео
Молекулярные спектры
Существует третий и самый важный в нашем деле вид спектров — молекулярный спектр. Молекулярный спектр испускается молекулами различных сильно нагретых веществ в газообразном состоянии. В отличие от атомов молекулы имеют более сложную структуру и могут поглащать энергию увеличивая например скорость вращения или усиливая колебания атомов относительно друг друга, это приводит к тому что у молекулы помимо электронных уровней энергии (как у атомов) существуют еще колебательные и вращательные уровни энергии и соответствующие им возбужденные состояния. Переходы молекул между вращательными и калебательными состояниями характеризуются гораздо меньшими энергетическими изменениями, поэтому испускаемые при этом электромагнитные волны имеют гораздо меньшую энергию и соответственно намного меньшую длинну (смотри формулу планка E = hv). Таким образом линии соответствующие вращательным и калебательным переходам лежат в инфракрасном и микроволновом диапазонах, не видимых глазом. Их казалось бы можно считать несущественными, но если быть более внимательными то можно понять что молекула межет одним скачком перемещаться не только между вращательными и калебательными уровнями но и одновременно со скачком в электронном энергетическом уровне. Этот важный момент приводит к тому что любой электронный уровень содержит в близком по энергии соседством с собой множество калебательных и электронных уровней, и таким образом при переходах молекулы с одного электронного уровня на другой она может попасть на любой из соседствующих с этим электронным уровнем вращательный и калебательный уроветь. На практике это приводит к тому что спектр образующийся при переходах между электронными уровнями молекул, уже не является линейчатым так как полоса каждого электронного перехода соседствует с множеством других полос соответствующих тому же электронному переходу но ведущему на иной калебательный или вращательный уровень. Таким образом линии молекулярного спектра «размыты» и являются уже не линиями а полосками, поэтому молекулярные электронные спектры (которые так же как и линейчатые атомные лежат в видимом диапазоне) называют полосатыми спектрами. Полосатые спектры харектерны для нагретых газов и газообразных твердых веществ находящихся в молекулярном состоянии.
Очевидно что этот вид спектров так же имеет прямое отношение к пиротехнике, так как многие области плосатого спектра лежат в пределах одного цвета и имеют большую яркость, чем легко можно воспользоваться для придания пламени окраски. Беглого взгляда на рисунок выше достаточно чтобы увидеть что яркость крассной области в приведенном спектре заметно выше чем яркость других областей и вещество образовавшее этот полосатый спектр можно использовать для создания красного пламени. Логично возникает правда вопрос почему светится весь диапазон волн а не только полосы? Дело в том что так же как и в случае с атомами не все молекулы светящегося газа находятся в возбужденном состоянии и излучают плосы, часть молекул до сих пор находится на основном (низшем) — стабильном энергетическом уровне, переходить этим молекулам некуда и поэтому они светят как простое нагретое тело давая фон из слабого спошного спектра — этот фон называется континиумом. Континиум виден тем ярче чем ниже температура и чем меньше молекул совершило переход на возбужденный энергетический уровень, если бы условия в пламени позволили перейти большей части молекул в возбужденное состояние то континиум был бы практически необнаружимым.
Молекулярные спектры применяются для цветных пламен исключительно широко и практических примеров их применения великое множество, но в качестве элюстрации я приведу например состав красного огня основанного на молекулярном свечении монохлорида стронция образующегося при горении состава содержащего 35 массовых процента перхлората аммония (NH4ClO4), 37% нитрата стронция (Sr(NO3)2), 17.5% уротропина ((СH2)6N4), 7.5% идитола (C13H12O2) и 2.5% тиомочевины (SC(NH2)2):
В следующем разделе мы детально разберем особенности спектров окрашивающих пламя веществ и выясним условия при которых наблюдается наилучшее окрашивание пламени. Зная эти условия мы сможем создавать составы необходимого нам цвета пламени.
Синие огни
Для получения синих пламен в пиротехнике применяют соли меди. Составы синего огня являются святым граалем пиротехники, потрачены сотни лет, испытаны тысячи составов но до сих пор не найдено способа добиться чистого синего пламени. Даже самые страшные ухищрения не позволяют поднять чистоту цвета синего пламени выше 40%. Это связано в первую очередь с особенностями спектров и спектрообразования солей меди, а так же множеством практических трудностей связанных с получением хотя бы самого примитивного синего окрашивания. Единственными молекулярными излучателями синего цвета является монохлорид меди (СuCl) и монобромид меди (СuBr), которые в отличие от моногалогенидов стронция и бария устойчивы и при комнатной температуре и весьма капризны как в химическом плане так и в плане своего свечения. Ниже приведена диаграмма со структурой спектров высокотемпературных соединений меди свечение которых используются для создания синих огней:
Как видно из приведенной диаграммы гидрокись меди (CuOH) имеет свечение в желто зеленой области спектра, поэтому при ее образовании в пламени сообщает ему зеленое окрашивание. Очевидно что составы на гидрокиси меди применяться не могут, но ее излучение играет важную роль, поскольку она всегда в той или иной степени присутствует в пламени из за неполного взаимодействия галогена поставленного донором c окисью меди, а так же за счет повторного окисления моногалогенида в областях богатых кислородом или его взаимодействия с водяным паром.
Излучение монохлорида меди (СuCl) приходится в основном на сине — голубую часть спектра. Излучение в сине голубой области соответствует переходам из 2-5 возбужденных состояний, а линия в зеленой области соответствует переходу из первого возбужденного состояния. Интенсивность этой линии не слишком высока и не мешает использованию хлорида меди в составах синего пламени.
Излучение монобромида меди (СuBr) так же приходится на сине — голубой участок спектра. Но возбуждается оно несколько легче потому как голубой цвет излучается уже из первого возбужденного состояния, узлучение в синей области соответствует 2-му и третьему возбужденным состояниям. СuBr излучает в более глубокой синей области и не имеет линии в зеленой части спектра, что естественно улучшает качество окраски. Таким образом спектр CuBr является несколько более удачным чем для CuCl, и от CuBr можно ожидать несколько большего качества окраски.
Монохлорид и монобромид меди могут вводиться в пламя простым добавлением их в состав пиросмеси. Кроме того монохлорид меди может образовываться в пламени при реакции оксидов меди, которые вводят в состав исходной смеси со свободным хлором (аналогичным путем монобромид получить нельзя так как доноры брома недоступны):
В состав пиросмеси в качестве окрашивающего компонента можно вводить так же негигроскопичные соли лекгоразлогающиеся при нагревании до любого из оксидов меди, такой солью является например малахит: (оксалат меди для этой цели не подходит так как при разложении образует металическую медь и СO2):
Образующийся оксид меди может образовывать монохлорид меди по рекции приводившейся выше. В пламени содржащем кислород и водяной пар могут протекать и обратные реакции, например образование окиси и гидрокиси меди, при этом пламя окрашивается в характерный для CuOH зеленый цвет:
2СuCl + H2O => Cu2O + 2HCl СuCl + H2O => CuOH + HCl 2СuCl + O2 = 2CuO + Cl2
Проблема окисления CuCl кислородом настолько остра, что нелегко получить пламя даже самого простейшего синего оттенка. СuCl черезвычайно легко окисляется кислородом уже при комнтаной температуре, а при более высоких температурах в присутствии кислорода окисление протекает мгновенно и полностью уничтожает окрас. Но и это еще не все, дело в том что помимо химической неусточивости в содержащем кислород пламени для CuCl характерна так же неустойчивость в плане термического разложения, при температурах выше 1200 °С оно протекает проктически нацело уничтожая синий окрас.
Для создания cинего пламени на основе оксидообразующих веществ (например малахита), обязательно применение доноров галогенов, причем желателен значительный избыток хлора, так же очень рекомендуется вводить доноры и в составы содержащие готовый моногалогенид. Введение избытка хлора позволяет затормозить гидролиз CuCl до CuOH, сдвигая равновесие реакции в сторону образования монохлорида меди. К тому же избыток хлора способствует защите СuCl от кислорода. Важным является так же тот факт, что излучение в глубокой синей области у CuCl возбуждается с очень высоких возбужденных состояний (4,5) в то время как у СuOH излучение происходит из 1 и 2-го возбужденных состояний, поэтому очень важно свести любую возможность образования СuOH к минимуму в противном случае легко образующийся CuOH окрашивает пламя в грязно зеленый оттенок.
Проблема отклонения нежелательных спектров для синих огнеи имеет особое значение. Это связано с огромной разницой в энергиях необходимых для возбуждения высоких возбужденных уровней CuCl и очень низких и легко вобуждающихся уровней щелочных металлов которые могут присутствовать в исходной смеси. В случае их присутствия почти вся энергия будет испускаться путем их атомарного свечения. В присутствии дажее крохотных примесей натрия, уничтожение синей окраски носит катострофический характер, и уже в присутствии 2 тысячных процента солей натрия синие окрашивание полностью ликвидируется переходя в желтое атомарное свечение натрия. Это требует очень жестких требований к качеству исходных реактивов, в которых даже ничтожная примесь натрия совершенно недопустима. Что касается примесей твердых и жидких частиц в пламени, то это не имеет столь большого значения поскольку температура синих пламен низка и тепловое излучение частиц в пламени незначительно.
Стоит обратить самое пристальное внимание на температурный режим и среду. Как уже было отмечено выше синее пламя может быть получено лишь в востановительной среде хорошо защищающей СuCl, и только при температурах не более 1200 °С. Поэтому для составления составов синего огня стараются использовать легкоразлогающиеся энергичные окислители, способные поддерживать интенсивное горение при низкой температуре (например хлорат и бромат калия и перхлорат аммония), а так же использовать малокалорийные горючие обычно используемые для снижения температуры пламени (уротропин, сера, лактоза).
Составы имеющие в своем составе CuCl или CuBr являются синим подобием составов на хлорате и бромате бария. Они сразу содержат готовую молекулу излучатель, ликвидируя таким образом необходимость в протекании реакций превращения оксида в галогенид, но в отличие от хлоратных и броматных зеленых аналогов, введение в состав доноров настоятельно рекомендуется. В целом в силу указанных обстоятельств качество цвета составов на готовых моногалогенидах получается несколько выше чем на окисях или малахите.
В общем случае совокупность всех сложностей делает создание синих цветных огней крайне тонким и непростым занятием, и даже в самых удачных условиях чистоту цвета выше 25-30% на практике черезывывчайно трудно. В случае использования в качестве одного из исходных компонентов монобромида меди (СuBr) cитуациая несколько улучшается (поскольку он излучает синий с низких возбужденных состояний, но в остальном все проблемы остаются в силе) и от него можно ожидать несколько большей чистоты цвета но и в этом случае 35-40% составляют фактический предел.
Для пиротехнических составов синего пламени используют следующие соединения меди: СuСl, CuBr, Cu2O, CuO, Cu(OH)2*CuCO3, Cu(OH)Cl ; в качестве окислителей чаще всего используют NH4ClO4 намного реже KClO3 и KBrO3 а еще реже KClO4. В качестве основных топлив используют в основном низкокалорийные горючие дающие низкотемпературное пламя и восстановительную атмосферу: серу, уротропин и лактозу, реже используют горючие чуть большей калорийности например канифоль или уголь. Применение горючих средней калорийности нежелательно хотя и возможно (в разумных пределах) а использование высококалорийных металлических горючих полностью исключается. В качестве доноров хлора используют: гексахлорэтан (ГХЭ) или гексахлорбензол (ГХБ), поливинилхлорид (ПВХ), а так же используют составы на CuCl и СuBr.

Как нетрудно заметить составы идут по качестуву своего цвета слева направо, состав на окиси меди оказался оаутсайдером что впрочем и следовало ожидать. Поиски качественных огней синего цвета продолжаются постоянно уже очень долгое время, и я тоже в свое время очнь долго и упорно бился над синим пламенем, испытав около 40-50 составов из взятых из книг а также придумав и испытав примерно такое же количество своих собственных, я выделил 2 состава справа как безспорных фаворитов в своем классе. Если вдуг вам, дочитав до конца это руководство удастся создать что то лучшее дайте мне знать 🙂