какой металл самый легкоплавкий
Температура плавления металлов. Самый тугоплавкий и легкоплавкий металл
Почти все металлы при нормальных условиях представляют собой твердые вещества. Но при определенных температурах они могут изменять свое агрегатное состояние и становиться жидкими. Давайте узнаем, какая температура плавления металла самая высокая? Какая самая низкая?
Температура плавления металлов
Большая часть элементов периодической таблицы относится к металлам. В настоящее время их насчитывается примерно 96. Всем им необходимы разные условия, чтобы превратиться в жидкость.
Порог нагревания твердых кристаллических веществ, превысив который они становятся жидкими, называется температурой плавления. У металлов она колеблется в пределах нескольких тысяч градусов. Многие из них переходят в жидкость при относительно большом нагревании. Благодаря этому они являются распространенным материалом для производства кастрюль, сковородок и других кухонных приборов.
Средние температуры плавления имеют серебро (962 °С), алюминий (660,32 °С), золото (1064,18 °С), никель (1455 °С), платина (1772 °С) и т.д. Выделяют также группу тугоплавких и легкоплавких металлов. Первым, чтобы превратиться в жидкость, нужно больше 2000 градусов Цельсия, вторым – меньше 500 градусов.
К легкоплавким металлам обычно относят олово (232 °C), цинк (419 °C), свинец (327 °C). Однако у некоторых из них температуры могут быть еще ниже. Например, франций и галлий плавятся уже в руке, а цезий можно греть только в ампуле, ведь от кислорода он воспламеняется.
Самые низкие и высокие температуры плавления металлов представлены в таблице:
Легкоплавкие металлы – список, особенности и значение для человека
Однозначности в классификации этой группы металлов у специалистов нет. Их главное свойство содержится в названии – легкоплавкие металлы.
Что представляет собой
Как понятно из названия, легкоплавким считается металл с малой температурой плавления.
В номенклатуре, принятой Международным союзом теоретической и прикладной химии (ИЮПАК), термин «легкоплавкие металлы» отсутствует.
У специалистов единства тоже нет. Одни выставляют «порог плавления» в 500°С. Для других легкоплавким металлом является металл, расплавляющийся при менее 600°С.
Перечень
В соответствии с основной классификацией (температура плавления не более 500°С), к списку легкоплавов причислены следующие элементы:
| Название | Температура плавления (°С) |
| Цинк | 419 |
| Палладий | 327 |
| Свинец | 327 |
| Кадмий | 321 |
| Таллий | 303 |
| Висмут | 271 |
| Полоний | 254 |
| Олово | 232 |
| Индий | 157 |
| Натрий | 98 |
| Калий | 63 |
| Рубидий | 39 |
| Галлий | 30 |
| Цезий | 28 |
| Ртуть | – 39 |
Ртуть – самый легкоплавкий металл. Она единственная из группы плавится на морозе.
Галлий называют металлом, тающим в руках (нормальная температура тела человека выше точки плавления вещества почти на семь градусов).
Классификация
Легкоплавы подразделяются на две группы:
К драгоценным элементам причислен палладий.


Олово, таллий, свинец, цезий – мягкие легкоплавы.

Самый мягкий легкоплавкий металл – цезий (0,2 по шкале твердости Мооса).
Где и как применяются
Для всех сфер применения решающее преимущество данной группы – низкая температура плавления.
Особенности использования
На основании этого свойства легкоплавких металлов определены способы использования:
Легкоплавкие сплавы – это конгломерат металлов с температурой плавления не выше «оловянной» (232°С). Нижний предел – минус 61°C. На таком холоде плавится амальгама таллия.
Области применения
Сферы применения материала: энергетика, машиностроение, электро-, радиотехника, химпром:
Это также проводники, антикоррозионные покрытия, компонент антифрикционных сплавов.
Используются уникальные свойства отдельных позиций из списка легкоплавов:
Легко плавящиеся сплавы образуют также щелочные металлы. На практике такие материалы используются мало из-за чрезмерной химической активности.
Биологическое воздействие
Влияние легкоплавов на организм человека различно:
Самый легкоплавкий металл
Каждый человек множество раз держал в руках самый легкоплавкий металл, причём без всяких последствий. Речь идет о ртути, грозном и загадочном элементе из подгруппы цинка, занимающем в периодической таблице атомный номер 80.
Общие сведения
Название переводится с греческого, как «серебряная вода». На латинском звучит как hydrargyrum, а в русском это толкование праславянского — «катиться». Первая цивилизация шумеров уже вовсю использовала ртуть. Металл добывали из киновари (сульфида ртути) просто обжигая руду, или же из пород, где его видно в виде небольших вкраплений.
Это редкий элемент — общая доля в земных недрах составляет всего 83 мг на одну тонну, причем чаще в рассеянной форме, чем в виде месторождений. Больше всего ее содержится в сульфидах и сланцах, а всего в мире имеется более 20 минералов со ртутью.
Самый легкоплавкий металл
Всего 7 металлов плавятся при минусовой температуре. Литр ртути очень тяжелый — 13,5 кг, а закипит она при +357°С.
Интересно что доказательства ее принадлежности к металлам были опубликованы только в середине XVIII века Брауном и Ломоносовым. Они смогли заморозить ртуть и убедиться в ее металлических свойствах: ковкости, электропроводности, расширении при нагреве.
Самый токсичный металл
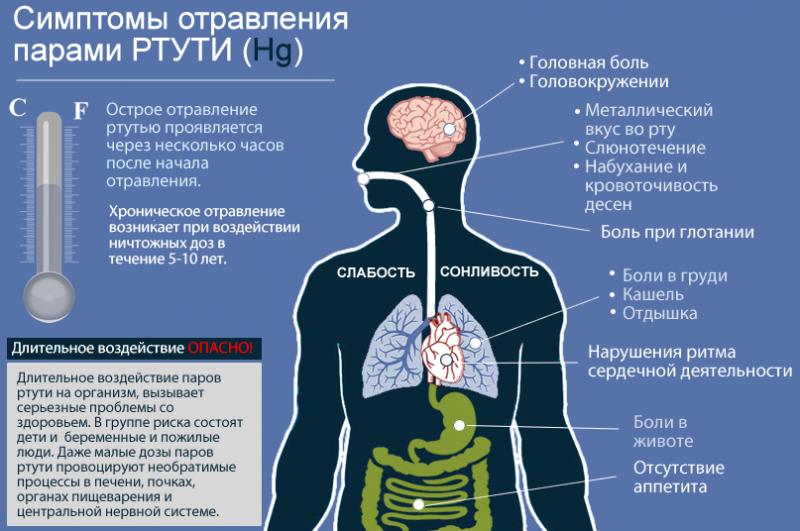
Ртути принадлежит высочайшая степень токсичности. Это самый ядовитый из всех нерадиоактивных элементов на планете, который начинает распространять свои пары при комнатной температуре. Если рядом присутствует человек, происходит поражение пищеварения, легких и нервной системы, причём первые признаки интоксикации наступают очень быстро, через 8 часов.
Симптомы отравления ртутью
И даже воздействие небольших доз, но длительный период, способно проявить себя в виде хронических заболеваний. Нервная система в первую очередь реагирует раздражением, недосыпанием, головными болями и быстрой усталостью. Выводится ртуть через почки. Начинаются частые позывы к мочеиспусканию, повышение температуры, рвота, слабость, тошнота, дрожь в теле.
Самая известная экологическая трагедия XX века, болезнь Минамата, вызвана отравлением метилртутью. Промышленное загрязнение бухты этого японского города в 1956 году привело к 3 тыс. жертв.
Люди всегда знали о токсических свойствах ртути. Например, при изготовлении фетровых шляп использовались ртутные соединения, но другого способа тогда не было. У мастеров часто развивались поражения нервной системы и слабоумие. Поэтому безумный Шляпник, описанный Льюисом Кэрроллом в «Алисе в стране чудес», совсем не выдуманный персонаж.
Безумный Шляпник из “Алисы в стране чудес”
В обычной жизни пищевые отравления грозят любителям морепродуктов. Ртуть содержится и растворяется в морской воде, накапливаясь в организмах его обитателей.
Симптомы хронического отравления часто встречаются в прибрежных районах по всему миру. Особенно страдают беременные и дети, у которых это основная пища. Умеренная олигофрения диагностируется там намного чаще, чем у тех групп, где морская рыба не является основным источником питания.
Хищники, поедая мелочь, сохраняют и приумножает отраву в своих организмах. У каждой четвертой выловленной рыбы содержание металла превышает допустимые пределы. Особенно много его в тунце и лобстере. Экологи бьют тревогу, а компании по производству рыбных продуктов открещиваются. И никакая тепловая обработка не делает мясо менее токсичным.
Использование самого легкоплавкого металла в быту
Несмотря на токсичность, человечество до сих пор не может отказаться от ртути.
Хорошая электропроводимость делает ее незаменимой в энергосберегающих лампах, паровых турбинах, вакуумных и диффузных насосах. Умение реагировать на малейшие колебания температуры и давления используется в барометрах и термометрах.
Фульминат ртути (взрывчатое вещество)
Не могут отказаться от ртути при окрашивании бортов корабля. Морские микроорганизмы всегда селятся там и существенно разрушают обшивку. Только краска на основе «серебряной воды» помогает сохранить судно.

Человечество с самых древних времен использовало ртуть для добычи из руды драгоценных металлов. Ртуть создает сплавы со всеми металлами (амальгамация) и только благодаря ей добыча серебра и золота в Мексике конкистадорами, начиная XVI века, достигла таких впечатляющих размеров и изменила весь мир.
Добыча золота ртутью
Никогда ртуть не транспортируют в самолетах, причем дело не в токсичности. Ртуть хорошо вступает в контакт со всеми металлами, делая их ломкими. Особенно это касается алюминиевых сплавов — случайная авария может повредить самолет.
Использование самого легкоплавкого металла в медицине
Ядовитый металл чаще всего встречался в эликсирах бессмертия и лекарствах для продления жизни. Алхимики пробовали добывать золото прямо из ртути, только сначала ее надо было нагреть. Ртуть называли праматерью металлов, она входила в теорию трех начал (с серой и солью) и была основным элементом философского камня.

Даже магические действия шаманов не могли обойтись без ртути. Распыляемым порошком киновари отпугивали нечистых духов. Несмотря на токсичность, «серебряную воду» активно использовали древние врачи практически во всех сферах своей деятельности.
Древнеегипетские жрецы клали немного ртути в сосуд и помещали в горло фараона, чтобы обезопасить его в загробной жизни.
В Индии йоги пили ртутно-серный напиток и утверждали, что таким образом можно продлить жизнь. Одним из самых вопиющих случаев в древности было лечение заворота кишок с помощью данного химического элемента.
Врачи были уверены, что жидкое серебро должно замечательно проходить сквозь человеческие кишки, распрямляя их. Но данный способ почему-то не прижился, так как у пациентов от большого объема высокоплотного «лекарства» происходил разрыв желудка.
Утверждают, что Иван Грозный стал жертвой именно ртути. Предположительно, ему или лечили сифилис, или давали лекарства, содержащие ртуть. То, что русский царь умер в результате ртутной интоксикации и имел деформации костей, свойственные глубоким старикам, уже доказано несколькими учеными.

Историки отмечали, что перед смертью царь очень изменился. Постоянная свирепость, искаженные черты лица, на теле не осталось ни единого волоса. Постоянные эпилептические припадки служили очередным доказательством отравления.
Интересно, что мгновенно покончить с жизнью с помощью ртути ни у кого не получалось. Когда самоубийцы выпивали металл — все они выживали. Самыми опасными являются пары и раствор, а сама ртуть никогда не растворится в желудке и выйдет из организма.
В 70-х годах в продаже можно было встретить множество препаратов с ртутью: мочегонные, слабительные, в мазях для отбеливания лица и антисептиках.
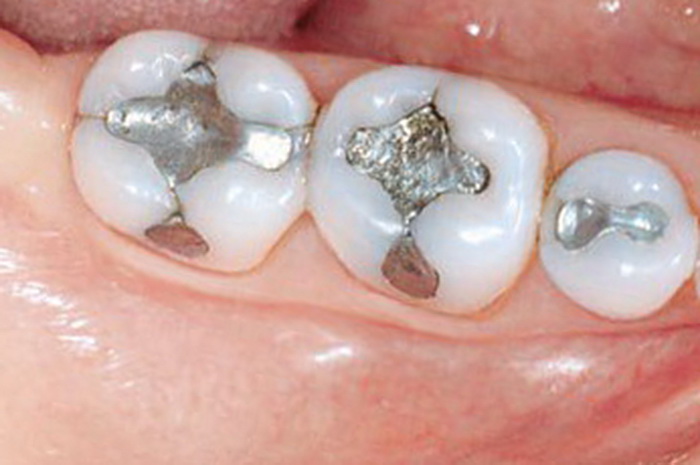
Амальгама серебра не так давно была распространенным пломбировочным стоматологическим материалом в России и до сих пор используется в дешевых пломбах за рубежом.
Самый легкоплавкий металл на планете необходим человечеству по-прежнему. А вот смогут ли люди дружить с ним, не отравляя жизнь вокруг — очень спорный вопрос…
7 областей применения самого легкоплавкого металла
Самый легкоплавкий металл: разбор понятия + обзор 7 элементов группы легкоплавких металлов + обзор, какой металл считается самым легкоплавким + область применения материала в промышленности и быту.
У каждого элемента из группы металлов имеются уникальный перечень физических и химических свойств, благодаря которым те могут служить на благо человечества. Температура плавления – отнюдь не последний показатель в данном вопросе.
Если речь о металлических элементах, то здесь происходит преобразование из твердого состояния в жидкое при достижении пикового значения по температуре.
Сегодня мы разберем самый легкоплавкий металл и его ближайших соседей по характеристике – рассмотрим свойства, особенности и области применения элементов периодической системы в промышленности и повседневной жизни человека.
Суть понятия самого легкоплавкого металла
Для специалистов больше знакомо понятие «тугоплавкость». Хотя слово «легкоплавки» и является антонимом в языковом аспекте, на практике – это один из пунктов к общей классификации в промышленности. По своей сути, любой элемент, имеющий температуру плавления менее 600 градусов по Цельсию, называют легкоплавким. Некоторые источники ставят планку вхождения в группу еще ниже – до 500 градусов Цельсия.
Классификация металлов по плавкости:
Процесс плавления одинаковый для всех металлических элементов – либо внешнее воздействие, либо внутреннее. В первом случае – это расплавка в печах, а во втором – разогревание через пропуск электрического тока сквозь металл. Иногда используется индукционный нагрев в электромагнитном поле с высокой частотой.
Процесс плавки металла через призму науки:
В зависимости от температуры плавления, выбирают аппараты из сплавов, способных выдержать пиковые значения. Для легкоплавких металлов вопрос решается проще всего.
Второй весомый параметр – температура кипения металла. В 95% случаев она в 2 раза выше температуры плавления. Между собой эти две величины являются прямо пропорциональными + при снижении/увеличения давления на материал, снижается и его показатели плавления с кипением.
ТОП легкоплавкости + области применения
Обратите внимание: легкоплавкие сплавы состоят из соответствующих металлов, но пиковая температура плавления таких элементов не должна превышать 232 градуса.
Если взглянуть на таблицу легкоплавких металлов выше, мы поймем, что граничным материалом будет именно олово. Все остальные легкоплавкие металлы, температура плавления которых выше, как легирующие добавки используются редко.
1) Обзор группы легкоплавких металлов промышленного назначения
Широчайшее применение имеет 9 легкоплавких материалов – цинк, свинец, кадмий, таллий, висмут, олово, индий, галлий и ртуть. Далее мы по каждому из элементов подадим краткую характеристику + область применения в быту и промышленности человеком.
А) Цинк (Zn)
| Распространенность | ★★★★★ (5.0 из 5.0) | Общая привлекательность в промышленности ★★★★★ 4.5 |
| Стоимость | ★★★★(4.0 из 5.0) | |
| Применение | ★★★★(4.0 из 5.0) |
Первые упоминания цинка в неявном виде пришли к нам из древней Греции и Египта – он там был составляющим элементом латуни. Первое промышленное изготовление цинка было запущено в 1743 году в городе Бристоле, а в 1746 был разработан метод получения металла путем прокаливания окиси смеси с углем без доступа кислорода с дальнейшим охлаждением паров в холодильном оборудовании.
Химические и физические свойства цинка:
В природе существует 65+ минералов с содержанием цинка. В земной коре металл содержится на уровне 8*10^(-3) %. В воде цинк также присутствует и активно мигрирует в термальных потоках на ровне со свинцом. Крупнейшие месторождения цинка – Иран, Австралия, Боливия и Казахстан.
Область применения цинка:
Физиологическая ценность цинка заключается в его катализирующих свойствах. Элемент является составляющей инсулина, а его поступление в организм обеспечивается через молоко, мясо и яйца. Недостаток цинка в почве приводит к возникновению болезней растений. В чистом виде металл мало токсичен.
В) Свинец (Pb)
| Распространенность | ★★★★★ (5.0 из 5.0) | Общая привлекательность в промышленности ★★★★ 4.0 |
| Стоимость | ★★★★★ (5.0 из 5.0) | |
| Применение | ★★★(3.0 из 5.0) |
На внешний вид, плюмбум – металл серебристого цвета с беловатым и голубоватым оттенками. Из-за широкого распространения и просты в обработке, свинец использовался еще с древних времен (датируется 6 400 лет до н. э.). Промышленная отладка производства свинца началась в 1840 году, а к концу 20-го века уровень его добычи снизился из-за понижения спроса. Металл начали замещать другими материалами, которые менее опасны для здоровья человека.
| Физические свойства | Химические свойства |
|---|---|
| Низкая теплопроводимость – 35 Вт/(м*к), но это при температуре в 0 градусов. | При взаимодействии с кислородом получаем оксиды. |
| Высокая пластичность материала. Изделия из олова не составит труда поцарапать, разрезать ножом или согнуть. | Хороший реагент для кислот. |
| Плавится при температуре в 328 градусов, а закипает при нагревании до 1750 градусов. | Взаимодействует с растворами щелочей. |
| Расположен в группе тяжелых металлов. Изначальная плотность в 11.34 грамма на сантиметр кубический постепенно падает по мере повышения температуры в окружении. | Некоторые соединения на основании свинца обладают повышенными кислотными свойствами, что переводят вещество в разряд окислителей. |
| При достижении точки температуры в 7.26 кельвина становится сверхпроводником. |
В основе производства свинца руды с галенитом. Через флотацию формируют концентрат с 50%-80% чистого вещества, а далее одним из 4 методов получают черновой свинец. Основными добытчиками свинца является США, Китай и Россия.
Где применяют свинец:
В медицине свинец применяется как защитник от излучения в рентгеновских аппаратах. Стоимость одного килограмма свинца более чем приемлема – 2-3 доллара. Нельзя забывать и о токсичности химического элемента. Хотя сам по себе свинец и не токсичен, того нельзя сказать о массе его производных соединений.
С) Кадмий (Cd)
| Распространенность | ★★★★(4.0 из 5.0) | Общая привлекательность в промышленности ★★★★ 4.0 |
| Стоимость | ★★★★★ (5.0 из 5.0) | |
| Применение | ★★★(3.0 из 5.0) |
Очередной мягкий и ковкий металл с проявлением тягучих свойств. По расцветке – это серебристо-белое вещество. С древних времен не распространялся. Открыт только в 1817 году немцем Штромейером. Название придумано тем же человеком, и происходит от руды, с которой добывали на то время цинк. Массовая доля кадмия в отношении массы земной коры составляет 130 миллиграмм на тонну. В воде элемент также присущ – от 0.11 микрограмма на литр. В природе имеется всего 6 минералов с содержанием кадмия, но из-за их широкого распространения, вещество по частоте проявления приравнивают цинку.
Физические свойства кадмия:
Почти 40% кадмиевого производства отправляется для создания антикоррозийных покрытий на другие сплавы. Кадмирование относится к электролитическим процедурам и один из лучших способов сделать детали с инструментами менее восприимчивыми к коррозии. Порядка 20% элемента используют в качестве добавки в красящие вещества. Из прочих областей применения – пленочные солнечные батареи, компонент полупроводников, пайка алюминия и криогенная техника. В больших концентрациях соединения на основе кадмия ядовиты.
D) Таллий (Tl)
| Распространенность | ★★★★(4.0 из 5.0) | Общая привлекательность в промышленности ★★★ 3.0 |
| Стоимость | ★★★★(4.0 из 5.0) | |
| Применение | ★★(2.0 из 5.0) |
Таллий относится к группе легкоплавких металлов – температура плавления от 304 градусов, а кипения – от 1473 Цельсия.
Открытие металла произошло в 1861 году англичанином Круксом через спектральный метод, а название получено из-за зеленых линий спектра. Дословно Таллий переводится с греческого как «зеленая ветвь». Таллий относится к элементам рассеянного типа. Существует только 7 минералов с содержанием частичек металла в неявном виде. Среднее содержание в рамках земной коры – 3.5*10 в (-5) степени.
Из физических свойств выделим сверхпроводимость при температуре выше 2.39 Кельвина, твердость по Моосу в 1.3 (по Бриннелю 20 МПа). По химии – реакции с неметаллами, хорошая растворимость в азотной и серной кислотах + инертность в отношении реакции с щелочами. Значительной биологической роли в жизнедеятельности человека талий не играет. Металл относится к ядам кумулятивного типа, а при больших концентрациях вещество способно вызвать поражения почек, нервной системы и желудочно-кишечного тракта.
E) Висмут (Bi)
| Распространенность | ★★★(3.0 из 5.0) | Общая привлекательность в промышленности ★★★★ 4.0 |
| Стоимость | ★★★★★ (5.0 из 5.0) | |
| Применение | ★★★★(4.0 из 5.0) |
Физические свойства висмута:
Висмут относится к редким металлам. Ежегодная добыча в чистом виде едва ли достигает отметки к 6 200 тонн ежегодно. Основные поставщики вещества на мировой рынок – Германия, Монголия, Австралия, Перу и Россия. Цена на металл непостоянна и меняется от уровня спроса. В 2020 году, к примеру, 1 килограмм висмута можно приобрести за 12$.
F) Олово (Sn)
| Распространенность | ★★★★(4.0 из 5.0) | Общая привлекательность в промышленности ★★★★ 4.0 |
| Стоимость | ★★★★★ (5.0 из 5.0) | |
| Применение | ★★★★(4.0 из 5.0) |
История олова начинается еще с 4 века до нашей эры, но в чистой форме вещество было получено только в 21 веке. Происхождение названия металла – чисто славянское. Температура плавления олова составляет 231 градус, а кипения – 2 620 по Цельсию. Разница между показателями более чем заметна. Модуль упругости 55 ГПа, а временное сопротивление на разрыв – 20 МПа. Твердость по Бринеллю 152 МПа у белого и 62 МПа у серого олова. Температура литья – 260-300 по Цельсию.
Область применения олова:
Олово относят к рассеянным редким элементам. В земной коре его процент разнится – от 2 до 8 умноженное на 10 в (-3) степени. Основным минералом для добычи олова считается касситерит, в котором содержится почти 80% чистого вещества. На втором месте – станнин, который более известен как оловянный колчедан (30%). Основные месторождения металла – Китай и Юго-восточная Азия. Достоверной информации о физиологическом воздействии олова на организм пока не имеется, но передозировки могут привести к отравлению и хроническим заболеваниям легких.
G) Индий (In)
| Распространенность | ★★(2.0 из 5.0) | Общая привлекательность в промышленности ★★★ 3.0 |
| Стоимость | ★★★(3.0 из 5.0) | |
| Применение | ★★★★(4.0 из 5.0) |
Металл был открыт двумя немцами Рейхом и Рихтером в 1863 году. Многие могут предположить, что название сродни одноименной стране на карте мира, но на самом деле свое обозначение металл получил из-за синего цвета (индиго) линий в спектре. Вещество в природе можно добыть из 5 минералов, а его общая доля в отношении земной коры составляет всего 10 в (-5) степени, что делает вещество в чистом виде как редким, так и дорогим (от 100 долларов за 1 килограмм).
Где применяется индий:
Температура плавления металла составляет 157 градусов, а кипения – 2072 градуса. Критическая температура для возникновения сверхпроводимости составляет 3.404 К. Твердость по Бринеллю 9 МПа, а по Моосу 1.2. Производство индия происходит из отходов цинка, реже свинца и олова. Ярко выраженной биологической роли металл для человека не имеет.
2) Какой самый легкоплавкий металл + область его применения
А) Ртуть – ТОП-1 по легкоплавкости в мире
В исторической справке металл известен с древности. Впервые чистую ртуть химическим путем получили в 1735 году. Сделал это швед-химик Брандт. По уровню распространения в природе, ртуть имеет концентрацию в 83 мг/тонну. Концентрация чистого вещества в ртутных рудах сравнительно высока и может достигать 2.8%-3%. В природе известно порядка 20 минералов с содержанием чистого вещества.
Плотность ртути меняется в зависимости ото температуры окружения. В нормальных условиях, при комнатной температуре – то 13 550 килограмм на метр кубический. Температура кипения чистого элемента составляет 357 градусов. Имеет диамагнетические свойства + способен образовывать с прочими металлами сплавы твердого и жидкого типов. В химическом плане ртуть малоактивная.
Области применения ртути:
Все соединения ртути, как и сам материал ядовиты, потому, широкого распространения элемент в промышленности и быту человека не приобрел. В 21 веке направления использования ртути можно с успехом заменить на более безопасные элементы. Да, чуть дороже, но здоровье превыше всего.
Развернутая информация о самом легкоплавком металле на земле:
Б) Галлий (Ga) – металл, тающий в руках
Если говорить о наглядности, то обойти стороной рассматриваемый металл нереально. Температура тела человека 36.6, а галлий тает при температуре в 29.8 градуса. То есть, если взять металл в руки, он начнет растекаться – забавное зрелище. Существование элемента было предсказано самим Менделеевым, но впервые выделить металл удалось только в 1875 году Де Буабодраном.
На тонну земной коры приходится порядка 19 грамм галлия. Металл является типичным рассеянным химэлементом у которого двойная геохимическая природа. В чистой форме встретить металл нельзя, но в отношении количества минералов с его содержанием, может дать фору многим. Основными месторождениями галлия является страны Юго-Западной Африки, Россия и некоторые страны СНГ.
Где применяется галлий:
Элемент относится к малотоксичным веществам + биологически важной роли в жизни человека не имеет. Хотя галлий и не самый легкоплавкий металл, его поведение в руках человека многих вводит в заблуждение.
Существуют и другие участники ряда металлов таблицы Менделеева с небольшой температурой плавления, но из-за их малой области применения, рассматривать в рамках нашего сайта их просто нет смысла.