какой микроскоп необходимо использовать в реакции иммунофлюоресценции
Какой микроскоп необходимо использовать в реакции иммунофлюоресценции
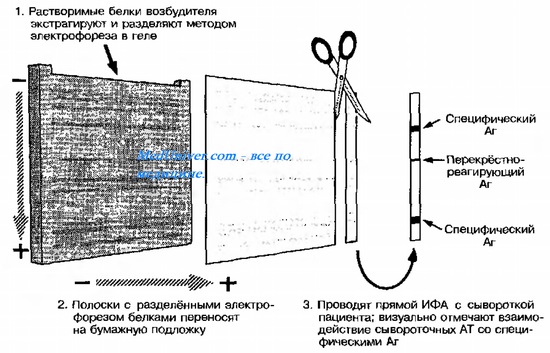
Иммуноблотинг [от англ. blot, пятно] — метод идентификации Аг (или AT) с помощью соответствующих известных сывороток (или Аг). На практике применяют для идентификации Аг ВИЧ. Первоначально электрофорезом в полиакриловом геле выделяют Аг вируса (на практике эту процедуру не проводят, а используют коммерческий реагент). Затем на полосы преципитата накладывают носитель (нитроцеллюлозную плёнку или активированную бумагу) и продолжают электрофорез. После чего на плёнку наносят сыворотку пациента и инкубируют.
После отмывания несвязавшихся AT (при их наличии) проводят ИФА — на плёнку наносят антисыворотку к Ig человека, меченную ферментом, и хромогенный субстрат, изменяющий окраску при взаимодействии с ферментом. При наличии комплексов Аг-АТ-антисыворотка к lg на носителе появляются окрашенные пятна (рис. 10-20).
Реакция иммунофлюоресценции (РИФ)
Реакция иммунофлюоресценции (РИФ) разработана А. Кунсом (1941) и основана на применении AT, меченных флюорохромными красителями. Такие AT, связывая различные Аг, вызывают свечение иммунных комплексов в УФ-лучах люминесцентного микроскопа. На практике применяют несколько вариантов РИФ.
— Вернуться в оглавление раздела «Микробиология.»
Какой микроскоп необходимо использовать в реакции иммунофлюоресценции
Выявление возбудителя аденовирусной инфекции (Adenovirus), в основе которого лежит обнаружение в биоматериале комплексов антигена аденовируса с меченными флюорохромом антителами.
Какой биоматериал можно использовать для исследования?
Мазок урогенитальный, мазок из носоглотки, мазок с конъюнктивы.
Как правильно подготовиться к исследованию?
Не принимать пищу в течение 2-3 часов до исследования, можно пить чистую негазированную воду.
Общая информация об исследовании
Аденовирусы – это ДНКсодержащие вирусы семейства Adenoviridae, из которых свыше 50 серотипов болезнетворны для человека, наиболее часто заболевания вызывают серотипы 1-8, 11, 35, 37, 40 и 41. Аденовирусы широко распространены и встречаются как в виде единичных случаев, так и в виде эпидемических вспышек. Источник инфекции – больной человек или вирусоноситель, у которых вирусы выделяются до 3-7-го дня болезни с отделяемым верхних дыхательных путей и конъюнктивы и до 3 недель с фекалиями. Путь передачи – воздушно-капельный или пищевой. Инкубационный период в среднем составляет 5-7 дней.
Аденовирусы вызывают развитие острых заболеваний, протекающих с преимущественным поражением органов дыхания, глаз и лимфатических узлов. Наиболее частыми клиническими формами аденовирусной инфекции являются ОРВИ, фарингит, фарингоконъюнктивальная лихорадка, тонзиллит, средний отит и эпидемический кератоконъюнктивит. Возможно поражение органов желудочно-кишечного тракта с аденовирусным гастроэнтеритом (у детей гастроэнтерит обусловлен серотипами 40 и 41). Аденовирусная инфекция может быть причиной инфекционно-аллергических заболеваний, таких как астматический бронхит, ларинготрахеит и др. Обычно болеют дети, особенно младшего возраста, у которых инфекция протекает тяжелее (с бронхиолитами, пневмониями и т. д.).
Аденовирусная инфекция нередко встречается у иммунокомпрометированных лиц (перенесших трансплантацию органов или костного мозга), поражая трансплантированные органы и системы (гепатит при трансплантации печени, геморрагический цистит или паренхиматозное поражение почек при трансплантации почек), однако при генерализации инфекции могут также страдть легкие, кишечник и центральная нервная система. Аденовирусная инфекция часто встречается при СПИДе и чаще всего затрагивает мочеполовой и желудочно-кишечный тракт.
Генерализация инфекции чаще наблюдается у детей и иммунокомпрометированных лиц и может привести даже к летальному исходу; как правило, она обусловлена 3-м, 7-м, 21-м и 30-м серотипами вируса. В некоторых случаях аденовирус может быть причиной острого геморрагического цистита и других заболеваний мочеполовой системы, а серотипы 1, 6, 12 и особенно 7 способны вызывать спорадический энцефалит и менингоэнцефалит (в том числе как осложнения после ОРВИ). У пациентов с гипогаммаглобулинемией может развиваться хронический менингоэнцефалит, обусловленный аденовирусами 7-го, 12-го и 32-го серотипов.
Для диагностики аденовирусной инфекции применяют методы культивирования вируса, определение его антигена или ДНК в тканях или крови, а также серологические методы (4-кратное увеличение титра антитела в парных сыворотках). Наиболее быстрый и высокоспецифичный (до 90 %) способ диагностики аденовирусной инфекции – иммунофлюоресцентная микроскопия. Она основана на непосредственном связывании антигенов аденовируса в биоматериале с меченными флюорохромом антителами с образованием комплексов антиген-антитело и последующей их микроскопии в ультрафиолетовом свете. Под воздействием ультрафиолета флюорохром начинает светиться, что позволяет быстро выявить антиген аденовируса.
Для чего используется исследование?
Когда назначается исследование?
Что означают результаты?
| Результат | Интерпретация |
| Отрицательный | Отсутствие специфического свечения |
| Положительный (+) | Слабая, неотчетливая флуоресценция |
| Положительный (++) | Отчетливая флуоресценция умеренной интенсивности |
| Положительный (+++) | Выраженная флуоресценция высокой интенсивности |
| Положительный (++++) | Яркая, интенсивная флуоресценция |
Причины положительного результата:
Причины отрицательного результата:
Кто назначает исследование?
Инфекционист, офтальмолог, пульмонолог, гастроэнтеролог, терапевт, педиатр.
Какой микроскоп необходимо использовать в реакции иммунофлюоресценции
Выявление в крови антилимфоцитарных антител, появление которых ведет к нарушению функции лимфоцитов и всей иммунной системы в целом, может быть причиной возникновения лимфоцитопенических и лейкоцитопенических состояний.
Антитела к лимфоцитам, АТ к лимфоцитам.
Синонимы английские
Antibodies to lymphocytes.
Какой биоматериал можно использовать для исследования?
Общая информация об исследовании
Лимфоциты являются клетками иммунной системы, представляют собой один из подвидов лейкоцитов – агранулоциты, т.к. не содержат в составе своей цитоплазмы гранул. Функция лимфоцитов заключается в обеспечении иммунных реакций организма.
Лимфоциты подразделяются на две большие группы:
— В-лимфоциты, отвечающие за гуморальный иммунитет посредством выработки иммуноглобулинов;
— Т-лимфоциты, осуществляющие клеточный иммунитет и участвующие в реакциях гуморального ответа, т.к. данные клетки первыми сталкиваются с попавшими в организм чужеродными антигенами, способны вырабатывать клетки памяти к каждому конкретному антигену, клетки-супрессоры (сразу подавляют иммунные реакции), клетки-хелперы (осуществляют переход с одного вида иммунных реакций на другой).
При развитии патологического процесса в иммунной системе лимфоциты способны начать вырабатывать аутоиммунные антитела по отношению к самим себе, что ведет к несостоятельности иммунного ответа при попадании в организм антигенов. Антитела к лимфоцитам могут вырабатываться отдельно к Т- или В-клеткам либо к обеим группам сразу. Это чаще всего происходит при различных онкогематологических заболеваниях, а также может быть при лейкоцитопении и лимфоцитопении другой этиологии.
Определение антител к лимфоцитам происходит посредством реакции иммунофлюоресценции, суть которой заключается во взаимодействии антител с антигенами. Для обнаружения антилимфоцитарных антител к исследуемому образцу венозной крови добавляют специфические к ним антигены, которые способны вместе образовать определенный комплекс. Реакцию между ферментом и комплексом антиген-антитело в виде субстрата можно наблюдать в микроскопе, что позволяет оценить качественно и количественно наличие искомых антилимфоцитарных антител.
Отрицательный результат свидетельствует об отсутствии антител к лимфоцитам. Положительный результат позволяет говорить о наличии аутоиммунных антител, что свидетельствует о нарушении лимфоцитарного звена иммунной системы. Это может быть следствием онкологического процесса (чаще – онкогематология), лимфоцитопении или лейкоцитопении, возникшим по другим причинам. Также наличие антител к лимфоцитам иногда проявляется в связи с переливанием крови как посттрансфузионное осложнение.
Одного анализа недостаточно для постановки достоверного диагноза. Точное заключение может быть дано только специалистом на основе комплексного обследования.
Для чего используется исследование?
Когда назначается исследование?
Что означают результаты?
Титр Также рекомендуется
Кто назначает исследование?
Гематолог, терапевт, врач общей практики.
ИММУНОФЛЮОРЕСЦЕНЦИЯ
ИММУНОФЛЮОРЕСЦЕНЦИЯ (лат. immunis свободный, избавленный от чего-либо + флюоресценция) — люминесценция в ультрафиолетовом свете микроскопа биологического объекта, содержащего изучаемый антиген после его предварительной обработки специфическими антителами, меченными флюорохромом.
Метод микроскопии, основанный на явлении (процессе) И., носит название метода Кунса, метода И., метода люминесцирующих антител (сывороток) и применяется в практике как экспресс-метод при микробиол. диагностике инфекционных заболеваний. Его применяют также при изучении патогенеза инфекционных заболеваний, механизма антителогенеза, антигенного анализа биол, объектов.
Иммунофлюоресцентный метод является универсальным иммунохим. методом, сочетающим в себе достаточно точный морфол, анализ со специфичностью и высокой разрешающей способностью иммунол, методов. Он основан на использовании явления люминесценции для выявления реакции антиген — антитело, происходящей на поверхности клеток или на срезах ткани.
Метод И. был предложен в 1942 г. Кунсом (A. Coons) с соавторами и получил дальнейшее развитие в 50-х гг. после синтеза самого лучшего из существующих флюорохромов — изотиоцианата флюоресцеина (ФИТЦ). В эти же годы в СССР были начаты исследования по использованию этого метода и его совершенствованию.
Успех метода И. во многом зависит от качества люминесцирующих антител (сывороток), которые получают путем хим. реакции между специфическими антителами, содержащимися в иммунной сыворотке, и флюоресцирующим красителем — флюорохромом (см.). Полученный продукт реакции называют конъюгатом. В ряде случаев приготовление специфичных и активных конъюгатов — трудная задача. Обычно с флюоресцирующими красителями конъюгируют не цельные иммунные сыворотки, а фракции сывороточных белков, содержащих антитела. Причем чем лучше очистка от балластных белков, тем более качественный конъюгат можно получить впоследствии. Наилучшие результаты дает использование для метки препаратов чистых антител, но это, к сожалению, не всегда возможно. Качество конъюгата определяется также чистотой и активностью красителя, его количеством при метке, концентрацией белка и антител, величиной pH при метке, временем и температурой конъюгации, а также степенью очистки от балластных белков и избытка красителя и наличием гетеро логичных и нормальных антител.
К флюорохромам, предназначенным для метки специфического белка, предъявляются следующие основные требования: цвет их флюоресценции должен отличаться от аутофлюоресценции объекта и контрастировать с фоном; они должны обладать высокой интенсивностью флюоресценции после присоединения к белку и не должны существенно изменять физ.-хим. и серол, свойства антител.
В практике используют флюорохромы, имеющие желто-зеленую, желтую и красную люминесценцию. Кроме ФИТЦ, применяют сульфохлорид родамина 200В (PCX), сульфофторид родамина 200В (РСФ), тетраметилродамин изотиоцианат (МРИТЦ), дихлортриазиниламинофлюоресцеин (ДХТАФ) и др.
Конъюгация белка с флюорохромом является хим. реакцией, в результате чего образуется новое соединение, в к-ром краситель присоединен к белку ковалентной связью. В реакции участвуют в основном ε-аминогруппы лизина и концевые аминогруппы белковой молекулы.
Метод И. применяется в трех основных модификациях. При прямом методе [Кунс, Каплан (М. Kaplan), 1950] на препарат, содержащий искомый антиген, наносят специфическую люминесцирующую сыворотку (антитело). После реакции препарат промывают и изучают под люминесцентным микроскопом. Преимуществом этого метода является его одноэтапность и использование небольшого количества контролей реакции.
При непрямом методе [Уэллер (Т. Weller), Кунс, 1954] препарат, содержащий искомый антиген, обрабатывают специфической немеченой сывороткой, несвязавшиеся белки отмывают и наносят люминесцирующую сыворотку к глобулинам немеченой сыворотки. В этом случае в качестве антигенов выступают связанные препаратом антитела первой сыворотки — немеченой. Преимуществом данной модификации является большая чувствительность, чем у прямого метода, и возможность использования ограниченного набора люминесцирующих антител.
Непрямой метод с комплементом [Гольдвассер, Шепард (В. Goldwasser, С. Shepard), 1958] является трехэтапным. Этот вариант заключается в использовании меченой антикомплементарной сыворотки, которая присоединяется к комплементу комплекса антиген — антитело. В такой постановке меченая сыворотка оказывается еще более универсальной.
К. А. Лебедевым с соавторами (1971) описана возможность проведения непрямого метода с использованием двух люминесцирующих сывороток (как антител против выявляемого антигена, так и антител против иммуноглобулинов того вида животных, от которых получена первая специфическая сыворотка).
Прямой метод выявления антител с помощью меченого антигена впервые применил Меллорс (В. Mellors) с соавт, в 1959 г. для доказательства присутствия ревматоидного фактора в определенных клетках организма. Этот вариант метода имеет ограниченное применение.
Во всех вариантах Иммунохим, сущность метода остается неизменной: локализация антигена в препарате обнаруживается по специфической флюоресценции в месте реакции антиген — антитело.
Методика приготовления препаратов различна и зависит от типа исследуемого препарата. Изучению подвергают мазки, мазки-отпечатки из органов, срезы органов, культуру ткани и пр. Для каждого антигена применяют свои фиксаторы. Препараты изучают под люминесцентным микроскопом (МЛ-2, МЛД-1, ЛЮМAM-2 и др.).
В связи с тем что в реакции И. участвует много компонентов, оценка надежности и точности результатов является обязательной частью исследования независимо от природы антигена, свойств и характеристики антител. Поэтому проводят контроль иммунол, специфичности наблюдаемого на препарате свечения и последовательно убеждаются в специфичности меченой сыворотки, качестве ее очистки, доказывают иммунол. характер обнаруживаемого свечения, проводят контроль фонового свечения с нормальной сывороткой, убеждаются в отсутствии реакции за счет антител к посторонним веществам и определяют иммунол, специфичность наблюдаемой реакции. Только после этого делают заключение о специфичности наблюдаемой реакции.
С целью повышения специфичности непрямого метода И. при выявлении тканевых антигенов применяют в качестве реактива меченые чистые антитела или конъюгаты с высоким титром антител, адсорбированные предварительно тканевыми порошками либо гомогенатами, не содержащими антигена, родственного специфическому антителу.
При выявлении бактерий, вирусов, риккетсий, простейших пользуются методами контрастирования неспецифического свечения. С этой целью используют бычий (или иной) альбумин, меченный родамином, синьку Эванса, конго красный и некоторые диазокрасители. При использовании метода контрастирования создают люминесцирующий фон, по цвету контрастирующий со специфическим свечением изучаемого объекта.
Иммунологические методы исследования в лабораторной практике
Преимущества иммунологического метода исследования.
Серологические реакции различаются по способности выявлять отдельные классы антител. Реакция агглютинации, например, хорошо выявляет lgM-антитела, но менее чувствительна для определения lgG-антител. Реакции связывания комплемента и гемолиза, которые требуют участия комплемента, не выявляют антитела, не присоединяющие комплемент, например lgA-антитела и lgE-антитела. В реакции нейтрализации вирусов участвуют лишь антитела, направленные против антигенных детерминант поверхности вириона, связанных с патогенностью. Чувствительность иммунулогических методов превосходит все другие методы исследования антигенов и антител, в частности радиоиммунный и иммуноферментный анализы позволяют улавливать присутствие белка в количествах, измеряемых в нанограммах и даже в пикограммах.
С помощью предложенного способа определяют группу и проверяют безопасность крови (гепатит В и ВИЧ-инфекция). При трансплантации тканей и органов, иммунологический метод позволяет определять совместимость тканей и тестировать методы подавления несовместимости. В судебной медицине используют реакцию Кастеллани для определения видовой специфичности белка и реакцию агглютинации для определения группы крови.
Иммунологические методы широко применяют в лабораторной диагностике инфекционных болезней. Этиологию заболевания устанавливают также на основании прироста антител к возбудителю в сыворотке крови реконвалесцента по сравнению с пробой, взятой в первые дни болезни. На основе исследования изучают иммунитет населения по отношению к массовым инфекциям, например к гриппу, а также оценивают эффективность профилактических прививок.
Развитию иммунологических методов способствовало создание моноклональных антител, продуцируемых гибридомой, полученной в результате слияния иммунокомпетентной клетки В-лимфоцита и клетки миеломы мышей. Моноклональные антитела несут только одну химически однородную популяцию антител, комплементарную специфической детерминанте антигена, что позволяет осуществлять тонкую дифференциацию белков. Развитие иммунологического метода исследования идет как по линии совершенствования реагентов (чистоты антигенов и антител), так и по линии создания автоматизированных систем постановки реакций и их инструментального учета.
Виды реакций метода иммунологического исследования.
В зависимости от их механизма и учета результатов, иммунологический метод исследования можно подразделить на 5 видов реакции.
1.Реакции, основанные на феномене агглютинации.
Агглютинация представляет собой склеивание клеток или отдельных частичек — носителей антигена с помощью иммунной сыворотки к этому антигену.
Реакция агглютинации бактерий с использованием соответствующей антибактериальной сыворотки относится к наиболее простым серологическим реакциям. Взвесь бактерий добавляют к различным разведениям испытуемой сыворотки крови и через определенное время контакта при t 37° регистрируют, при каком наивысшем разведении сыворотки крови происходит агглютинация. Реакцию агглютинации бактерий используют для диагностики многих инфекционных болезней: бруцеллеза, туляремии, брюшного тифа и паратифов, бациллярной дизентерии, сыпного тифа.
Реакции агглютинации для определения группы крови и резус-фактора основаны на взаимодействии аллоантител (изоантител) и антигенов эритроцитов. Антитела против резус-фактора являются неполными, они не способны к прямой реакции с резус-положительными эритроцитами, поэтому для их обнаружения используют реакцию Кумбса, основанную на выявлении неполных антител с помощью антиглобулиновых сывороток. К эритроцитам известной специфичности добавляют исследуемую сыворотку крови, а вслед за этим антиглобулиновую сыворотку против lgG (непрямая реакция Кумбса). Fab-фрагменты неполных антител исследуемой сыворотки крови присоединяются к эритроцитам, а к свободным Fc-фрагментам этих антител присоединяются антитела против lgG, и происходит агглютинация эритроцитов.
Реакция пассивной или непрямой гемагглютинации (РПГА, РНГА). В ней используют эритроциты или нейтральные синтетические материалы (например, частицы латекса), на поверхности которых сорбированы антигены (бактериальные, вирусные, тканевые) или антитела. Их агглютинация происходит при добавлении соответствующих сывороток или антигенов. Эритроциты, сенсибилизированные антигенами, называют антигенным эритроцитарным диагностикумом и используют для выявления и титрования антител. Эритроциты, сенсибилизированные антителами, называют иммуноглобулиновыми эритроцитарными диагностикумами и применяют для выявления антигенов.
Реакцию пассивной гемагглютинации используют для диагностики заболеваний, вызванных бактериями (брюшной тиф и паратифы, дизентерия, бруцеллез, чума, холера и др.), простейшими (малярия) и вирусами (грипп, аденовирусные инфекции, вирусный гепатит В, корь, клещевой энцефалит, крымская геморрагическая лихорадка и др.), а также для определения некоторых гормонов, выявления повышенной чувствительности больного к лекарственным препаратам и гормонам, например пенициллину и инсулину.
Реакция торможения гемагглютинации (РТГА) основана на феномене предотвращения (торможения) иммунной сыворотки гемагглютинации эритроцитов вирусами, используется для выявления и титрования противовирусных антител. Она служит основным методом серодиагностики гриппа, кори, краснухи, эпидемического паротита, клещевого энцефалита и других вирусных инфекций, возбудители которых обладают гемагглютинирующими свойствами, например, для серодиагностики клещевого энцефалита, в лунки панели разливают двукратные разведения сыворотки больного на щелочном боратном буферном растворе. Затем добавляют определенное количество, обычно 8 АЕ (агглютинирующих единиц), антигена клещевого энцефалита и после 18 ч экспозиции при t 4° вносят взвесь гусиных эритроцитов, приготовленную на кислом фосфатно-буферном растворе. Если в сыворотке крови больного есть антитела к вирусу клещевого энцефалита, то антиген нейтрализуется и агглютинация эритроцитов не происходит.
2.Реакции, основанные на феномене преципитации.
Преципитация происходит в результате взаимодействия антител с растворимыми антигенами. Простейшим примером реакции преципитации является образование в пробирке непрозрачной полосы преципитации на границе наслоения антигена на антитело. Широко применяют различные разновидности реакции преципитации в полужидких гелях агара или агарозы (метод двойной иммунодиффузии по Оухтерлоню, метод радиальной иммунодиффузии, иммуноэлетрофорез), которые носят одновременно качественный и количественный характер. В результате свободной диффузии, в геле антигенов и антител в зоне оптимального их соотношения образуются специфические комплексы — полосы преципитации, которые выявляют визуально или при окрашивании. Особенностью метода является то, что каждая пара антиген-антитело формирует индивидуальную полосу преципитации, и реакция не зависит от наличия в исследуемой системе других антигенов и антител.
Для постановки двойной иммунодиффузии наливают слой растопленного геля на стеклянную пластинку и после затвердевания вырезают лунки диаметром 1,5–3 мм. В расположенные по кругу лунки помещают исследуемые антигены, а в центральную лунку — иммунную сыворотку известной специфичности. Диффундируя навстречу друг другу, гомологичные сыворотки и антигены образуют преципитат.
При радиальной иммунодиффузии (по методу Манчини), иммунную сыворотку вносят в агар. Антиген, помещенный в лунки, диффундирует через агар, и в результате преципитации с иммунной сывороткой, вокруг лунок образуются непрозрачные кольца, внешний диаметр которых пропорционален концентрации антигена. Метод используют для определения классов иммуноглобулинов, а модификации метода можно применять для определения противомикробных антител, относящихся к различным классам иммуноглобулинов.
Иммуноэлектрофорез основан на усилении миграции в геле антигенов и антител путем помещения пластины геля с реагентами в электрическое поле. При этом достигается разделение антигенов и антител на компоненты в соответствии с их подвижностью и зарядом.
Разновидностью иммуноэлектрофореза является радиоиммунофорез. В этом случае после электрофоретического разделения антигенов в канавку, вырезанную параллельно движению антигенов в геле, наливают сначала меченную радиоактивным йодом иммунную сыворотку против определяемых антигенов, а затем иммунную сыворотку против lgG-антител, которая преципитирует образовавшиеся комплексы антитела с антигеном. Все несвязавшиеся реагенты вымывают, а комплекс антиген-антитело обнаруживает методом авторадиографии.
3.Реакции с участием комплемента.
В качестве комплемента используют свежую сыворотку крови морской свинки, основанную на способности субкомпонента комплемента Clq и затем других компонентов комплемента присоединяться к иммунным комплексам.
Реакция связывания комплемента (РСК) позволяет титровать антигены или антитела по степени фиксации комплемента комплексом антиген-антитело. Эта реакция состоит из двух фаз: взаимодействия антигена с испытуемой сывороткой крови (исследуемая система) и взаимодействия гемолитической сыворотки с эритроцитами барана (индикаторная система). При положительной реакции в исследуемой системе происходит связывание комплемента, и тогда при добавлении сенсибилизированных антителами эритроцитов, гемолиза не наблюдается. Реакцию применяют для серодиагностики сифилиса (реакция Вассермана), вирусных и бактериальных инфекций.
Реакция радиального гемолиза эритроцитов может протекать в геле. Взвесь эритроцитов барана помещают в агарозный гель с комплементом; в застывшем на стекле слое делают лунки и вносят в них гемолитическую сыворотку. Вокруг лунок в результате радиальной диффузии антител образуется зона гемолиза, радиус которой прямо пропорционален титру сыворотки. Если сорбировать на эритроцитах какой-либо антиген, например гликопротеиновый гемагглютинин вируса гриппа, краснухи или клещевого энцефалита, то можно воспроизвести феномен гемолиза иммунными сыворотками к этим вирусам. Реакцию радиального гемолиза в геле применяют в диагностике вирусных инфекций. Она характеризуется простотой постановки, нечувствительностью к сывороточным ингибиторам, позволяет титровать сыворотки крови по диаметру зоны гемолиза, не прибегая к серийным разведениям.
Иммунное прилипание. Эритроциты, тромбоциты и другие клетки крови имеют на поверхности рецепторы к третьему компоненту комплемента (СЗ). Если к антигену (бактериям, вирусам и др.) добавить соответствующую иммунную сыворотку и комплемент, то образуется комплекс антиген-антитело, покрытый СЗ-компонентом комплемента. Эту реакцию применяют при изучении ряда вирусных инфекций (клещевого энцефалита, денге), которые сопровождаются иммунопатологическими процессами и циркуляцией в крови вирусных антигенов в комплексе с антителами.
Основана на способности антител нейтрализовать некоторые специфические функции макромолекулярных или растворимых антигенов, например активность ферментов, токсины бактерий, болезнетворность вирусов. В бактериологии эту реакцию используют для обнаружения антистрептолизинов, антистрептокиназы и антистафилолизинов. Реакцию нейтрализации токсинов можно оценивать по биологическому эффекту, так, например, титруют антистолбнячные и антиботулинические сыворотки. Смесь токсина с антисывороткой, введенная животным, не вызывает их гибели. Различные варианты реакции нейтрализации применяют в вирусологии. При смешивании вирусов с соответствующей антисывороткой и введении этой смеси животным или в клеточные культуры, патогенность вирусов нейтрализуется и при этом животные не заболевают, а клетки культур не подвергаются деструкции.
5.Реакции с использованием химических и физических меток (ИФА).
Иммунофлюоресценция заключается в использовании меченых флюорохромом антител, точнее, иммуноглобулиновой фракции антител lgG. Меченое флюорохромом антитело образует с антигеном комплекс антиген-антитело, который становится доступным наблюдению под микроскопом в УФ-лучах, возбуждающих свечение флюорохрома. Реакцию прямой иммунофлюоресценции используют для изучения клеточных антигенов, выявления вируса в зараженных клетках и обнаружения бактерий и риккетсий в мазках. Так, для диагностики бешенства, отпечатки кусочков мозга животных, подозреваемых на вирусоносительство, обрабатывают люминесцирующей антирабической сывороткой. При положительном результате, в цитоплазме нервных клеток выявляются глыбки ярко-зеленого цвета. На обнаружении антигенов вирусов в клетках отпечатков со слизистой оболочки носа основана экспресс-диагностика гриппа, парагриппа и аденовирусной инфекции.
Более широко применяют метод непрямой иммунофлюоресценции, основанный на выявлении комплекса антиген-антитело с помощью люминесцирующей иммунной сыворотки против lgG-антител и используемой для обнаружения не только антигенов, но и титрования антител. Метод нашел применение в серодиагностике герпеса, цитомегалии, лихорадки Ласса. Препараты с наслоенной исследуемой сывороткой крови помещают в термостат при t 37° для образования иммунных комплексов, а затем, после отмывания несвязавшихся реагентов, выявляют эти комплексы меченой люминесцирующей сывороткой против глобулинов человека. Применяя меченые иммунные сыворотки против lgM- или lgG-антител, можно дифференцировать тип антител и обнаруживать ранний иммунный ответ по наличию lgM-антител.
Иммунофлюоресценцию широко используют не только в бактериологии, вирусологии, паразитологии, но и в иммунопатологии для обнаружения антител к тканевым антигенам человека.
Иммуноферментные или энзим-иммунологические методы основаны на использовании антител, конъюгированных с ферментами, главным образом пероксидазой хрена или щелочной фосфатазой. Чтобы обнаружить соединение меченых антител с антигеном, добавляют субстрат, разлагаемый присоединенным к lgG ферментом, с окрашиванием в желто-коричневый (пероксидаза) или желто-зеленый (фосфатаза) цвет. Используют также ферменты, разлагающие не только хромогенный, но и люмогенный субстрат. В этом случае при положительной реакции появляется свечение. Подобно иммунофлюоресценции, иммуноферментный метод применяют для обнаружения антигенов в клетках или титрования антител на антигенсодержащих клетках.
Наиболее популярной разновидностью иммуноферментного метода является иммуносорбция. На твердом носителе, которым могут быть целлюлоза, полиакриламид, декстран и различные пластмассы, сорбируют антиген. Чаще носителем служит поверхность лунок микропанелей. В лунки с сорбированным антигеном вносят исследуемую сыворотку крови, затем меченую ферментом антисыворотку и субстрат. Положительные результаты учитывают по изменению цвета жидкой среды. Для обнаружения антигенов, на носитель сорбируют антитела, затем вносят в лунки исследуемый материал и проявляют реакцию меченой ферментом антимикробной сывороткой. Повышению чувствительности иммунофлюоресцентного и иммуноферментного методов способствует введение в систему реакции авидина и биотина.
Радиоиммунологический метод основан на применении радиоизотопной метки антигенов или антител. Является наиболее чувствительным методом определения антигенов и антител, используется для определения гормонов, лекарственных веществ и антибиотиков, для диагностики бактериальных, вирусных, риккетсиозных, протозойных заболеваний, исследования белков крови, тканевых антигенов. Первоначально он был разработан как специфический метод измерения уровня циркулирующих в крови гормонов. Тест-системой являлись меченый радионуклидом гормон (антиген) и антисыворотка к нему. Если к такой антисыворотке добавить материал, содержащий искомый гормон, то он свяжет часть антител, при последующем внесении меченого титрованного гормона с антителами свяжется уменьшенное по сравнению с контролем его количество. Результат оценивают по сопоставлению кривых связанной и несвязанной радиоактивной метки. Эта разновидность метода носит название конкурентной реакции. Существуют и другие модификации радиоиммунологического метода.
Иммуногистологические методы предназначены для определения антигенов на поверхности или внутри клетки, например для обнаружения маркеров лимфоцитов и иммунокомплексов при гломерулонефритах и других заболеваниях почек. В этой реакции для выявления антигенов пользуются или иммунофлюоресценцией, или иммуноферментными конъюгатами с пероксидазой. Количество специфических антигенов определяют по интенсивности окрашивания. Иногда используют автоматическую регистрацию с помощью спектрофотометра.