какой недеполяризующий миорелаксант может быть альтернативой дитилину
Какой недеполяризующий миорелаксант может быть альтернативой дитилину
По мере развития медицины возникла необходимость искусственно вызывать вялый паралич скелетных мышц. Он необходим при искусственной вентиляции легких (ИВЛ). Длительную анестезию невозможно больше представить без расслабления мышц и вентиляции легких. Функцию концевой пластинки двигательного нерва можно обратимо нарушить на уровне рецепторов по двум механизмам.
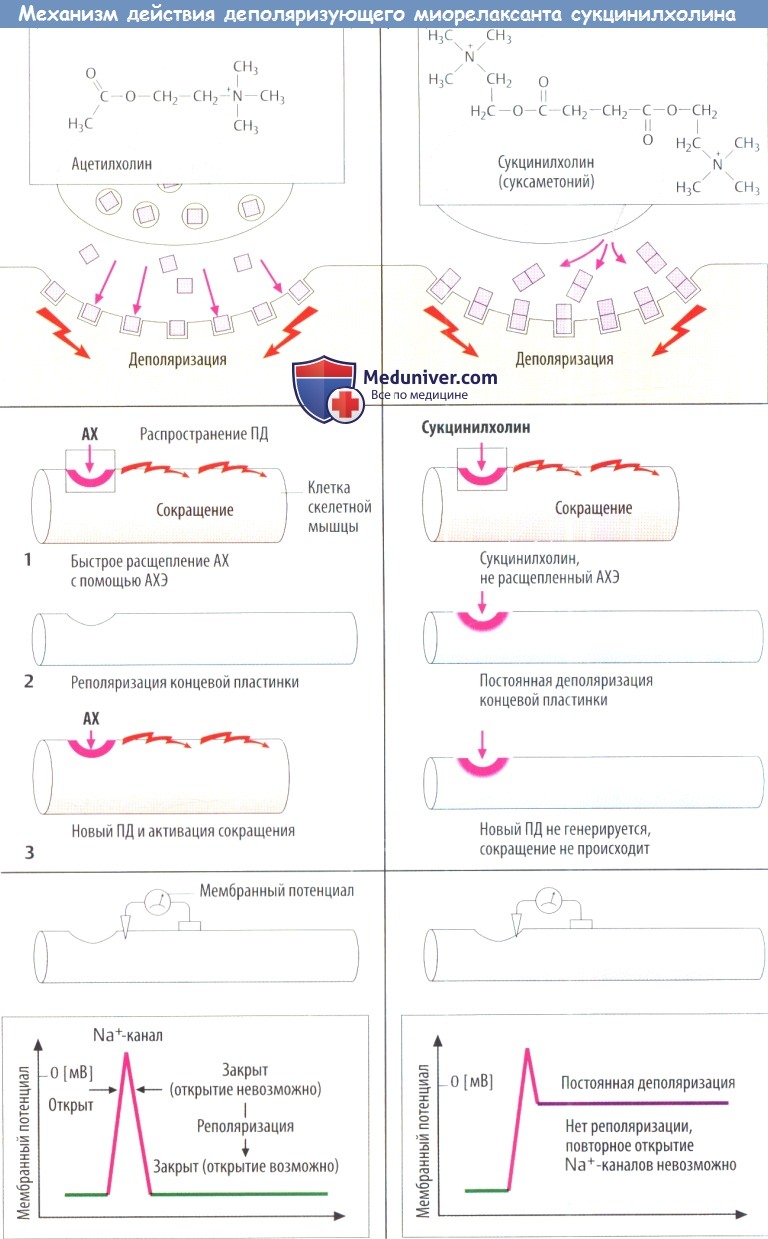
Первый механизм заключается в том, что агонист после связывания с рецептором вызывает одиночный ПД в прилежащей мембране, но остается связанным, тем самым сохраняя деполяризацию концевой пластинки двигательного нерва. По такому механизму действуют деполяризующие миорелаксанты. Ко второй группе относятся недеполяризующие миорелаксанты, которые действуют как антагонисты АХ-рецепторов.
а) Деполяризующие миорелаксанты. Простейшее химическое вещество, которое парализует мышцы, вызывая длительную деполяризацию, — декаметоний:
По химическому строению представляет собой углеводородную цепь с двумя положительно заряженными атомами азота, расположенными на расстоянии 1 нм друг от друга. Метаболически стабильный декаметоний использовался в анестезии, но из-за неудовлетворительных фармакокинетических характеристик его применение прекращено. Он имеет типичную структуру для всех миорелаксантов. Такую же структуру имеет и суксаметоний (сукцинилдихолин).
Структура сукцинилхолина — две молекулы АХ. Он имеет сродство к N-холинорецептору, но не разрушается специфической АХЭ. Неспецифическая сывороточная холинэстераза расщепляет сукцинилхолин медленно,поэтому активная концентрация сохраняется в синаптической щели в течение 5-10 мин (для сравнения: продолжительность действия АХ 1-2 мс).
Побочные эффекты сукцинилхолина — повышение концентрации К + в сыворотке, что может привести к нарушению функции сердца, подъему АД и тахикардии вследствие ганглионарной стимуляции. Сукцинилхолин стимулирует сокращение тонических волокон наружных мышц глаза и повышает внутриглазное давление.
Поэтому сукцинилхолин нельзя применять перед операциями на глазном яблоке. Кроме того, в хронически денервированных мышцах развиваются контрактуры, т. к. после повреждения двигательного нерва на неповрежденной поверхности денервированной скелетной мышцы появляются АХ-рецепторы. Подобная контрактура в сочетании с потерей К + может наблюдаться у пациентов, которым выполняют корректирующую операцию через определенное время послетравмы.
К преимуществам сукцинилхолина относится его очень быстрое начало действия. В последнее время созданы быстродействующие недеполяризующие миорелаксанты, поэтому использование сукцинилхолина сократилось. Сукцинилхолин служит основным миорелаксантом для экстренной интубации.
Деполяризация концевой пластинки двигательного нерва вызывает образование распространяющегося ПД в мембранах окружающих мышечных клеток, что приводит к сокращению мышечного волокна. Непродолжительное время после в/в инъекции наблюдаются мелкие подергивания мышц.
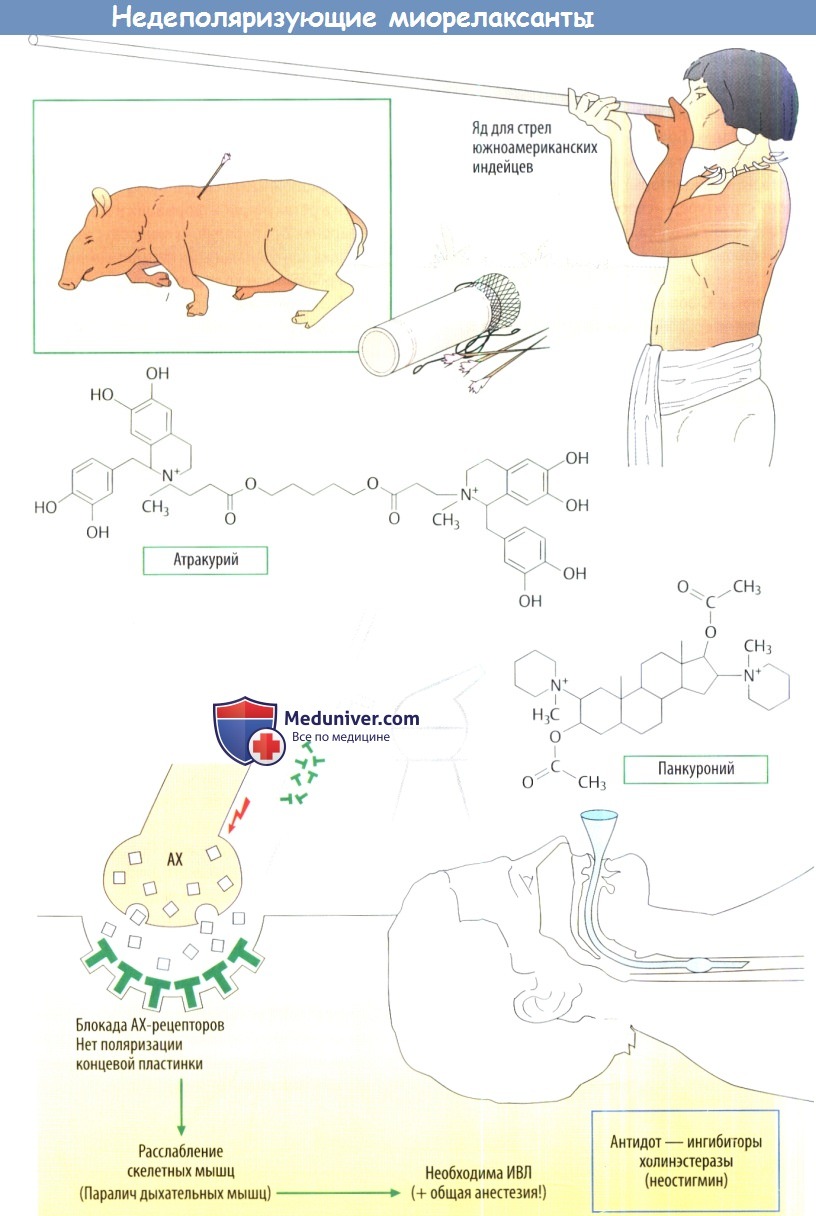
Подобные миорелаксанты имеют более сложную химическую структуру, чем декаметоний. В молекуле недеполяризующих миорелаксантов также имеется два ключевых положительно заряженных атома азота, но они расположены в системе колец. Эти два азотсодержащих кольца соединены либо длинной алифатической цепью, либо стероидной структурой. Формулы двух синтетических миорелаксантов показаны на рис. А. Эти крупные молекулы имеют высокое сродство к N-холинорецепторам, но не обладают собственной активностью, т. е. это чистые антагонисты.
Компонент яда кураре, D-тубокурарин, больше не используется в анестезии из-за неприемлемых побочных эффектов: высвобождение гистамина с падением АД, бронхоспазм и повышение секреции в бронхиальном древе. Также наблюдается ганглиоблокирующий эффект. Новыесинтетические миорелаксанты переносятся лучше. Они различаются по своим фармакокинетическим свойствам, например скорости начала и продолжительности действия.
В хирургии используются следующие препараты: панкуроний (длительного действия), векуроний (среднего действия), мивакурий (короткого действия), рокуроний (быстрое начало действия) и атракурий (расщепляется самопроизвольно после введения и не требует метаболической деградации, что важно для пациентов с заболеваниями печени).
Продолжительность действия недеполяризующих миорелаксантов можно сократить при использовании ингибиторов АХЭ, например неостигмина. АХ, секретируемый концевой пластинкой двигательного нерва, не расщепляется и накапливается в синаптической щели. Отношение антагониста к агонисту смещается в сторону нейромедиатора.
Наконец, следует отметить, что миорелаксанты не проникают в ЦНС. Это означает, что после введения миорелаксантов пациент будет находиться в сознании, однако возможна острая гипоксия вследствие паралича дыхательных мышц. В это время общение с пациентом невозможно из-за паралича всех мышц. При использовании миорелаксантов необходима анестезия и ИВЛ.
Восстановление иннервации происходит за счет роста новой концевой ветви аксона. Этот токсин используется в качестве лекарственного средства. Он вводится в мышцы при лечении болезненных мышечных спазмов, например блефароспазма. Токсин также используется в косметической медицине для модной в настоящее время подтяжки кожи лица.
в) Влияние на сократительную систему. ПД на короткое время деполяризует плазмолемму мышечных клеток, а также распространяется на саркоплазматический ретикулум. Это вызывает высвобождение Са 2+ из саркоплазматического ретикулума, что приводит к укорочению актомиозина. Данный процесс известен как электромеханическое сопряжение. Он ингибируется дантроленом, который используют для лечения болезненных спазмов мышц и злокачественной гипертермии.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Выбор фармакологической терапии при спастическом мышечном гипертонусе
Основными препаратами, используемыми для снижения мышечного тонуса, являются миорелаксанты. Рассмотрены вопросы выбора терапии с использованием антиспастических препаратов в зависимости от заболевания, выраженности мышечной спастичности, побочных эффектов
Myorelaxants are the basic preparations used for reduction in the muscular tone. Issues of selection of therapy by anti-spastic preparations depending on the disease, manifestation of muscular spasticity, side effects and special features of the preparation effect are considered.
Основными препаратами, используемыми для снижения мышечного тонуса, являются миорелаксанты. По механизму действия различают миорелаксанты центрального действия (влияют на синаптическую передачу возбуждения в центральной нервной системе) и периферического действия (угнетают прямую возбудимость поперечно-полосатых мышц). При применении миорелаксантов могут возникать достаточно значимые побочные действия, которые при выборе препарата надо тщательно оценивать [1, 2].
При выборе антиспастических препаратов учитывают в основном их способность тормозить полисинаптические рефлексы (уменьшение спастики), оказывая при этом наименьшее влияние на моносинаптические рефлексы (сила мышц). Антиспастический препарат должен уменьшать мышечную спастичность при минимальном снижении мышечной силы [3, 4].
Медикаментозная терапия основана на использовании таблетированных и инъекционных форм. Применяемые внутрь антиспастические средства, уменьшая мышечный тонус, могут улучшить двигательные функции, облегчить уход за обездвиженным пациентом, снять болезненные мышечные спазмы, усилить действие лечебной физкультуры, предупредить развитие контрактур [5]. При легкой степени спастичности применение миорелаксантов может привести к значительному положительному эффекту, однако при выраженной спастичности могут потребоваться большие дозы миорелаксантов, применение которых нередко вызывает нежелательные побочные эффекты. Лечение миорелаксантами начинают с минимальной дозы, затем ее медленно повышают для достижения эффекта [6].
К миoрелаксантам центрального действия, наиболее часто используемым в России для лечения спастического мышечного гипертонуса, относятся баклофен, тизанидин, толперизон, диазепам [7, 8].
Баклофен (Баклосан, Лиорезал) оказывает антиспастическое действие преимущественно на спинальном уровне. Препарат представляет аналог гамма-аминомасляной кислоты (ГАМК), который связывается с пресинаптическими ГАМК-рецепторами, приводя к уменьшению выделения возбуждающих аминокислот (глутамата, аспартата) и подавлению моно- и полисинаптической активности на спинальном уровне, что и вызывает снижение спастичности. Препарат проявляет также умеренное центральное анальгезирующее действие. Баклофен используется при спинальном и церебральном спастическом мышечном гипертонусе различного генеза. Начальная доза составляет 5–15 мг/сут (в один или три приема), затем дозу увеличивают на 5 мг каждый день до получения желаемого эффекта. Препарат принимают во время еды. Максимальная доза баклофена для взрослых составляет 60–75 мг/сут. Побочные эффекты чаще проявляются седацией, сонливостью, снижением концентрации внимания, головокружением и часто ослабевают в процессе лечения. Возможно возникновение тошноты, запоров и диареи, артериальной гипертонии, усиление атаксии, появление парестезий. Требуется осторожность при лечении больных пожилого возраста, пациентов, перенесших инсульт, пациентов с язвенной болезнью желудка и двенадцатиперстной кишки. Баклофен противопоказан при эпилепсии, наличии судорог в анамнезе [9, 10].
При выраженной спастичности, когда обычное пероральное применение антиспастических препаратов не эффективно, показано интратекальное введение баклофена, которое впервые было предложено в 1984 г. R. Penn. Для достижения необходимой концентрации препарата в спинномозговой жидкости необходимо принимать довольно значительные дозы баклофена, что может привести к нарушениям сознания, сонливости, слабости. В связи с этим были разработаны системы, при помощи которых баклофен доставляется непосредственно в подоболочечное пространство спинного мозга при помощи подоболочечной баклофеновой насосной системы. При этом клинического эффекта добиваются гораздо меньшими дозами баклофена, чем при использовании таблетированных форм [11, 12].
Данная система состоит из резервуара, где содержится баклофен или аналогичный препарат, насоса (помпы), при помощи которого препарат дозированно подается в подоболочечное пространство спинного мозга через люмбальный катетер и блока питания. Из резервуара баклофен поступает непосредственно в спинномозговую жидкость, а его дозировка контролируется специальным радиотелеметрическим устройством. Количество поступающего в спинномозговую жидкость лекарственного препарата можно изменять в зависимости от клинической картины. Добавление баклофена в резервуар производится через 2–3 месяца при помощи чрезкожной пункции [13].
Использование баклофеновой помпы улучшает скорость и качество ходьбы больных с нефиксированными рефлекторными контрактурами, обусловленными высокой спастичностью мышц-синергистов и дисбалансом мышц-антагонистов. Имеющийся 15-летний клинический опыт применения баклофена интратекально у больных, перенесших инсульт, свидетельствует о высокой эффективности этого метода в уменьшении не только степени спастичности, но и болевых синдромов и дистонических расстройств. Отмечено положительное влияние баклофеновой помпы на качество жизни больных, перенесших инсульт [14].
Тизанидин (Сирдалуд) — миорелаксант центрального действия, агонист альфа-2-адренергических рецепторов. Препарат снижает спастичность вследствие подавления полисинаптических рефлексов на уровне спинного мозга, что может быть вызвано угнетением высвобождения возбуждающих аминокислот L-глутамата и L-аспартата и активацией глицина, снижающего возбудимость интернейронов спинного мозга. Тизанидин обладает также умеренным центральным анальгетическим действием. Препарат эффективен при церебральной и спинальной спастичности, а также при болезненных мышечных спазмах. Начальная доза препарата составляет 2–6 мг/сут в один или три приема, при индивидуальном подборе увеличение дозы происходит на 3–4 день на 2 мг. При пероральном приеме действие препарата проявляется через 30–45 минут, максимальный эффект наступает в течение 1–2 часов. Средняя терапевтическая доза составляет 12–24 мг/сут, максимальная доза — 36 мг/сут. В качестве побочных эффектов могут возникнуть сонливость, сухость во рту, головокружение и снижение артериального давления, что ограничивает использование препарата при постинсультной спастичности. Антиспастический эффект тизанидина сопоставим с эффектом баклофена, однако тизанидин при адекватном подборе дозировки лучше переносится, т. к. не вызывает общей мышечной слабости и не усиливает мышечную слабость в парализованной конечности [15, 16].
Толперизон (Мидокалм) — антиспастический препарат центрального действия, угнетает каудальную часть ретикулярной формации и обладает Н-холинолитическими свойствами. Толперизон снижает активность спинальных нейронов, участвующих в формировании спастичности, путем ограничения потока натрия через мембрану нервных клеток. Наиболее часто используется по 300–450 мг/сут в два или три приема. Снижение мышечного тонуса при назначении толперизона иногда сопровождается сосудорасширяющим действием, что следует учитывать при назначении больным с тенденцией к артериальной гипотонии. Также препарат может вызывать или усиливать у больных недержание мочи [17].
Основным побочным эффектом баклофена, тизанидина и толперизона является быстрое наступление мышечной слабости, причем в каждом случае врач должен находить баланс между снижением тонуса и усилением слабости. Кривая баланса между снижением спастического тонуса и усилением мышечной слабости у больных на фоне увеличения дозы Мидокалма, Сирдалуда или Баклофена показывает, что наиболее быстрое усиление слабости происходит при приеме Баклофена, а самый мягкий препарат, позволяющий эффективно подобрать индивидуальную дозировку, — Мидокалм. Во всех случаях, учитывая наличие узкого терапевтического окна, курс лечения начинают с небольшой дозы препарата, постепенно наращивая ее до достижения отчетливого антиспастического эффекта, но не до появления слабости [18, 19].
Диазепам (Реаланиум, Релиум, Сибазон) является миорелаксантом, поскольку обладает способностью стимулировать уменьшенное пресинаптическое торможение на спинальном уровне. Он не имеет прямых ГАМК-ергических свойств, увеличивает концентрацию ацетилхолина в мозге и тормозит обратный захват норадреналина и дофамина в синапсах. Это приводит к усилению пресинаптического торможения и проявляется снижением сопротивляемости растяжению, увеличением диапазона движений. Диазепам также обладает способностью уменьшать болевой синдром, вызываемый спазмом мышц. Наряду со снижением мышечного тонуса, развиваются заторможенность, головокружение, нарушение внимания и координации ввиду токсического действия на центральную нервную систему. Это значительно ограничивает применение диазепама в качестве миорелаксанта. Используется он, в основном, для лечения спастичности спинального происхождения при необходимости кратковременного снижения мышечного тонуса. Для лечения спастичности назначают в дозе 5 мг однократно или по 2 мг 2 раза в день. Максимальная суточная доза может составлять 60 мг. При больших дозах могут отмечаться расстройства сознания, преходящая дисфункция печени и изменения крови. Продолжительность лечения ограничена из-за возможного развития лекарственной зависимости [20].
Клоназепам является производным бензодиазепина. Клоназепам оказывает успокаивающее, центральное миорелаксирующее, анксиолитическое действие. Миорелаксирующий эффект достигается за счет усиления ингибирующего действия ГАМК на передачу нервных импульсов, стимуляции бензодиазепиновых рецепторов, расположенных в аллостерическом центре постсинаптических ГАМК-рецепторов восходящей активирующей ретикулярной формации ствола головного мозга и вставочных нейронов боковых рогов спинного мозга, а также уменьшения возбудимости подкорковых структур головного мозга и торможения полисинаптических спинальных рефлексов.
Быстрое наступление сонливости, головокружения и привыкания ограничивает применение этого препарата. Для снижения проявления возможных побочных реакций, достигать терапевтической дозы необходимо путем медленного титрования в течение двух недель. Для приема внутрь взрослым рекомендуется начальная доза не более 1 мг/сут. Поддерживающая доза — 4–8 мг/сут. Возможно назначение небольших доз в сочетании с другими миорелаксантами. Клоназепам эффективен при пароксизмальных повышениях мышечного тонуса. Противопоказан при острых заболеваниях печени, почек, миастении [21].
Дикалия клоразепат (Транксен) — аналог бензодиазепина, трансформируется в главный метаболит диазепама, обладает большей активностью и длительностью антиспастического действия, чем диазепам. Отмечен его хороший эффект при лечении в виде уменьшения фазических рефлексов на растяжение, обладает незначительным седативным эффектом. Первоначальная доза составляет 5 мг 4 раза в сутки, затем уменьшается до 5 мг 2 раза в сутки [22].
Дантролен — производное имидазолина, действует вне центральной нервной системы, преимущественно на уровне мышечных волокон. Механизм действия дантролена — блокирование высвобождения кальция из саркоплазматического ретикулума, что ведет к снижению степени сократимости скелетных мышц, редукции мышечного тонуса и фазических рефлексов, увеличению диапазона пассивных движений. Важным преимуществом дантролена по отношению к другим миорелаксантам является его доказанная эффективность в отношении спастичности не только спинального, но и церебрального генеза. Начальная доза — 25 мг/сут, при переносимости дозу увеличивают в течение 4 недель до 400 мг/сут. Побочные эффекты — сонливость, головокружение, тошнота, диарея, снижение скорости клубочковой фильтрации. Серьезную опасность, особенно у пожилых пациентов в дозе более 200 мг/сут, представляет гепатотоксическое действие, поэтому в период лечения надо регулярно следить за функцией печени. Элиминация дантролена на 50% осуществляется за счет печеночного метаболизма, в связи с этим он противопоказан при заболеваниях печени. Осторожность следует соблюдать и при тяжелых сердечных или легочных заболеваниях.
Катапресан — применяется в основном при спинальных повреждениях, действует на альфа-2-агонисты головного мозга, обладает пресинаптическим торможением. Из побочных эффектов отмечаются снижение артериального давления и депрессия. Первоночальная доза — 0,05 мг 2 раза в день, максимальная — 0,1 мг 4 раза в день.
Темазепам — взаимодействует с бензодиазепиновыми рецепторами аллостерического центра постсинаптических ГАМК-рецепторов, расположенных в лимбической системе, восходящей активирующей ретикулярной формации, гиппокампе, вставочных нейронах боковых рогов спинного мозга. В результате открываются каналы для входящих токов ионов хлора и таким образом потенцируется действие эндогенного тормозного медиатора — ГАМК. Рекомендуемая доза — 10 мг 3 раза в день. Эффективно его сочетание с баклофеном [23, 24].
Основные лекарственные средства, используемые для лечения спастического мышечного гипертонуса, представлены в табл.
Таким образом, выбор препарата определяется основным заболеванием, выраженностью мышечной спастичности, а также побочными эффектами и особенностями действия конкретного препарата.
Так, например, тизанидин и баклофен в большей степени действуют на тонус мышц-разгибателей, поэтому в случаях наличия значительного гипертонуса мышц-сгибателей руки, легкой спастичности мышц ноги их прием не показан, поскольку легкое повышение тонуса мышц-разгибателей ноги компенсирует мышечную слабость в ноге и стабилизирует походку больного. В таком случае средством выбора являются методы физического воздействия на мышцы верхней конечности.
При лечении церебральной спастичности наиболее часто применяют Сирдалуд, а при спинальной спастичности — Сирдалуд и Баклофен. Важным преимуществом перед другими миорелаксантами обладает Мидокалм, который не оказывает седативного эффекта и имеет благоприятный спектр переносимости, поэтому является препаратом выбора для лечения в амбулаторных условиях и для лечения пожилого контингента пациентов.
Допустима комбинация нескольких средств, что позволяет эффективно снижать тонус на меньших дозах каждого из препаратов. Сочетание препаратов с разными точками приложения, начиная от центров в головном мозге и до мышц, может привести к суммированию терапевтического эффекта.
Эффективность пероральных антиспастических препаратов снижается при их длительном использовании, часто возникает необходимость возрастающего повышения дозировок для поддержания начального клинического эффекта, что сопровождается увеличением частоты и тяжести побочных реакций [25–27].
В ситуации, когда спастичность носит локальный характер и системный эффект пероральных миорелаксантов нежелателен, предпочтительны локальные методы воздействия, одним из которых является локальное введение ботулотоксина [28, 29].
Литература
А. А. Королев, кандидат медицинских наук
ФГБУ «Всероссийский центр экстренной и радиационной медицины им. А. М. Никифорова» МЧС России, Санкт-Петербург
Дитилин-дарница : инструкция по применению
Состав
действующее вещество: suxamethonium iodide;
1 мл раствора содержит: суксаметония йодида (дитилина) – 20 мг;
вспомогательные вещества: натрия хлорид, динатрия эдетат, кислота аскорбиновая, кислота хлористоводородная разбавленная, вода для инъекций.
Основные физико-химические свойства
Прозрачная бесцветная жидкость.
Фармакотерапевтическая группа
Миорелаксанты. Производные холина.
Дитилин является деполяризирующим миорелаксантом короткого действия. По химическому строению дитилин можно рассматривать как удвоенную молекулу ацетилхолина. Обладает высоким сродством к постсинаптическому нервно-мышечному рецептору, конкурентно блокирует нервно-мышечную передачу, вызывает деполяризацию постсинаптической мембраны и кратковременную релаксацию скелетных мышц. Быстро разрушается псевдохолинэстеразой с образованием холина и янтарной кислоты, из-за чего эффект дитилина кратковременный.
После внутривенного введения действие препарата проявляется через 2–3 минуты и сохраняется в полном объеме до 3 минут. Приблизительно через 5 минут после окончания введения препарата эффект полностью прекращается.
Быстрое наступление эффекта и последующее быстрое восстановление тонуса мышц позволяет создавать контролируемую и управляемую релаксацию скелетных мышц.
Данные по фармакокинетике дитилина существенно ограничены из-за короткого времени действия препарата. Сразу же после внутривенного введения препарат подвергается воздействию псевдохолинэстеразы крови. Распадается на холин, который в последующем используется для синтеза ацетилхолина, и на янтарную кислоту, которая принимает участие в процессах тканевого дыхания. Препарат проходит через гематоэнцефалический и плацентарный барьеры.
Применять с целью миорелаксации при интубации трахеи, эндоскопических процедурах (бронхо-, эзофаго-, ларинго-, цистоскопия), кратковременных операциях, требующих миорелаксации (вправление вывихов, репозиция отломков кости), для поддержания миоплегии при оперативных вмешательствах (гинекологических, торакальных, абдоминальных), устранении судорог при столбняке.
Противопоказания
Повышенная чувствительность к компонентам препарата, глаукома, миастения, острая печеночная недостаточность, выраженная анемия, злокачественная гипертермия в анамнезе, атипичная активность холинэстеразы плазмы крови; гиперкалиемия при обширных травмах или ожогах, при длительной иммобилизации больного, параличе скелетных мышц; гиперкалиемия, связанная с почечной недостаточностью; открытая травма глаза и случаи, когда повышение внутриглазного давления является нежелательным; миопатия скелетных мышц, рабдомиолиз.
Одновременное применение препаратов, повышающих чувствительность к суксаметонию.
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий
К другим лекарственным средствам, которые могут негативно повлиять на активность псевдохолинэстеразы в плазме крови, относятся апротинин, дифенингидрамин, прометазин, эстрогены, окситоцин, глюкокортикостероиды (в высоких дозах), оральные контрацептивы, тербуталин, метоклопрамид.
Приведенные ниже лекарственные вещества и химические соединения повышают интенсивность и длительность миорелаксирующего действия Дитилина-Дарница путями, которые не связаны со сменой активности холинэстеразы в плазме крови. К ним относятся: соли магния; лития карбонат; азатиоприн; хинин и хлорхинин; антибиотики аминогликозидного ряда, клиндамицин, полимиксины; противоаритмические препараты: хинидин, прокаинамид, верапамил, бета-адреноблокаторы, лидокаин, прокаин; летучие и ингаляционные анестезирующие лекарственные средства: галотан, энфлуран, десфлуран, изофлуран, диетилэфир и метоксифлуран – имеют незначительный эффект на I фазу блокировки нервно-мышечной передачи Дитилином-Дарница, однако ускоряют начало и повышают интенсивность II фазы блокировки нервно-мышечной передачи суксаметонием.
При одновременном применении с сердечными гликозидами повышается эффект последних.
При одновременном применении со средствами для лечения миастении снижается эффективность последних.
Галогенсодержащие средства для общей анестезии повышают нежелательный эффект дитилина на сердечно-сосудистую систему.
Тиопентал натрия, атропин снижают нежелательный эффект дитилина на сердечно-сосудистую систему.
Применять только в условиях специализированного отделения стационара по решению и под тщательным контролем опытного анестезиолога и при наличии аппаратуры для проведения немедленной интубации трахеи, ингаляции кислорода и искусственной вентиляции легких.
Имеются сведения о случаях необратимой остановки сердца после применения суксаметония хлорида у детей и подростков, имевших ранее не обнаруженные нейромышечные заболевания. Ввиду опасности побочных явлений рекомендуется ограничить применение суксаметония хлорида, кроме случаев, при которых требуется немедленная интубация или освобождение дыхательных путей в критических ситуациях.
Следует учитывать, что в больших дозах дитилин может вызвать «двойной блок», когда после деполяризующего действия развивается антидеполяризующий эффект. Потому после последней инъекции дитилина действие долгое время (до 25–30 минут) не проходит и самостоятельное дыхание не восстанавливается.
Для купирования последнего после предварительного введения атропина вводить прозерин или галантамин. Следует помнить, что прозерин и другие антихолинэстеразные препараты, подавляя активность холинэстеразы, действие дитилина удлиняют.
С осторожностью применять при известной гиперчувствительности к другим миорелаксантам или к какому-либо компоненту общей анестезии.
Около 0,05 % населения имеет наследственную сниженную активность холинэстеразы плазмы. Действие суксаметония может быть пролонгировано у таких пациентов, а также при состояниях, которые сопровождаются снижением активности холинэстеразы: беременность и послеродовый период; тяжелое течение столбняка, туберкулеза, а также других тяжелых и/или хронических инфекционных заболеваний; массивные ожоги; злокачественные новообразования; хроническая анемия и недоедание; терминальные стадии печеночной недостаточности; острая или хроническая почечная недостаточность; аутоиммунные заболевания: микседема, коллагеновые заболевания; после массивной трансфузии плазмы; после проведения плазмафереза, а также в результате некоторой сопутствующей терапии (см. раздел «Взаимодействие с другими лекарственными средствами и другие виды взаимодействий»).
После повторного введения суксаметония возможно возникновение привыкания к препарату.
Применение суксаметония может сопровождаться последующими мышечными болями, интенсивность которых слабо коррелирует с видимыми мышечными сокращениями при введении препарата. Инъекции недеполяризующих миорелаксантов за несколько минут до введения Дитилина-Дарница могут способствовать уменьшению проявления мышечных болей. Этот метод может требовать введения дозы суксаметония более 1 мг/кг массы тела для достижения удовлетворительных условий для эндотрахеальной интубации.
Больные с тяжелым сепсисом склонны к развитию гиперкалиемии, что необходимо иметь в виду при применении Дитилина-Дарница.
Не рекомендуется назначать Дитилин-Дарница пациентам с миастенией gravis ввиду высокого риска развития «двойного блока». Пациенты с миастеническим синдромом Итона-Ламберта более чувствительны к действию суксаметония, что может потребовать снижения дозы препарата.
У здоровых пациентов (взрослых и детей) суксаметоний иногда может вызвать брадикардию, которую можно предупредить предшествующим внутривенным введением атропина.
При отсутствии гиперкалиемии редко, но могут возникать желудочковые аритмии, связанные с применением суксаметония. Однако пациенты, которые принимают препараты дигиталиса, более склонны к развитию таких аритмий. Действие суксаметония на сердце может приводить к изменению сердечного ритма, включая остановку сердца.
Следует учитывать, что у больных с генетически обусловленным дефицитом холинэстеразы, а также с гипокалиемией Дитилин-Дарница может вызвать пролонгированное угнетение дыхания.
С осторожностью препарат следует использовать для лечения пациентов с заболеваниями печени, анемией, кахексией.
Применение в период беременности или кормления грудью
Суксаметоний не оказывает прямого влияния на матку и другую гладкую мускулатуру. В нормальных терапевтических дозах препарат не проникает через плацентарный барьер в количестве, который может оказать влияние на дыхание новорожденного. В период беременности препарат применять только в том случае, если польза для матери превышает риск для плода.
Кормление грудью: нет данных о способности препарата проникать в грудное молоко.
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами
Дитилин-Дарница предназначен для применения в условиях лечебного учреждения в сочетании со средствами для общей анестезии, поэтому необходимо соблюдать все предостережения по поводу применения средств для общей анестезии.
Способ применения и дозы
Применять внутривенно болюсно и в виде инфузий или внутримышечно.
Введение Дитилина-Дарница допускается только при наличии всех условий для проведения искусственной вентиляции легких.
Взрослые. Дозы устанавливает врач индивидуально, с учетом массы тела, реакции пациента, степени необходимой мышечной релаксации, пути введения.
Для проведения эндотрахеальной интубации вводить внутривенно в дозе 1 мг/кг массы тела. Эта доза обычно вызывает мышечную релаксацию через 30–60 секунд длительностью от 2 до 6 минут. Большие дозы вызывают более длительную мышечную релаксацию, но удвоение дозы не обязательно приводит к удвоению продолжительности релаксации. Дополнительные дозы дитилина, составляющие от 50 % до 100 % от исходной дозы, следует вводить с интервалами от 5 до 10 минут, будут поддерживать мышечную релаксацию в течение кратковременного хирургического вмешательства под общей анестезией.
Для длительного расслабления мускулатуры на протяжении всей операции Дитилин-Дарница можно вводить в виде инфузий 0,1–0,2 % раствора, разведенного в 5 % растворе глюкозы или 0,9 % растворе натрия хлорида со скоростью 2,5–4 мг/минуту. Скорость инфузий необходимо скорректировать в зависимости от реакции конкретного пациента. Общая доза Дитилина-Дарница при повторных внутривенных инъекциях или непрерывной инфузий не должна превышать 500 мг/час.
Дети в возрасте от 1 года. Пациенты этой возрастной группы более устойчивы к действию дитилина по сравнению с взрослыми. Рекомендованная внутривенная доза составляет – 1 мг/кг массы тела.
При введении Дитилина-Дарница детям путем внутривенной инфузий дозу следует определять, как для взрослых, но начальную скорость инфузий снижать пропорционально массе тела.
Рекомендуемая внутримышечная доза для детей в возрасте от 1 года – до 4 мг/кг массы тела.
Эти дозы вызывают мышечную релаксацию, что длится примерно 3 минуты. Суммарная доза не должна превышать 150 мг.
Применение пожилым пациентам: дозы Дитилина-Дарница для людей пожилого возраста аналогичны дозам для взрослых. Пожилые люди более предрасположены к возникновению сердечных аритмий, особенно если они принимают сердечные гликозиды.
Препарат применять детям с 1 года. Следует проявлять осторожность при применении препарата пациентам этой возрастной группы, потому что у детей чаще диагностируется миопатия, они более склонны к развитию злокачественной гипертермии и рабдомиолиза и имеют повышенный риск развития серьезных побочных реакций после введения суксаметония.
Передозировка
Симптомы: передозировка дитилином проявляется длительной остановкой дыхания и параличом мышц.
Лечение: искусственная вентиляция легких, при необходимости – переливание свежей крови, т.е. содержащей в своем составе псевдохолинэстеразу.
Со стороны органов чувств: повышение внутриглазного давления.
Со стороны желудочно-кишечного тракта: повышенное слюноотделение, повышение внутрижелудочного давления (и, как следствие, увеличение риска регургитации и попадания желудочного содержимого в дыхательные пути).
Со стороны печени и желчевыводящих путей: нарушение функции печени.
Метаболические нарушения: гипергликемия, транзиторное повышение уровня калия.
Со стороны сердечно-сосудистой системы: артериальная гипертензия или гипотензия, приливы, кратковременная брадикардия, асистолия, тахикардия, аритмия (включая желудочковые аритмии), нарушения сердечной проводимости, кардиогенный шок, остановка сердца, коллапс.
Со стороны органов дыхания: апноэ, бронхоспазм, пролонгированный паралич дыхательных мышц (связанный с генетически обусловленным нарушением продуцирования псевдохолинэстеразы).
Со стороны опорно-двигательного аппарата: появление мышечных болей через 10–12 часов после введения дитилина, фасцикуляции мышц, тризм, рабдомиолиз с последующим развитием миоглобинемии и миоглобинурии.
Дерматологические нарушения: покраснение кожи, сыпь.
Аллергические реакции: реакции гиперчувствительности, включая крапивницу, анафилактический шок.
Со стороны организма в целом: гипертермия, изменения в месте введения.
_575.gif)