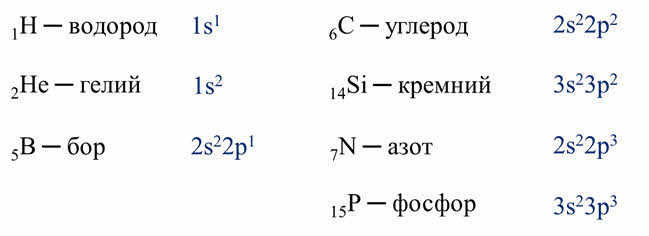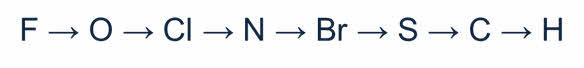какой неметалл в больших количествах встречается
Неметаллы и их значение в жизни человека: описание, примеры
Содержание:
В периодической системе 22 элемента являются неметаллами. Самыми распространенными макроэлементами являются:
Кислород. В организме человека кислород можно обнаружить в составе белков, жиров, углеводов, гормонов, ферментов и других биологических веществ. Он принимает участие в реакциях обмена веществ в организме, в процессах разложения погибших животных и отмерших растений. Кислород широко используется в медицине: применяется при лечении сердечно-сосудистых, инфекционных заболеваний, а также злокачественных опухолей. Он может оказывать снотворное действие и возбуждать центральную нервную систему. Озон обеззараживает воду и воздух, вызывает гибель бактерий, грибов, вирусов. Образует озоновый слой Земли, который задерживает вредное для всего живого ультрафиолетовое излучение солнца.
Углерод. Составляет основу жизни на Земле. Обеспечивает построение всех живых организмов и их жизнедеятельность. В биологических молекулах углерод образует цепи полимеров и прочно соединяется со всеми макроэлементами. Участвует практически во всех биохимических процессах. Окисляется под действием кислорода до воды и углекислого газа, во время этого процесса выделяется энергия. В организм человека попадает с пищей, а выводится с выдыхаемым воздухом (в виде углекислого газа) и мочой (в виде мочевины).
Из углерода образованы основные виды топлива на Земле – природный газ, нефть, каменный уголь.
В самородном виде в природе существуют две аллотропные модификации углерода: графит и алмаз. Они различаются строением кристаллических решеток и, следовательно, свойствами. Алмаз используется для обработки твердых металлов, для шлифования, резки и гравировки стекла, а также в качестве ювелирных украшений. Графит используют в карандашной промышленности, при изготовлении электродов, некоторых красок, в ядерных реакторах для замедления нейтронов.
Азот. В природе встречается в виде двухатомного газа. Инертен. Активны его соединения. Входит в состав:
Нехватка азота возникает при несбалансированном питании (дефицит белков и витаминов). Это ведет к нарушению обмена веществ, мышечной дистрофии, иммунодефициту, депрессии, гиподинамии.
При избытке белка нарушается работа почек и печени.
Сера. Участвует в пространственной организации молекул белка. Защищает организм от токсического воздействия. Входит в состав ферментов и гормонов. Больше всего её содержится в нервной и соединительной тканях. Недостаток серы в организме проявляется в виде симптомов заболеваний печени, суставов, кожи. Переизбыток ведет к стойким головным болям, параличам, расстройству желудочно-кишечного тракта и дыхательной системы.
В природе сера встречается в самородном виде.
Фосфор. Входит в состав костной ткани, клеточных мембран, нуклеиновых кислот. Участвует в обмене веществ, в выделении глюкозы и в работе нервной системы. При недостатке фосфора в первую очередь разрушаются кости и зубы. Снижается работоспособность и умственная деятельность. Начинают болеть суставы и мышцы. Аппетит снижается, появляется раздражительность. При избытке фосфора страдают почки, нервная система, может возникнуть остеопороз.
Водород. Входит в состав молекул воды и органических соединений: белков, липидов, углеводов, нуклеиновых кислот. Образует водородные связи и этим поддерживает четвертичную структуру белка, а также осуществляет принцип комплементарности при построении нуклеиновых кислот. Ионы водорода участвуют в энергетическом обмене, фотосинтезе, биосинтезе, азотфиксации, в процессах мембранного транспорта и поддержании гомеостаза.
Неметаллы. Физические и химические свойства
Положение неметаллов в периодической системе
Как же определить, относится вещество к металлам или к неметаллам?
Если внимательно посмотреть на Периодическую систему Д.И. Менделеева (подробно с классификацией элементов знакомимся в параграфе 42 учебника по химии для 8 класса под редакцией Еремина В.В.) и провести условную диагональ от водорода через бор до астата и неоткрытого пока элемента № 118, таблица неметаллов займет правый верхний угол.
Каждый горизонтальный период таблицы заканчивается элементом с завершенным внешним энергетическим уровнем. Эта группа элементов носит название благородные газы и имеет особые свойства, с которыми можно познакомиться в параграфе 18 учебника «Химия» для 8 класса под редакцией Еремина В.В.
При рассмотрении электронного строения неметаллов можно заметить, что энергетические уровни атома заполнены электронами больше чем на 50% (исключение – бор), и у элементов, расположенных в таблице справа налево количество электронов на внешнем уровне увеличивается. Поэтому в химических реакциях эта группа веществ может быть как акцептором электронов с окислительными свойствами, так и донором электронов с восстановительными свойствами.
Вещества, образующие диагональ бор-кремний-германий-мышьяк-теллур, являются уникальными, и в зависимости от реакции и реагента могут проявлять как металлические, так и неметаллические свойства. Их называют металлоиды. В химических реакциях они проявляют преимущественно восстановительные свойства.
Физические свойства неметаллов. Аллотропия
Если смотреть на металлы, то невооруженным глазом можно заметить общие свойства — металлический блеск, твердое агрегатное состояние (исключение — жидкая ртуть), тепло- и электропроводность.
С неметаллами все намного сложнее. Они могут иметь молекулярное и немолекулярное строение. Благодаря различиям в строении, простые вещества неметаллы существуют в трех агрегатных состояниях:
Большинство из неметаллических веществ плохо проводят электричество и тепло.
Исключением является графит — разновидность углерода.
Аллотропия — уникальная способность неметаллического элемента образовывать несколько простых веществ. В естественной среде существуют аллотропные модификации элементов, которые отличаются физическими и химическими свойствами. К ним относятся озон и кислород, графит и алмаз. Подробнее о физических свойствах неметаллов вы можете узнать в учебнике «Химия. 9 класс».
Химические свойства неметаллов
Как мы разобрали выше, группа неметаллов довольно полиморфна и в зависимости от типа реакций, в которых они участвуют, могут проявлять и окислительные, и восстановительные свойства. Фтор — исключение в этом ряду. Он всегда окислитель.
В ряду F,O,N,CL,Br,I,S,C,Se,P,As,Si,H окислительные свойства уменьшаются. Восстановительные свойства кислород может проявлять только в отношении фтора.
В этом типе реакций проявляются окислительные свойства и неметаллы принимают электроны с образованием отрицательно заряженных частиц.
Практически все неметаллы реагируют с водородом. Лишь благородные газы составляют исключение для реакций данного типа. Продуктом реакции являются летучие водородные соединения:
P + 5O2 = 2P2O5
4. Взаимодействие с водой и кислотами для неметаллов не характерно.
История открытия неметаллов
Медная посуда, железные орудия труда, золотые украшения — издавна человек замечал, что у всех этих веществ есть определенные общие свойства:
В противовес металлам были и другие вещества, не обладающие металлическими свойствами, и названные соответственно неметаллами. Практически до конца XVII века ученым-алхимикам было известно всего лишь два вещества-неметалла — углерод и сера.
В 1669 году Бранд в поисках «философского камня» открыл белый фосфор. И за короткий период с 1748 по 1798 годы было открыто около 15 новых металлов и 5 неметаллов.
В настоящее время открыто 22 неметаллических элемента.
Какой неметалл в больших количествах встречается
В процессе изучения химии вы уже ознакомились со многоми неметаллическими элементами и их соединениями. Наиболее известные вам неметаллы – водород, кислород и их уникальное соединение – вода. В 8 классе на примере VII группы главной подгруппы вы познакомились с семейством неметаллов – галогенами, с их свойствами. В новой теме вы получите целостные представления об элементах-неметаллах. Учитывая, что вы имеете некоторый запас знаний о них, умеете использовать ПСХЭ, мы сначала ознакомимся с общими свойствами групп неметаллов, затем и с их конкретными представителями. Такой подход в изучении предмета называется дедуктивным.
I. Положение элементов-неметаллов в ПСХЭ

II. Строение атомов неметаллов
Для атомов-неметаллов характерно:
Небольшой атомный радиус (в сравнении с радиусами атомов-металлов одного с ними периода).
Большее число электронов на внешнем уровне (4-8), исключения Н, Не, В.
Происходит заполнение электронами только внешнего энергетического уровня.
Для элементов-неметаллов характерны высокие значения электроотрицательности.
III. Общие свойства элементов-неметаллов по их положению в ПСХЭ
Своеобразной мерой неметалличности элементов является электроотрицательность (вспомнить понятия электроотрицательности, ряд электроотрицательности). Чем больше ЭО элемента, тем сильней его способность к оттягиванию общих электронных пар, а значит тем сильнее неметаллические, т.е. окислительные способности. Чем ближе в ПС элемент располагается к фтору, тем сильнее проявляются у него окислительные свойства.
III. Неметаллы в природе
Атомы неметаллических элементов составляют подавляющее большинство соединений во Вселенной и верхних слоях Земли. Они более распространены в природе, чем металлы. Некоторые неметаллические элементы встречаются в природе в виде простых веществ: месторождения самородной серы в Прикарпатье; Завальевское месторождение графита; существуют залежи пород, содержащих алмазы. В состав воздуха входят: азот, кислород, инертные газы. Распространенным элементом в космосе является водород. Гораздо больше атомов неметаллических элементов образуют различные сложные вещества. Так, значительную часть литосферы составляет кремнезем SiO2, гидросферы — вода.
Кислород один из самых распространенных элементов на Земле. В земной коре в составе соединений 49% по массе. Он входит в состав воды, горных пород, минералов, солей. Есть обязательной составной частью растительных, животных организмов: входит в состав белков, жиров, углеводов. В воздухе свободного кислорода 21% по объему.
Сера широко распространен в природе как в свободном виде (с примесями горных пород), так и в соединениях с различными металлами (сульфиды), а также в виде солей. Сульфиды: железный колчедан или пирит FeS2, цинковая обманка ZnS, медный блеск CuS, киноварь HgS. Сульфаты: гипс CaSO4 • 2H2O, глауберовая соль Na2SO4 • 10H2O, горькая соль MgSO4 • 7H2O. Содержится в живых организмах, входит в состав белка, в состав органических соединений в нефти.
Элемент Карбон (углерод) входит в состав нефти, газа, угля, сланцев, органических соединений, углекислого и угарного газов. Важный элемент живой природы — входит в состав белков, жиров, углеводов, витаминов, ферментов, гормонов. В виде простых веществ графита и алмаза; сложных веществ: CaCO3 — мел, известняк, мрамор, CaCO3 • MgCO3 — доломит, MgCO3 — магнезит.
Чистый кремний в природе не существует, его добывают химическим способом. По распространенности занимает второе место после кислорода. Оболочка Земли на 97% состоит из соединений кремния. Встречается в виде: SiO2 — песок, кварц, кремнезем; минералов — слюда, асбест, тальк, нефелин, полевой шпат. В стеблях растений (хвощ, бамбук), в теле птиц и животных — перья, глаз, скелет, тело губок.
Азот в виде простого вещества азота входит в состав воздуха, примерно 78% по объему. Содержание элемента в земной коре — 0,01% по массе в виде нитратов. Небольшое количество в составе нефти и каменном угле. Входит в состав белковых веществ всех живых организмов.
Фосфор в природе существует только в соединениях в виде фосфатов. Главные минералы в состав которых входит Фосфор — Ca3(PO4)2 — апатиты и фосфориты (0,08%). Элемент Фосфор входит в состав костной, мышечной, нервной тканей человека и животных, многие его в клетках мозга.
IV. Аллотропия неметаллов
Среди неметаллов распространено явление аллотропии. Один элемент может образовывать несколько простых веществ.
Разные типы кристаллических решеток (белый фосфор Р4 – молекулярная, красный фосфор Р – атомная).
Разная структура кристаллической решетки (алмаз – тетраэдрическая, графит – слоистая).
Разный состав молекул аллотропных модификаций (О2 и О3).
Тесты по химии на тему «Азот»
Тесты по теме «Азот»
1. Электронное строение внешнего энергетического уровня атома азота:
а ) 3s 2 3p 6 б ) 3s 2 3p 4 в ) 2s 2 2p 6 г ) 2s 2 2p 3
2. Укажите наиболее характерные степени окисления азота в соединениях:
3. Укажите число протонов в ядре атома азота
а) 32 б) 7 в) 48 г) 26
4. Какие свойства проявляет азот в химических реакциях с простыми веществами?
а) окислительные в) окислительные и восстановительные
б) восстановительные г) азон не вступает в реакцию с простыми веществами.
5. Азот является: а) s – элементом; б) p – элементом; в) d – элементом; г) f – элементом.
Ключ к тестовым заданиям варианта № 1: 1. – г); 2. – а); 3. – б); 4. – в); 5. – 5).
1. Укажите число нейтронов в ядре атома азота:
а) 32 б) 16 в) 48 г) 7
2. Азот проявляет высшую степень окисления в соединении:
3. Верно ли из следующих утверждений, что азот – газ?
4. Азот не проявляет свойства восстановителя в реакции с:
а) металлами; б) водородом; в) кислородом ; г) кремнием.
5. Укажите правильную схему распределения электронов по энергетическим уровням для атома азота:
Ключ к тестовым заданиям варианта № 2: 1. – г); 2. – б); 3. – г); 4. – в); 5. – г).
1. Процесс отдачи электронов атомами называется:
а) окисление ; б) восстановление; в) окисление-восстановление; г) восстановление- окисление.
2. Какой из неметаллов широко используют в холодильных системах?
а) жидкий азот ; б) сера; в) фосфор; г) углерод.
3. Этот неметалл называют «неподдерживающий жизнь»:
4. Какой неметалл в больших количествах встречается:
а) в натриевой силитре; б) в калиевой силитре ; в) в литиевой силитре; г) в цезиевой силитре.
5. Где расположен неметалл азот в периодической системе химических элементов Д. И. Менделеева?
а) в первом периоде главной подгруппы первой группы;
б) во втором периоде побочной подгруппы второй группы;
в) в четвёртом периоде главной подгруппы четвёртой группы;
г) во втором периоде главной подгруппы пятой группы.
Ключ к тестовым заданиям варианта № 3: 1. – а); 2. – а); 3. – г); 4. – б); 5. – г).
1. Степень окисления –3 азот проявляет в соединении:
2. Степень окисления +2 азот проявляет в соединении:
3. Высшим оксидам азота соответствует:
4. В « V А» группу не входит элемент:
5. Для азота не характерна валентность:
а) I ; б) II ; в) IV ; г) V д) III
Ключ к тестовым заданиям варианта № 4: 1. – а); 2. – в); 3. – г); 4. – а); 5. – а).
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
Курс повышения квалификации
Современные педтехнологии в деятельности учителя
Курс профессиональной переподготовки
Методическая работа в онлайн-образовании
Ищем педагогов в команду «Инфоурок»
Номер материала: ДБ-451682
Международная дистанционная олимпиада Осень 2021
Не нашли то что искали?
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Безлимитный доступ к занятиям с онлайн-репетиторами
Выгоднее, чем оплачивать каждое занятие отдельно
Шойгу предложил включить географию в число вступительных экзаменов в вузы
Время чтения: 1 минута
Рособрнадзор откажется от ОС Windows при проведении ЕГЭ до конца 2024 года
Время чтения: 1 минута
Минпросвещения будет стремиться к унификации школьных учебников в России
Время чтения: 1 минута
Минпросвещения разрабатывает образовательный минимум для подготовки педагогов
Время чтения: 2 минуты
Российские адвокаты бесплатно проконсультируют детей 19 ноября
Время чтения: 2 минуты
ЕСПЧ запретил учителям оскорблять учеников
Время чтения: 3 минуты
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Неметаллы
Урок 34. Химия 11 класс ФГОС
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Неметаллы»
Как известно, традиционное деление элементов на металлы и неметаллы исторически сложилось из-за того, что металлы, как правило, находятся в твёрдом агрегатном состоянии, имеют металлический блеск, тепло- и электропроводны, ковки и пластичны, а неметаллы при обычных условиях этими свойствами не обладают.
К неметаллам относятся 23 химических элемента, все неметаллы являются элементами главных групп.
Условная граница между металлами и неметаллами находится на линии в направлении от бора к астату. Таким образом, элементы, расположенные начиная с третьей А группы и заканчивая восьмой А группой, являются неметаллами. К неметаллам относится и водород, расположенный в первой A группе.
Число элементов неметаллов в группе увеличивается с номером группы.
В третьей A группе находится только один элемент неметалл – бор, а восьмая A группа полностью состоит из неметаллов.
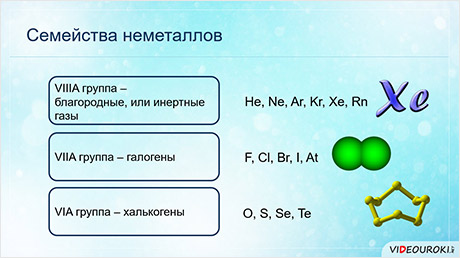
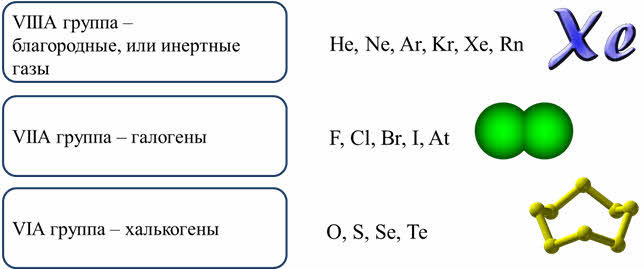
Для некоторых неметаллов используют групповые названия. Элементы восьмой A группы называются благородными, или инэртными газами, элементы седьмой A группы называются галогенами, элементы шестой A группы – халькогенами.
Наиболее типичными неметаллами являются: водород, кислород, углерод, азот, фосфор, сера, а также галогены – фтор, хлор, бром, йод.
Элементы, расположенные вдоль условной разграничительной линии: бор, кремний, германий, мышьяк, селен, тэллур, астат, являются неметаллам, но могут проявлять и металлические свойства, поэтому их называют полуметаллами.
У атомов большинства неметаллов, кроме водорода, гелия и бора, на внешнем энэргетическом уровне от четырёх до восьми электронов. У атома водорода на внешнем уровне содержится только один электрон, у гелия – два и его электронный слой полностью заполнен, у бора на внешнем энергетическом уровне находится три электрона.
Число электронов на внешнем уровне численно равно номеру группы. Так, углерод и кремний – элементы четвёртой A группы содержат четыре электрона на внешнем энэргетическом уровне, а азот и фосфор – элементы пятой A группы содержат пять электронов на внешнем слое.
Атомы водорода и гелия относятся к эс-элементам, а все остальные атомы неметаллов – к пэ-элементам.
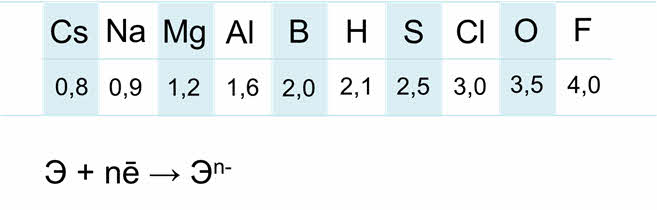
Электроотрицательность неметаллов гораздо выше, чем металлов.
Электроны внешнего энэргетического уровня прочно связаны с ядром, поэтому для атомов неметаллов характерна способность присоединять электроны до завершения внешнего слоя.
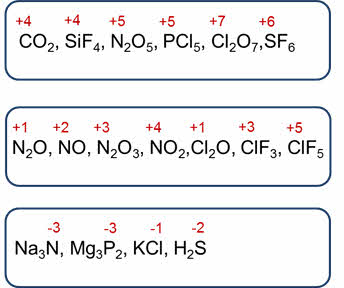
Для атомов неметаллов возможны различные степени окисления. Максимальная положительная степень окисления, кроме кислорода и фтора, равна номеру группы. Например, у углерода и кремния плюс четыре, у азота и фосфора — плюс пять, у хлора — плюс семь, у серы — плюс шесть.
Некоторые неметаллы проявляют несколько положительных степеней окисления. Например, азот может кроме плюс пяти иметь такие степени окисления, как плюс один, плюс два, плюс три, плюс четыре, а хлор, кроме степени окисления плюс семь, имеет степени окисления плюс один, плюс три, плюс пять.
Минимальная отрицательная степень окисления равна номер группы минус восемь. У азота и фосфора минимальная отрицательная степень окисления равна минус трём, у атомов галогенов — минус один, у серы — минус два.
Таким образом, атомы неметаллов в их соединениях с атомами металлов, водорода и других менее электроотрицательных элементов проявляют отрицательные степени окисления, а в соединениях с более электроотрицательными элементами для атомов неметаллов характерны положительные степени окисления.
Благородные газа – ксенон и в меньшей степени криптон – в своих соединениях со фтором и кислородом также способны проявлять положительные степени окисления плюс два, плюс четыре, плюс шесть и плюс восемь.
Исключение составляет фтор, который в соединениях может проявлять только степень окисления минус один.
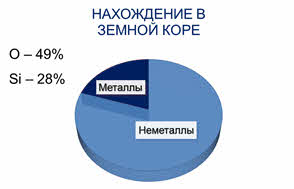
Массовая доля неметаллов в земной коре составляет почти 80%, а во вселенной достигает девяноста девяти процентов (в основном за счёт водорода и гелия). На долю кислорода в земной коре приходится более 49%, на долю кремния – около 28%, а на долю брома, йода, селена и тэллура – сотые доли процента.
Неметаллы входят и в состав живых организмов. Эти элементы называются органогенными. К ним относятся: углерод, кислород, водород, азот, фосфор, сера.
Несмотря на незначительное содержание селена, брома, йода в живых организмах, эти элементы относятся к жизненно необходимым.
В последние годы учёные установили, что селен оберегает клетки от вредного воздействия ультрафиолетового и радиоактивного облучения. Селен содержится в таких грибах, как лисички, опята, маслята, но значительно больше этого элемента содержится в ядовитых грибах: бледной поганке, мухоморе.
По мнению учёных, большие концентрации селена в грибах способствуют их быстрому росту. Но следует помнить, что употребление продуктов, содержащих селен в больших количествах, больше пяти миллиграмм на один килограмм пищи, приводит к острому отравлению организма человека.
В природе неметаллы встречаются как в виде простых веществ, так и в виде сложных соединений. Большая часть неметаллов входит в состав минералов и горных пород, в состав органических соединений.
Молекулы неметаллов могут быть одноатомными (благородные газы), двухатомными (галогены, кислород, азот и водород), а также содержать большее число атомов (как озон, фосфор и сера).
Атомы некоторых неметаллов могут образовывать цепи, например, атомы углерода образуют цепи неограниченной длины, а атомы кремния – недлинные цепи (до шести атомов).
Неметаллы образуют вещества молекулярного строения (кислород, азот, сера, благородные газы) и немолекулярного строения (углерод в виде алмаза и графита).
Для неметаллов характерно разнообразие в физических свойствах. Как вы знаете, при обычных условиях кислород, водород, азот, фтор, хлор – газы, как и элементы благородные, или инэртные газы.
Единственной жидкостью среди неметаллов является бром. Все остальные неметаллы – твёрдые вещества, которые имеют атомную кристаллическую решётку, как у бора и кремния, так и молекулярную, как у йода, фосфора, серы.
Многие неметаллы обладают окраской: графит – серо-чёрной, бром – красно-бурой, сера – жёлтой, хлор – жёлто-зелёной, йод – фиолетово-чёрной.
Очень различаются и другие физические свойства неметаллов: так температура плавления графита составляет 3850 градусов по Цэльсию, а у гелия — минус 272 градуса по Цэльсию.
Плотность газообразных неметаллов также различна: самая маленькая – у водорода, а самая большая – у радона.
Твёрдые неметаллы не обладают пластичностью.
В воде неметаллы нерастворимы или малорастворимы. Некоторые из них, как галогены, сера лучше растворяются в органических растворителях, а белый фосфор – в сероуглероде.
Различаются неметаллы и по электропроводности. Большинство неметаллов – это изоляторы.
Графит – является хорошим проводником электрического тока. Кремний, селен и тэллур обладают полупроводниковыми свойствами.
Интересно, что радиоактивный радон используется в медицине для лечения опорно-двигательного аппарата, сердечных и нервных заболеваний. Но в тоже время в литературе часто упоминается термин «радоновая проблема», который означает достаточно высокое облучение, вызванное радоном, который выделяется через разломы в земной коре.
Для неметаллов характерно явление аллотропии.
Аллотропия (от греч. аллотропия – другое свойство) явление существования элементов в виде нескольких простых веществ. Так, химический элемент кислород в природе существует в виде двух простых веществ – кислорода и озона. Различный состав и строение молекул определяют различие в их свойствах.
Кислород – газ без цвета и запаха, озон – газ светло-голубого цвета с резким характерным запахом. Они различаются также температурами плавления и кипения, реакционной способностью.
В природе озон образуется при грозовых разрядах и при окислении смолы хвойных деревьев. Озон в верхних слоях атмосферы образует озоновый слой, который защищает живые организмы от ультрафиолетового излучения.
Небольшое количество озона в воздухе оказывает целебное действие на людей с заболеванием лёгких, но сильное обогащение воздуха озоном может стать опасным для здоровья. Источником озона служат работающие ксероксы, лазерные принтеры, источники ультрафиолетового и рентгеновского излучения. Поэтому помещения, в которых находятся такие приборы необходимо часто проветривать.
Химический элемент углерод также встречается в нескольких аллотропных модификациях: графит, алмаз, карбин, фуллерен, но наиболее распространены алмаз и графит, которые отличаются по своим свойствам. Графит – мягкое, серо-чёрное вещество, хорошо проводит электрический ток, а алмаз – прозрачный кристалл, самое твёрдое природное вещество, является изолятором.
Простые вещества неметаллы различаются и по химической активности. Наиболее химически активны галогены и кислород. Сера, фосфор, углерод и кремний вступают в химические реакции, как правило, только при нагревании.
Для неметаллов характерны и восстановительные, и окислительные свойства. Способность неметаллов проявлять те или иные свойства определяется положением их в ряду электроотрицательности. Электрооотрицательность уменьшается от фтора к водороду.
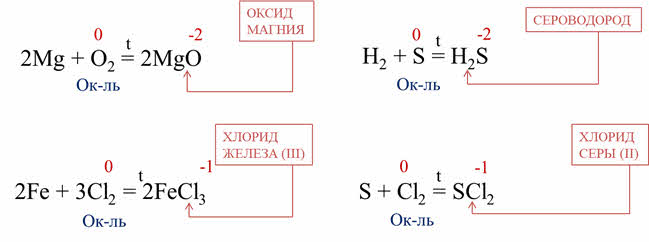
В качестве окислителей неметаллы взаимодействуют с металлами. Например, при горении магния в кислороде образуется оксид магния, кислород понижает свою степень окисления с нуля до минус двух, поэтому он вступает в роли окислителя, при горении железа в хлоре образуется хлорид железа три, хлор понижает степень окисления с нуля до минус единицы, поэтому хлор является окислителем.
В реакции с водородом неметаллы выступают в качестве окислителей, а водород – в качестве восстановителя. Например, в реакции водорода с серой образуется сероводород. Сера понижает свою степень окисления с нуля до минус двух, поэтому сера – окислитель.
Неметаллы выступают в роли окислителей при взаимодействии с другими неметаллами, имеющими более низкую электроотрицательность. Так, в реакции серы с хлором образуется хлорид серы два, хлор понижает свою степень окисления с нуля до минус единицы, поэтому хлор – окислитель.
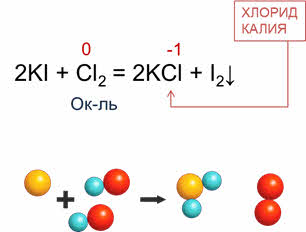
Неметаллы реагируют и со сложными веществами: в реакции хлора с йодидом калия образуется хлорид калия и йод. В этой реакции хлор понижает свою степень окисления с нуля до минус единицы, поэтому в данной реакции хлор является окислителем.
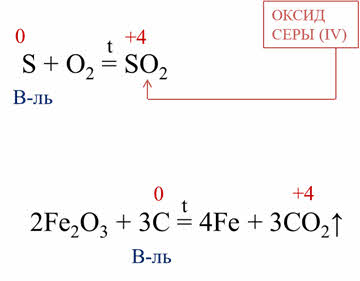
В качестве восстановителей неметаллы выступают в реакциях с неметаллами, атомы которых имеют более высокое значение электроотрицательности. Например, в реакции горения серы образуется оксид серы четыре, в данной реакции сера повышает свою степень окисления с нуля до плюс четырёх, поэтому в этой реакции сера – восстановитель.
Восстановительные свойства неметаллы проявляют и в реакциях со сложными веществами. Например, в реакции углерода с оксидом железа три углерод повышает свою степень окисления с нуля до плюс четырёх, выступая в роли восстановителя.
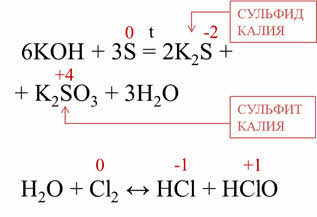
В реакциях диспропорционирования один и тот же неметалл является одновременно и окислителем, и восстановителем.
Например, в реакции серы с гидроксидом калия образуется сульфид калия, сульфит калия и вода. Сера, таким образом, изменила свою степень окисления с нуля до мину двух и плюс четырёх. В реакции хлора с водой хлор также изменяет свою степень окисления с нуля до минус единицы и плюс единицы.
Таким образом, все неметаллы являются элементами главных групп. Атомы неметаллов могут проявлять как отрицательные, так и положительные степени окисления. Простые вещества неметаллы существенно различаются между собой физическими и химическими свойствами. Для неметаллов характерно явление аллотропии. В химических реакциях неметаллы могут проявлять окислительные и восстановительные свойства.