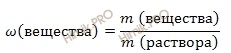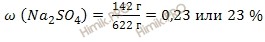какой объем 2 м раствора сульфата натрия получится при растворении 25г na2so4 в воде
Химик.ПРО – решение задач по химии бесплатно
Какова массовая доля сульфата натрия (Na2SO4) в растворе, полученном при растворении в 300 граммах воды 1 моль глауберовой соли (Na2SO4 10H2O)?
Решение задачи
При решении данной задачи будем использовать формулу нахождения массовой доли растворенного вещества в растворе:
Массовая доля растворенного вещества в растворе – это отношение массы растворенного вещества к массе раствора. Выражается в долях единицы или в %. Следует отметить, что массовая доля растворенного вещества в растворе, выраженная в %, называется процентной концентрацией раствора.
Найдем массу безводного сульфата натрия (Na2SO4), содержащегося в 1 моль кристаллогидрата (Na2SO4 10H2O).
Для этого рассчитаем молярные массы сульфата натрия (Na2SO4) и глауберовой соли (Na2SO4 10H2O):
Учитывая, что в 1 моль глауберовой соли (Na2SO4 ∙ 10H2O) содержится 1 моль безводного сульфата натрия (Na2SO4) и что молярные массы глауберовой соли (Na2SO4 10H2O) и безводного сульфата натрия (Na2SO4) соответственно равны 322 и 142 г/моль, вычислим массы данных веществ по формуле, устанавливающей связь между массой и химическим количеством вещества:
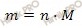
Найдем массу раствора, используя формулу нахождения массы раствора:

m (раствора) = 322 г + 300 г = 622 (г).
Используя формулу нахождения массовой доли растворенного вещества в растворе, вычислим массовую долю сульфата натрия (Na2SO4) в растворе глауберовой соли (Na2SO4 10H2O):
Ответ: массовая доля сульфата натрия (Na2SO4) в растворе = 0,23 или 23 %.
«Решение задач по химии»
РАБОЧАЯ ПРОГРАММА КУРСА
«Решение задач по химии»
Вычисления по химическим уравнениям.
Вычисление количества (массы) продуктов реакции по известному количеству (массе) одного из вступивших в реакцию веществ.
1. Запишите условие задачи, выяснив единицы их измерения.
2. Запишите уравнение реакции.
3. Подчеркните формулы веществ, с которыми будете работать.
4. Над формулами веществ напишите данные условия задачи.
5. Под подчеркнутыми формулами подпишите:
А) количества этих веществ,
Б) М – массу или Vm (как того требует решение задачи),
В) m – массу вещества.
6. Приведите все значения величин надписанные и подписанные под формулами веществ к единой единице измерения:
7. Установите логическую связь:
А) между величинами веществ (по условию задачи),
Б) между величинами веществ (по уравнению реакции).
8. Составьте и решите пропорцию. Найдите значение неизвестной величины.
9. Выразите найденное значение величиной в той единице, которая требуется по условию задачи.
Вычисление относительной плотности газов.
1. Составьте краткую запись условия задачи.
2. Из понятия «относительная плотность газов» следует:
А) D (газ1) (газ2) = Mr (газа1) / Mr (газа2);
Б ) D ( газ ) (H2) =Mr ( газа ) / Mr (H2) = Mr ( газ ) / 2 ;
В) D (газ) (воздух) = Mr (газа) / Mr (воздуха) = Mr (газ) / 29
1) D ( СО 2) (H2) =Mr ( СО 2) / Mr (H2) = (12+16*2)/ 2=22
2) D (СО2) (воздух) = Mr (СО2) / Mr (воздуха) = (12+16*2)/29 =1,52
Ответ: D (СО2) ( H 2) =22; D (СО2) (воздух) = 1,52
1) Найдем массу соли в растворе из формулы
w ( NaCl )= m ( NaCl )/ m (р-ра)*100%, следовательно
m ( NaCl )= w ( NaCl )* m (р-ра)/ 100%=12*150/100=18г
2) m ( H 2 O )= m (р-ра)- m ( NaCl )=150г-18г=132г
Ответ: m ( NaCl ) = 18г, m ( H 2 O )= 132г.
1. Какова массовая доля NaOH в растворе, полученном при растворении 4г NaOH в 46г воды?
2. Путем выпаривания 20г раствора было получено 4г CuSO 4.
Какова массовая доля соли раствора?
3. К 80г 15% раствора сульфата натрия прибавили 20г воды.
Какова массовая доля соли станет после разбавления водой раствора?
4. Какую массу поваренной соли и воды надо взять, чтобы получить:
А) 100г 10% раствора,
Б) 200г 15% раствора?
Вычисление по химическим формулам с использованием понятия
Из формул * следует
V газа/22,4 л/моль = m (газа) / M (газа)
v (H 2 SO 4 ) = m (H 2 SO 4 ) / M (H 2 SO 4 );
M (H 2 SO 4 )=2+32+16*4=98 г / моль ;
v ( H 2 SO 4 )=49г /98г/моль = 0,5 моль
Ответ: v ( H 2 SO 4 )= 0,5 моль
V (CO 2 ) / Vm = m ( CO 2 ) / M ( CO 2 ), следовательно
V (CO 2 )= m ( CO 2 )* Vm / M ( CO 2 ) = 2,2г*22,4л/моль /44г/моль = 1,12л
Ответ: V ( CO 2 ) = 1,12л
Приготовление растворов с определенной массовой долей растворенного вещества
Вспомните о взаимодействии величин
А) m ( р-ра ) = m ( растворителя ) + m ( вещества );
Б) w (вещества)%= m ( вещества )/ m ( раствора )*100%
Дано: m ( спирта )=47,5г
Решение: 1) Найти m ( раствора )
m ( р-ра ) = m ( спирта ) + m ( вещества )= 47,5+2,5=50г
2) Найти массовую долю I 2 в растворе.
w ( I 2 )%= m ( I 2 )/ m ( раствора )*100% =2,5г/50г*100%=5%
Нахождение простейшей формулы вещества по массовым долям элементов.
Задача: выведите химическую формулу оксида азота, элементарный состав которого:
1. Составляем краткую запись условия задачи.
2. Записываем отношения масс элементов, зная, что отношение масс элементов равно отношению их массовых долей:
m 1(эл-та) : m 2(эл-та) = w 1(эл-та) : w 2(эл-та) …
3. Вычислить количество элементов по формуле:
v (эл-та) = m (эл-та) / M (эл-та)
4. А) Запишите отношение количества элементов;
Б) Выразите это отношение целым числом.
5. составьте химическую формулу (индексами в ней будут найденные целые числа).
1) m ( N ) : m ( O ) = w ( N ) : w ( O )
2) V ( N ) = m / M =36,87/ 14 = 2,63 моль
3 ) V ( O ) = m / M =63,16/ 16 = 3,94 моль
4) V ( N ) : V ( O ) = 2,63 / 3,94=1:1,5=2:3
Вычисление отношения масс элементов и массовых долей элементов
в сложном веществе.
1. Дана химическая формула вещества
Найти: массовые доли химических элементов.
2. Записываем количество каждого элемента в веществе, исходя из его химической формулы (индексы в хим. формуле соответствуют количествам элементов)
3. Вычисляем массы элементов по формуле
m (эл-та) = M (эл-та) * v (эл-та)
4. Можно вычислить отношение масс элементов
5. Вычислить массу 1 моль вещества (1 моль вещества = сумме масс элементов)
6. Вычисляем массовые доли (%) элементов:
w %(эл-та) = m (эл-та) / m (вещества) *100%
Задача: найти массовые доли элементов в сульфате меди.
CuSO 4 – сульфат меди
1)M ( CuSO 4 ) = Ar ( Cu ) + Ar ( S ) + 4Ar ( O ) =64+32+64 = 160 г / моль
2) исходя из формулы w %(эл-та) = m (эл-та) / m (вещества) *100% находим
Определение количества (массы или объема) продукта реакции, если один из сореагентов взят для реакции в избытке.
1. Сделать краткую запись условия задачи;
2. Записать уравнение реакции;
3. Расставить данные условия задачи (вверху), подставить под формулами веществ данные уравнения;
4. Найти отношение молей исходных веществ, применив формулы:
v = m / M или v = V / V m
5. Найти, какое вещество в избытке, а какое – в недостатке (по нему вести расчет).
6. Вычислить число молей продукта реакции, его массу.
Задача: Рассчитайте массу гидроксида меди, образовавшегося при сливании двух растворов, содержащих соответственно 24 г. сульфата меди и 16 г. гидроксида натрия.
M ( CuSO 4)=64+32+16*4=160г/моль
M ( NaOH )=23+16+1=40г/моль
M ( Cu ( OH )2)=64+(16+1)*2=98г/моль
1. Найдем соотношение молей исходных веществ:
v ( CuSO 4) = m : M =24г : 160 г/моль =0,15моль – недостаток
v ( NaOH ) = m : M =16г : 40 г/моль =0,4моль – избыток
Находим, какое вещество взято в избытке, а какое – в недостатке:
По уравнению реакции: v ( CuSO 4): v ( NaOH )=1:2
По условию задачи: v ( CuSO 4): v ( NaOH )=0,15:0,4=1:2,7
CuSO 4 – в недостатке; NaOH – в избытке.
Дальнейшие расчеты по CuSO 4
2. v ( Cu(OH ) 2 ) =0,15моль
3. m ( Cu ( OH ) 2 )= M * v = 98г/моль*0,15 моль=14,7 г Ответ: m ( Cu ( OH ) 2 )= 14,7 г
1. По закону Авогадро: отношение количеств газов равно отношению их объемов:
v (газ1) / v (газ2) = V (газ1) / V (газ2) ;
2. Составляем краткую запись условия задачи
3. Записываем уравнение реакции
4. Расставляем: а) над формулами веществ данные условия задачи;
б) под формулами подписать количество веществ
5. Составить пропорцию и найти из нее значение неизвестной величины.
Задача: Вычислите, какой объем азота вступит в реакцию с 6 л водорода?
1) v ( N 2 ) / v (Н 2 ) = V ( N 2 ) / V (Н 2 )
Вычисление выхода продукта реакции (%) от теоретически возможного.
1. Составьте краткую запись условия задачи.
2. Вычислите массу продукта реакции ( m теорет) по известной массе (количеству) одного из веществ, вступивших в реакцию.
3. Вычисляем массовую долю продукта реакции:
? (%)= m (практ.) : m (теорет.) *100%
Задача. При взаимодействии в растворе сульфата натрия с 20,8г хлорида бария был получен осадок сульфата бария, масса которого после фильтрования и высушивания составила 22г. определите массовую долю (в %) выхода соли от теоретически возможного.
m пр ( BaSO 4 )=2 2 г
М( BaCl 2 )= 137+71=208г/моль
М( BaSO 4 )=137+32+64=233г/моль
1. найдем v ( BaCl 2 )
v ( BaCl 2 ) = m : M =20,8г : 208 г/моль =0,1моль
т.к. отношение их молей v ( BaCl 2 ): v ( BaSO 4 )=1 моль:1 моль
3. m теор ( BaSO 4 )= M * v = 233г/моль * 0,1моль=23,3г
Вычисление массы вещества (исходного или получаемого) по уравнению реакции, если известна масса другого вещества (получаемого или исходного), содержащего определенную долю примесей.
Задача. Какая масса оксида кальция может быть получена из 500т известняка, в котором массовая доля примесей составляет 0,2 (или 20%)?
m ( изв )=500 т = 500 000кг
w чист CaCO 3 = 8 0 %
М( CaCO 3 )= 40+12+16*3=100г/моль
1. Найдем m чистого CaCO 3
w чист CaCO 3 = m ( чист CaCO 3 ) / m (всего известняка) *100%, отсюда
m ( чист CaCO 3 ) = w чист CaCO 3 * m (всего известняка) :100%
= 80%* 500 000кг: 100% = 400 000 кг
2. Найдем количество CaCO 3
v ( CaCO 3 ) = m : M =400 000:100= 4000 молей
3. v (CaO) = v (CaCO 3 )= 4000 молей
4. m ( CaO )= M * v = 4000молей *56кг/молей=224 000кг
Ответ: m ( CaO )=224 000кг = 224т
Вычисление массы продукта реакции, если известна массовая доля выхода продукта реакции по сравнению с теоретически возможным.
Задача. На гашенную известь, взятую в необходимом количестве, подействовали 3,15 кг чистой азотной кислотой. Какую массу нитрата кальция ( Ca ( NO 3 ) 2 ) получили, если практический выход его составляет в массовых долях 0,98 (или 98%) по сравнению с теоретическим?
М( HNO 3 )= 1+14+16*3=63кг/моль
М(С a ( NO 3 ) 2 )=40+(14+16*3)*2=164кг/моль
v ( HNO 3 ) = m : M =3,15кг : 63 кг/моль =0,05моль
3. m ( Ca ( NO 3 ) 2 )= M * v = 164кг/моль * 0,025 моль =4,1кг (ТВ)
Ответ : m практ (С a ( NO 3 ) 2 )= 4,02 кг
Задача1. На нейтрализацию раствора серной кислоты потребовался раствор, содержащий 8 г гидроксида натрия. Какова масса образовавшейся соли?
М( NaOH )= 23+16+1=40 г/моль
М( Na 2 SO 4 )=23*2+32+16*4=164кг/моль
I способ (составлением пропорции):
80 г—- 142 г (по уравнению реакции)
I I способ решения:
v ( NaOH ) = m : M =8 г : 40г/моль =0,2моль
3. m ( Na 2 SO 4 )= M * v = 142г/моль * 0,1 моль =14,2 г
Ответ : m ( Na 2 SO 4 ) =14,2 г
Вычисление массы или объема продукта реакции, по известной массе исходного вещества, содержащего определенную массовую (или объемную) доли примесей.
Химическими формулами обозначают состав чистых веществ. Сырье, поступающее на производство содержащий примеси, т.е. вещества, которые не участвуют в проводимых реакциях
m ( известняка )=3 00кг
1. 100-8=92% чистого карбоната Са
2. m (СаСО 3 ) = 92*300 : 100= 276кг
3. определяем массу негашеной извести
Ответ : m (С a О)= 154,6 кг
Задача 2. При обработке избытком соляной кислотой 30 кг природного известняка получено 5,6 м 3 (н.у.) углекислого газа. Вычислить массовую долю Ca СО 3 в известняке.
? ( Ca СО 3 )= m ( Ca СО 3 ) : m (известняка) * 100%= 25:30*100%=83,3% Ca СО 3
Задача 3. Какую массу известняка с массовой долей карбоната кальция 80% надо взять, чтобы получить углекислый газ объемом 112л?
x =100*112:22,4=500г Ca СО 3
1. Азот объемом 56 л (н.у.) прореагировал с водородом. Массовая доля выхода аммиака 50%. Рассчитайте массу полученного аммиака.
2. Установить формулу газообразного углеводорода, если при полном сжигании 0,7 г получили 1,12л углекислого газа и 0,9г воды. Относительная плотность паров этого вещества по водороду – 42.
4. Марганец получают восстановлением оксида марганца ( III ) кремнием. Технический оксид массой 20 кг с массовой долей примесей 5,2% восстановили до металла. Рассчитайте массу полученного марганца.
5. Требуется приготовить 500г раствора с массовой долей хлорида калия 14%. Рассчитайте массу требуемых хлорида калия и воды.
6. Какой объем кислорода необходим для полного окисления 5 литров ацетилена?
7. Рассчитайте массу газообразного водорода, который выделится, если растворить 4,5г алюминия в соляной кислоте.
8. Сколько граммов бензола вступило в реакцию с азотной кислотой, если при этом получилось 0,65 моль нитробензола?
9. Вычислите массы гидроксида натрия и сульфата меди ( II ), необходимых для получения 4,9г гидроксида меди ( II )?
10. Определите массу осадка, образовавшегося при добавлении к раствору хлорида калия, содержащего 7,45 хлорида калия 10г 85% раствора нитрата серебра.
11. Выведите молекулярную формулу органического вещества, если известно, что массовая доля углерода – 80%, водорода – 20%. Относительная плотность вещества по водороду – 15.
12. При восстановлении алюминием оксида железа ( III ) массой 100г выделяется 476,0 кДж. Определите тепловой эффект химической реакции.
13. Сколько литров оксида азота ( II ) получится при реакции 25,6г меди с разбавленной азотной кислотой?
Информацию подготовила Бондаренко Ирина Анатольевна,