при каком давлении воздух растворяется в воде
Растворимость воздуха в воде. Деаэрация. Закон Генри. Коэффициенты Генри для воздуха.
Растворимость воздуха в воде. Деаэрация. Закон Генри. Коэффициенты Генри для воздуха.
Деаэрация.
При нагревании пресной воды начинают формироваться воздушные пузырьки. Как известно, вода не может удерживать растворенный воздух при повышении температуры. При 1 баре и температуре 100 0 C (212 0 F) вода закипает и тогда уже водяной пар формирует пузырьки. Если быстро охладить воду, а потом снова ее нагреть, пузырьки не появятся до тех пор пока вода не закипит. Вода деаэрирована.
Растворимость.
Растворимость воздуха может быть выражена через соотношение:
Sa = массовая доля растворимого воздуха в воде
ma = масса воздуха (кг)
Закон Генри.
c = концентрация газа в растворе
k H = коэффициент Генри
pg = парциальное давление газа над раствором
Растворимость кислорода в воде выше растворимости азота. Воздух, растворенный в воде содержит приблизительно 35,6 % кислорода по сравнению с 21% долей в обычном воздухе.
Количество воздуха, растворенного в воде может быть посчитано, исходя из закона Генри.
Коэффициенты Генри при температуре окружающей среды 25 o C (77 o F)
Относительное содержание (по объему) в воздухе:
Объем кислорода, растворенного в воде при атмосферном давлении может быть посчитан как :
co = (1 атм) 0.21 / (756.7 атм/(моль/л)) (31.9988 г/моль)
Объем азота, растворенного в воде при атмосферном давлении может быть посчитан как:
cn = (1 атм) 0.79 / (1600 атм/(моль/л)) (28.0134 г/моль)
Поскольку воздух-это сумма кислорода и азота :
ca = (0.0089 г/л) + (0.0138 г/л)
Таблица. Количество (масса) воздуха, растворенного в воде при различных давлениях и температуре 25 o C (77 o F):
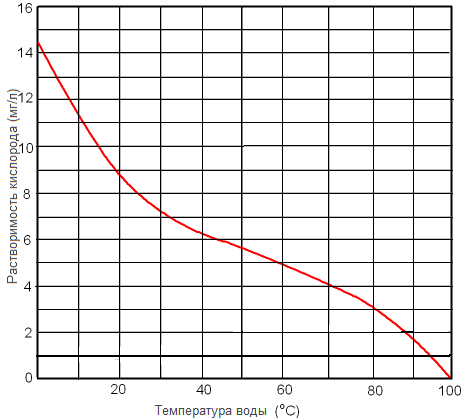
Рисунок. Растворимость кислорода в пресной воде при 1 атм в зависимости от температуры.
Деаэрация
Для максимальной деаэрации вода должна быть нагрета до 212 0 F (100 0 C) при атмосферном давлении. Это обычное инженерное решение для паровых систем, где пресная вода подается в систему через нагретый деаэратор наверху конденсатоприемника.
Также обычным решением является установка деаэрационных устройств с горячей стороны теплообменника в отопительных системах для интенсификации удаления растворенного воздуха из системы.
Поскольку максимум деаэрации приходится на минимум статического давления и максимум температуры в системе, то наилучший результат деаэрации достигается в верхних точках систем относительно уровня земли и/или на входе насоса.
9.12. Растворимость газов в жидкостях
Вы здесь
Воздух несколько растворим в воде; при комнатной температуре (20°С) и давлении 1 атм в 1 л воды растворяется 19,0 мл воздуха. (Количество растворенного в воде воздуха уменьшается с повышением температуры.) При увеличении давления вдвое растворимость воздуха также увеличивается вдвое. Такую пропорциональность между растворимостью воздуха и его давлением отражает закон Генри*, который можно сформулировать следующим образом: при постоянной температуре парциальное давление одного из компонентов раствора в газовой фазе, находящейся в равновесии с раствором, пропорционально концентрации данного компонента в растворе (в области низкой концентрации).
Это соответствует утверждению, что растворимость газа в жидкости пропорциональна парциальному давлению данного газа.
Пример 9.5.
Распределение растворенного вещества между двумя растворителями
Если водный раствор иода взболтать с хлороформом, то большая часть иода перейдет в хлороформ. Отношение концентрации иода в этих двух фазах, называемое коэффициентом распределения, остается постоянным в области малых концентраций растворенного вещества в каждой фазе. Для иода в хлороформе и в воде при комнатной температуре этот коэффициент равен 250; отсюда следует, что при взбалтывании раствора иода в хлороформе с водой или раствора иода в воде с хлороформом при достижении равновесия концентрация иода в фазе хлороформа будет в 250 раз превышать концентрацию иода в водной фазе.
Из рассмотрения различных равновесий следует, что коэффициент распределения растворенного вещества между двумя растворителями равен отношению растворимостей данного вещества (в виде кристаллической, жидкой или газообразной фазы) в двух растворителях, если растворимости невелики.
* Закон открыт английским химиком Уильямом Генри (1775—1836).
** Атмосферный азот содержит 98,8% N2 и 1,2% Аr.
Кислород в воде
Кислород вместе с другими газами, входящими в состав воздуха, легко растворяется в воде.
Сколько же воздуха может раствориться в воде? Говорить о растворимости воздуха в целом нельзя, нужно говорить о растворимости каждой составной части воздуха в отдельности.
Кислород, азот, аргон, двуокись углерода и другие газы обладают различной растворимостью. При одинаковых температуре и давлении чистого кислорода в воде растворится почти в 2 раза больше, чем азота, а углекислого газа — в 35 раз больше, чем кислорода.
Однако существуют общие закономерности для всех газов. Чем выше температура жидкости, тем меньше растворимость газов. В литре чистой воды при нормальном атмосферном давлении, равном 760 миллиметрам ртутного столба, и при температуре 0° растворяется около 50 кубических сантиметров чистого кислорода. А при температуре 30° — примерно в 2 раза меньше. Чистого азота при температуре 0° и нормальном атмосферном давлении растворится 24 кубических сантиметра, а при температуре 30° — 14 кубических сантиметров.
Чем выше давление газа над жидкостью, тем больше его растворимость.
Если в закрытом сосуде, наполненном на одну треть водой, создать давление в 2 атмосферы, то газа растворится вдвое больше, чем при 1 атмосфере. И, наоборот: при пониженном давлении газа растворится во столько же раз меньше, во сколько ниже давление.
Два равных объема различных газов, смешанных при давлении в 1 атмосферу, растворяясь в воде, будут вести себя как два самостоятельно существующих газа, находящихся под давлением в 1/2 атмосферы. Растворимость каждого из них будет в 2 раза меньше их растворимости при нормальном атмосферном давлении.
Воздух — это смесь газов. Так как в воздухе содержится 21 процент кислорода, то его парциальное давление, то есть та часть давления, которая падает только на кислород, будет в 5 раз меньше давления воздуха. Поэтому кислорода воздуха при нормальном атмосферном давлении растворится в воде в 5 раз меньше, чем чистого кислорода при том же давлении.
В самом деле, если при нормальном давлении и при температуре 0° насытить воду не чистым кислородом, а воздухом, то в литре воды растворится только 10 кубических сантиметров кислорода вместо 50, а азота из воздуха растворится 19 кубических сантиметров вместо 24.
В воде, содержащей различные соли, растворимость газов снижается. В речной воде кислорода растворяется меньше, чем в чистой (дистиллированной), а в морской меньше, чем в речной.
Чтобы растворить газ в воде, его нужно привести в соприкосновение или перемешать с водой; чтобы вытеснить газ из воды, воду нужно подогреть. Доведя температуру воды до 100°, можно почти полностью вытеснить из нее газ.
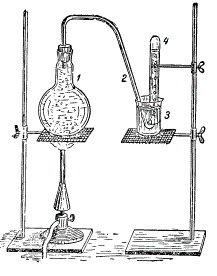
Вытеснение воздуха из воды кипячением: 1 — колба с водой; 2 — загнутая стеклянная трубка; 3 — стакан с водой; 4 — пробирка, в которую собирается вытесненный воздух
Возьмите колбу, наполненную доверху водой, закройте ее пробкой, в которую вставлена загнутая стеклянная трубка. Второй конец этой трубки вставьте в стакан с водой и наденьте на этот конец трубки наполненную водой пробирку. Доведите воду в колбе до кипения. В опрокинутой пробирке появится газ, тот самый газ, который был растворен в воде до ее кипячения.
Хотя до кипячения вода соприкасалась только с воздухом, но в силу различной растворимости кислорода и азота состав вытесненного газа будет существенно отличаться от состава обычного воздуха. В него входит 1 объем кислорода и 2 объема азота. А это означает, что в полученном газе кислорода уже не 21, как в воздухе, а 33 процента.
В обыкновенной, неочищенной воде, кроме растворенного газообразного кислорода, имеется еще кислород, входящий в состав растворенных в ней солей. Этот кислород вытеснить кипячением нельзя, так как он прочно связан с каким-нибудь другим элементом.
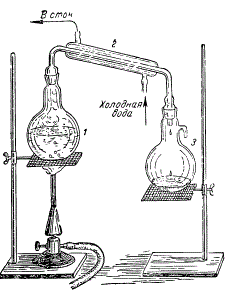
Чтобы освободить воду от солей, ее нужно перегнать.
Прибор для перегонки состоит из колбы для кипячения воды, холодильника, где конденсируются пары, и приемника, куда стекает дистиллированная вода.
Полученная таким образом вода содержит только растворенные газы, которые можно вытеснить кипячением.
Что же содержится в воде, в которой нет ни солей, ни растворенных газов?
Вода, как и всякое химическое соединение, состоит из однородных молекул.
В состав молекулы воды (Н2O) входит 2 атома водорода и 1 атом кислорода, тесно связанные между собой.
Лабораторная установка для получения дистиллированной воды: 1 — колба для кипячения воды; 2 — холодильник; 3 — приемник
Разделить, разорвать молекулу воды на ее составные части нелегко, на это нужно затратить энергию.
Молекулярный вес воды равен 18. Он состоит из 2 атомных весов водорода, равных 2 единицам, и атомного веса кислорода — 16. Следовательно, в молекуле воды содержится около 89 процентов кислорода и около 11 процентов водорода. В килограмме воды насчитывается 890 граммов кислорода.
Это означает, что все реки, моря и океаны состоят главным образом из кислорода.
Вода занимает три четверти земной поверхности.
Но в природе вода встречается не только в жидком виде. В полярных странах и на высоких горах круглый год сохраняются огромные толщи льда и снега. Большие количества воды мы встречаем в воздухе в виде пара.
Животные и растения больше чем наполовину состоят из воды. В человеческом организме, при среднем весе тела 65—70 килограммов, содержится до 40 килограммов воды.
Источник: В. Медведовский. Кислород. Государственное Издательство Детской литературы Министерства Просвещения РСФСР. Ленинград. Москва. 1953
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Растворение в жидкостях газов
Все жидкости растворяют газы, которые в растворенном (дисперсном) состоянии не оказывают существенного влияния на механические свойства жидкости. Однако, если давление в какой-либо точке объема жидкости уменьшается, газы выделяются из раствора в виде пузырьков, которые ухудшают свойства жидкости. Относительное количество газа, который может раствориться в жидкости до ее насыщения, прямо пропорционально давлению на поверхности раздела. Этот объем можно вычислить по формуле
где Vг – объем растворенного газа, отнесенный к атмосферному давлению (760 мм рт. Ст.) и нулевой температуре;
k = 
р1 и р2 – начальное и конечное давление газа, находящегося в контакте с жидкостью.
Коэффициент растворимости зависит от свойств жидкостей и газов. Воздух растворяется в минеральных маслах, применяемых в гидросистемах машин, в объеме, равном
10% (k = 0,10) объема жидкости на 1 ат.
Растворимость кислорода в жидкостях выше, чем атмосферного воздуха, ввиду чего растворенный в жидкости воздух содержит кислорода на 40—50% больше чем атмосферный воздух, что интенсифицирует окисление жидкости и разрушение резиновых деталей гидроагрегатов.
Ниже приведены коэффициенты растворимости воздуха k в распространенных жидкостях при 20 0 С
индустриальное 12 ……………….0,0759
Растворимостью примерно такого же порядка обладает и азот, который широко применяется для наддува жидкостных баков (резервуаров).
Растворимость воздуха в маслах малой вязкости несколько выше, чем в маслах высокой вязкости.
С увеличением температуры растворимость воздуха в масле практически сохраняется постоянной. Так, например, коэффициент растворимости воздуха в керосине при температуре — 30° С равен 0,12 и при температуре 20° С он повышается до 0,125.
Последний фактор следует учитывать при проектировании гидросистем, находящихся под давлением газа (воздуха) в условиях широкого температурного диапазона, поскольку в результате изменения объема растворенного газа, обусловленного его тепловым расширением, может нарушаться условие насыщенности жидкости газом.
Время, в течение которого происходит насыщение масла газом, зависит от величины поверхности раздела, приходящейся на единицу объема масла, а также от степени возмущенности состояния этой поверхности. При интенсивном перемешивании жидкость насыщается в течение одной или нескольких минут, тогда как в спокойном состоянии процесс длится часами.
Рассмотренное свойство жидкости имеет важное значение для работы гидросистемы, так как присутствие газа ухудшает, а во многих случаях может полностью нарушить работу гидросистемы и ее агрегатов. В частности, при наличии газа ускоряется наступление кавитации. Газ, выделившийся из жидкости в местах пониженного давления, может частично заполнить рабочие полости насоса, уменьшая тем самым его производительность и ухудшая режим его работы. Как показали наблюдения, при вакууме у входа в насос, равном 200—250 мм рт. ст., который образуется при определенных условиях в результате сопротивления всасывающей магистрали, наступает помутнение потока минерального масла из-за выделения воздуха; при вакууме 380—400 мм рт. ст. количество выделившегося воздуха становится таким, что резко изменяется окраска масла и образуются видимые глазом пузырьки, и при вакууме в баке 400— 450 мм рт ст. масло, поступающее но трубе из бака в насос, превращается в пену.
Книги по аквариумистике
Лучшая on-line библиотека для начинающих и профессионалов!
Растворенные в воде газы
Газы, из которых состоит воздух, мы находим в воде в других концентрациях: азот, кислород, аргон и двуокись углерода (см. таблицу па стр. 25). Газообразный азот растворяется в воде согласно физическим законам для газов. Он не участвует в химических реакциях, но принимает участие в биологических процессах. Так же пассивно ведет себя инертный газ аргон.
Кислород, необходимый для всех жизненных процессов, следует тем же физическим законам, что и азот. Кислород вступает в интенсивный биологический цикл и является газом для дыхания, всех живых существ за исключением некоторых бактерий. Двуокись углерода, напротив, участвует как в химических, так и в биологических процессах.
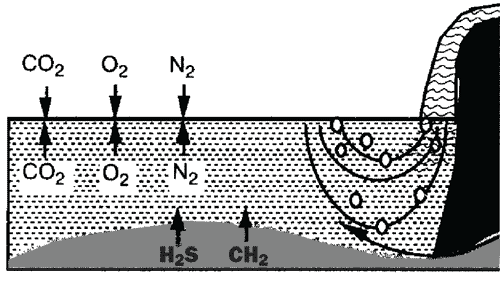
Между водой, грунтом и атмосферой происходит постоянный газовый обмен
Газообмен между водой и атмосферой происходит преимущественно на поверхности воды. Газы, такие, как CO2, выделяются из недр Земли и также поглощаются водой. Если вода вытекает из источников в земле, то она также вступает во взаимодействие с атмосферой. Вещества, имеющиеся в воде в избытке, такие, как угольная кислота, переходят в атмосферу. Другие газы, которых нет в воде или есть только в незначительном количестве, напротив, поглощаются. На поверхности воды происходит газообмен с помощью диффузии.
Концентрация определенного газа в воздухе находится в балансе с концентрацией этого же газа в жидкости. Если каким-либо образом концентрация газа в растворе становится более высокой, то на поверхности волы происходит газообмен до тех пор, пока равновесие снова не будет достигнуто. Вода, напротив, поглощает из воздуха значительные количества газов, концентрация которых в воде слишком низка. Концентрация, при которой газообмен приходит к равновесию, называется точкой насыщения. Граница раздела вода/воздух может представлять собой не только ровное водное зеркало. В частности, движение волн, быстрые течения, водопады и, прежде всего, медленно восходящие пузырьки газов приводят, как показано в таблице на стр. 25, к увеличению пограничной поверхности и, таким образом, к интенсивному газообмену в обоих направлениях. Чем быстрее вода передвигается, тем больше становится пограничная поверхность между водой и воздухом, и тем более интенсивным будет массообмен между водой и воздухом, например, в быстром потоке. Это приводит к увеличению поглощения кислорода на порядок по сравнению с поверхностью спокойного озера. Таблица на стр. 25 внизу показывает значения насыщаемости воды кислородом, азотом и двуокисью углерода. Очевидно, что содержание кислорода и азота в воде значительно ниже, чем в воздухе, в то время как двуокись углерода в этих средах имеет примерно равные концентрации. Отметим, что кислорода в воде содержится мало. Это приводит к тому, что живые существа должны предпринимать значительные усилия, чтобы поглощать его в достаточном количестве.