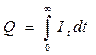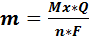при каком методе титрования используют постоянную силу тока
При каком методе титрования используют постоянную силу тока
2.3. Кулонометрический метод анализа
2.3.1. Основные законы и формулы
В основе кулонометрических методов лежат законы электролиза Фарадея.
Законы Фарадея формулируются следующим образом.
Электрохимический эквивалент – это масса вещества, выделившегося на электроде ( или растворившегося с электрода) в процессе электролиза при протекании единицы количества электричества, т. е. 1 Кл.
Суть законов Фарадея заключается в том, что для выделения одного моля эквивалента любого вещества в процессе электролиза необходимо затратить одно и то же количество электричества, называемое числом Фарадея F =96500 Кл/моль.
Где Q – количество электричества (Кл), необходимое для выделения на электроде m граммов вещества с молярной массой эквивалента, равной М / n ( М – молярная масса вещества; n – число электронов, участвующих в электродной реакции).
Где I – сила тока, А (ампер); t – время электролиза, с (секунда).
Ясно, что применение этой формулы требует, чтобы электролиз протекал со 100%-ной эффективностью тока ( или со 100%-ным выходом по току), что возможно только в отсутствие конкурирующих реакций.
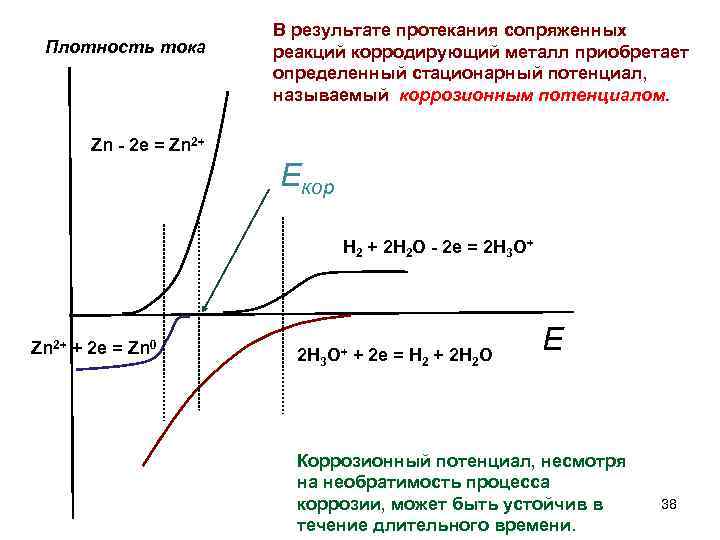
Различают два основных вида кулонометрических определений – прямую кулонометрию и кулонометрическое титрование. В методах прямой кулонометрии электрохимическому превращению непосредственно в кулонометрической ячейке подвергается анализируемое вещество. В методе кулонометрического титрования электролизу подвергается вспомогательное вещество, а далее продукт электролиза – титрант – реагирует с определяемым веществом. Кулонометрические определения могут проводиться при постоянном потенциале ( потенциостатическая кулонометрия ) и постоянной силе тока ( амперостатическая кулонометрия ). В прямой кулонометрии широко применяют потенциостатические методы. Массу определяемого вещества рассчитывают по приведенной выше формуле.
Определение точки эквивалентности можно проводить потенциометрическим, амперометрическим, спектрофотометрическим и другими методами.
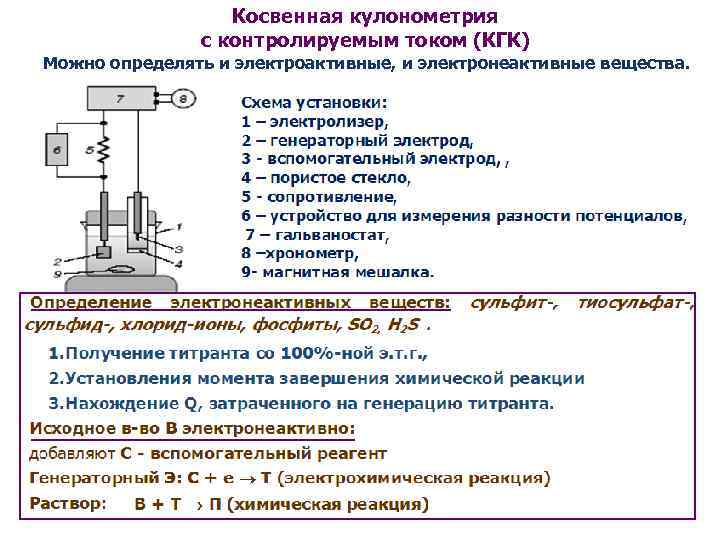
Установка для кулонометрического титрования при постоянной силе тока содержит следующие основные узлы: 1) источник постоянного тока; 2) устройство для определения количества электричества; 3) электрическую ячейку с генераторным электродом; 4) индикаторную систему для определения конца титрования; 5) хронометр для определения продолжительности электролиза.
Кулонометрия при постоянной контролируемой силе тока (кулонометрическое титрование)
Кулонометрический метод анализа
Кулонометрические методы анализа основаны на измерении количества электричества, израсходованного на электропревращение определяемого вещества.
· Теоретические основы метода
В основе кулонометрических методов лежат законы электролиза Фарадея.
Законы Фарадея формулируются следующим образом.
1. Количество электропревращенного (восстановленного или окисленного) в процессе электролиза вещества прямо пропорционально количеству прошедшего электричества.
2. Массы различных веществ, выделенных или растворенных при прохождении одного и того же количества электричества, пропорциональны их электрохимическим эквивалентам.
Электрохимический эквивалент – это масса вещества, выделившегося на электроде (или растворившегося с электрода) в процессе электролиза при протекании единицы количества электричества, т. е. 1 Кл.
Суть законов Фарадея заключается в том, что для выделения одного моля эквивалента любого вещества в процессе электролиза необходимо затратить одно и то же количество электричества, называемое числом Фарадея F=96500 Кл/моль.
m-масса выделяющегося вещества, г
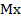
Q – количество электричества (Кл),
n – число электронов, участвующих в электродной реакции).
где I – сила тока, А (ампер);
t – время электролиза, с (секунда).
Кулонометрические методы анализа обладают существенным преимуществом перед большинством других методов анализа.
Это связано с тем, что в соответствии с уравнением (1) коэффициент пропорциональности между аналитическим сигналом (Q) и массой определяемого вещества (m) содержит только физические константы (постоянные величины). Поэтому при использовании кулонометрических определений не требуется проводить градуировку аналитического сигнала по стандартным образцам (растворы сравнения), что является необходимым условием для большинства современных физических и физико-химических методов анализа.
Кроме того, кулонометрические методы анализа обеспечивают получение результатов с лучшей воспроизводимостью, чем большинство других методов анализа при определении как малых, так и сравнительно больших содержаний; они более экспрессны и легко автоматизируются.
В методе необходимо соблюдение трех обязательных условий:
–электрохимическое превращение вещества должно протекать со 100% выходом по току, т.е. побочные электродные реакции должны отсутствовать (только при этом условии можно воспользоваться законом Фарадея для вычисления количества определяемого вещества).
-кроме 100 % выхода по току для осуществления анализа необходимо определить окончание электродной реакции в прямой кулонометрии и химической реакции в кулонометрическом титровании, а также точно измерить количество электричества, затраченного на проведение электродной реакции.
–момент завершения электрохимической реакции должен быть достаточно точно устанавливаемым;
–количество электричества, вовлечённое в электродную реакцию, должно быть точно определяемо подходящим способом.
Различают два основных вида кулонометрических определений:
– косвенную (кулонометрическое титрование).
В методах прямой кулонометрии анализируемое вещество непосредственно подвергается электрохимическому превращению в кулонометрической ячейке, т.е. определяемое вещество электороактивно.
В методах косвенной кулонометрии определяемые вещества не электроактивны и тогда в их раствор вносят такое вещество, которое способно электроокисляться или электровосстанавливаться на электродах. Продукт этих реакций способен химически количественно взаимодействовать с определяемым веществом в эквивалентных количествах и количество электричества соответственно будет также эквивалентно содержанию определяемого вещества.
По технике выполнения кулонометрический метод анализа делится на:
–потенциостатическую кулонометрию (или кулонометрию при контролируемом потенциале)
– амперостатическую кулонометрию (или кулонометрию при постоянной силе тока)
· Метод потенциостатической кулонометрии (при контролируемом потенциале электрода)
Метод состоит в проведении электролиза раствора, содержащего определяемое вещество при постоянном, заранее выбранном потенциале рабочего электрода.
В методах прямой кулонометрии электрохимическому превращению непосредственно в кулонометрической ячейке подвергается анализируемое вещество.
В прямой кулонометрии измерения обычно проводят при постоянном контролируемом потенциале, т.е. в потенциостатическом режиме. Принципиальная схема установки для потенциостатической кулонометрии приведена на рис. 1.
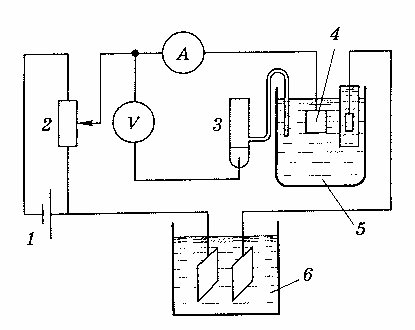
Рис. 1. Схема установки для потенциостатической кулонометрии.
3-электрод сравнения (каломельный или хлорсеребряный)
Напряжение с аккумуляторной батареи 1 через делитель напряжения 2 подается на рабочий электрод 4 кулонометрической ячейки. Потенциал электрода определяется милливольтметром или потенциометром, сила тока – амперметром. Количество израсходованного электричества измеряется кулонометром 6.
Рабочим электродом кулонометрической ячейки обычно служит платиновая пластинка или ртуть, хотя иногда используют также золотые, серебряные или графитовые электроды.
Вспомогательный электрод изготовляется из тех же материалов.
Электродные пространства рабочего и вспомогательного электродов разделены. Контакт между ними осуществляется через пористую перегородку. В качестве электрода сравнения 3 (рис. 1) обычно выбирают каломельный или хлорсеребряный.
Определение количества электричества, израсходованное на протекание электрохимической реакции, производится путем измерения тока в течение всего процесса электролиза с последующим определением величины, соответствующего площади, ограниченной осями координат i-t кривой.
Эта операция может быть выполнена автоматически с помощью электронных интеграторов тока.
кулонометра, т.е. второй электрохимической ячейки.
Известны три основных типа кулонометров:
В весовых кулонометрах (к ним относятся серебряные и медные) количество прошедшего в них электричества рассчитывается по изменению массы катода или анода. В объемных кулонометрах расчет производится на основании измерения объема получающихся веществ (газа в водородном кулонометре, жидкой ртути в ртутном кулонометре). В титрационныхкулонометрах количествоэлектричества определяется по данным титрования веществ, образующихся в растворе в результате электродной реакции.
Этиловый спирт добавляют в электролит для получения более мелкокристаллических, компактных катодных осадков и с целью предотвращения окисления медных электродов кулонометра.
О количестве прошедшего электричества судят по изменению массы катода, до и после электролиза.
Медный кулонометр для небольших токов.
В кулонометре со 100%-ным выходом протекает хорошо известная электрохимическая реакция. Измерение количества электричества сводится к определению количества вещества, полученного в результате этого процесса, и расчета количества электричества по закону Фарадея.
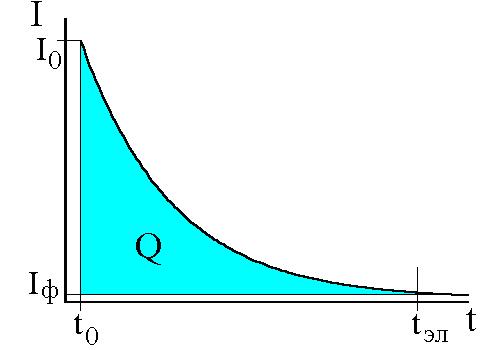
В ходе электролиза из перемешиваемого раствора ток падает со временем по экспоненциальному закону, электролиз прекращают, когда ток достигает 0,1% начального значения. В некоторых случаях, например, при большом остаточном токе применяют химические или физико-химические способы индикации. Массу определяемого вещества рассчитывают по формуле
Кулонометрия при постоянной контролируемой силе тока (кулонометрическое титрование)
Метод амперостатической кулонометрии основана получении ионов, реагигующих с анализируемым веществом (титранта), в самом титруемом растворе
При этом задача определения количества электричества упрощается и сводится к измерению времени, в течение которого достигается конечная точка титрования:
Для обеспечения 100%-ного выхода по току в электролизер вводят
1000-кратное избыточное количество вспомогательного реагента, из которого генерируют титрант, то есть вспомогательный реагент служит своего рода электрохимическим буфером, препятствующим сдвигу потенциала рабочего электрода до значений, при которых возможны побочные электрохимические реакции. При генерации титранта из воды или материала электрода 100%-ный выход по току обеспечивается автоматически.
В кулонометрическом титровании успешно используют:
-реакции комплексообразования и осаждения
Для фиксирования момента завершения химической реакции между определяемым веществом и кулонометрическим титрантом используют как визуальные (с помощью индикаторов), так и инструментальные методы индикации конечной точки титрования (потенциометрический, амперометрический, спектрофотометрический).
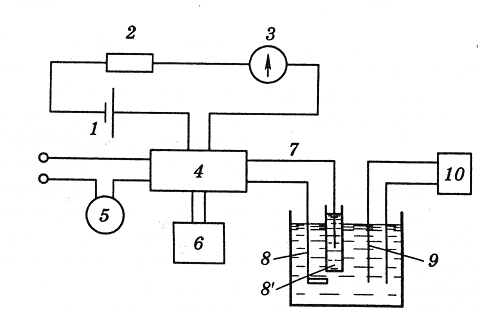
В методе кулонометрического титрования используют установки с постоянной силой тока. Так как титрант генерируется в количестве, точно эквивалентном содержанию анализируемого вещества, то по количеству электричества, израсходованного на генерацию титранта, можно рассчитать содержание определяемого вещества. Блок-схема установки для кулонометрического титрования приведена на рис. 2.
Рис. 2. Блок-схема установки для кулонометрического титрования.
Титрант генерируется в результате электролиза на электроде 8 (рабочий генераторный электрод).
Вторым электродом схемы генерации является так называемый вспомогательный электрод 8′. Его обычно изолируют от раствора анализируемого вещества, помещая в трубку с дном из пористого стекла, так как продукт реакции на вспомогательном электроде нередко мешает кулонометрическому определению.
Индикаторными электродами могут быть два платиновых электрода, если для индикации применяются амперометрический метод, или платиновый и каломельный, если используется потенциометрическая индикация, и т.д. Может быть использован также спектрофотометрический или какой-либо другой способ определения точки эквивалентности.
Дата добавления: 2020-11-29 ; просмотров: 168 ; Мы поможем в написании вашей работы!
Научная электронная библиотека
Кушхов Х Б, Адамокова М Н, Кучмезова Ф Ю,
Лабораторная работа № 4.ПРОВЕДЕНИЕ КУЛОНОМЕТРИЧЕСКИХ ИХ ИССЛЕДОВАНИЙ
Теоретические основы кулонометрии
и кулонометрического титрования
Открытый в 1834 г. Фарадеем закон, устанавливающий зависимость между количеством электричества, необходимым для электрохимического превращения вещества в процессе окисления или восстановления на электроде, и массой образовавшегося продукта, был положен в свое время в основу кулонометрии – метода электрохимического анализа, название которого связано с единицей измерения электрического заряда.
Согласно закону Фарадея, масса выделившегося на электроде вещества (g) пропорциональна суммарному количеству затраченного электричества:
где N – число молей вещества; М – молекулярная или атомная масса продукта электрохимической реакции; Q – количество электричества в кулонах; n – число электронов, участвующих в электрохимической реакции; F – число Фарадея.
Количество прошедшего электричества можно измерить, подключая кулонометр последовательно с электрохимической ячейкой, в которой проводят электролиз. Однако в аналитической практике этот способ измерения Q применяют редко. Чаще измеряют ток, а не количество электричества. Для определения Q измеряют силу тока, т.е. i = Q/t. Поскольку мгновенное значение тока равно dQ/dt, то количество электричества равно интегралу тока по времени:
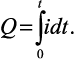
Аналитическим стандартом в кулонометрии является постоянная Фарадея. Она представляет собой произведение заряда электрона (1,602·1019 Кл) на число Авогадро (6,022·1023 мол–1) и равна 96487 Кл/моль. Измеряя силу тока или количество электричества, можно установить, какое количество вещества вступило в реакцию на электроде, если, конечно, эта реакция является стехиометрической.
С помощью формулы (2) можно оценить и чувствительность метода. Учитывая, что современные приборы позволяют измерять токи на уровне 10–9 А и ниже, кулонометрическим методом можно определять нанограммовые количества вещества.
Классификация методов кулонометрии
Среди методов кулонометрии различают прямые и косвенные. Последние известны как методы кулонометрического титрования. Для всех методов кулонометрии обязательным является условие, при котором превращение вещества на электроде должно протекать со 100 %-й эффективностью, т.е. со 100 %-м выходом по току. Иначе говоря, внешнее напряжение должно обеспечивать электролиз определяемого вещества и в то же время быть недостаточным для возникновения побочных электрохимических реакций. Это условие означает строгое выполнение пропорциональной зависимости между количеством прошедшего через ячейку электричества и суммарным количеством продукта электролиза.
Выход по току (η) представляет собой отношение количества вещества, выделившегося на электроде в процессе электролиза, к рассчитанному теоретически по закону Фарадея:
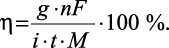
Отклонение выхода по току от 100 % может быть обусловлено протеканием побочных процессов: разложением воды, восстановлением или окислением примесей, участием материала электрода в электрохимической реакции и др. Поэтому следует подбирать такие условия электролиза (рН раствора, материал электрода, растворитель, фоновый электролит и т.п.), чтобы выход по току был близок к 100 %.
Если в прямой кулонометрии электрохимическому превращению подвергается определяемое вещество, то в методах косвенной кулонометрии определение количества вещества складывается из электрохимической и химической реакций. Определяемое вещество не участвует в реакции, протекающей на электроде. В ходе электролиза генерируется титрант, который вступает в химическую реакцию с определяемым компонентом в объеме раствора (кулонометрическое титрование с внутренней генерацией). Поэтому в косвенной кулонометрии необходимо иметь способ обнаружения момента завершения химической реакции генерированного на электроде титранта с определяемым веществом. Для установления конечной точки титрования применяют потенциометрический, амперометрический, фотометрический или другие методы.
Кулонометрические титранты в косвенной кулонометрии могут быть получены и вне анализируемого раствора (кулонометрическое титрование с внешней генерацией). В этом случае электролизу подвергают отдельный (внешний) раствор и добавляют его в раствор определяемого вещества. Реакция между ним и генерированным титрантом происходит при смешении анализируемого раствора с раствором титранта.
По технике выполнения определений электролиз можно проводить как при контролируемом потенциале (потенциостатическая кулонометрия), так и при контролируемой силе тока (гальваностатическая кулонометрия).
Содержание определяемого вещества в кулонометрии рассчитывают по величине Q, которая соответствует либо электропревращению определяемого компонента (если он элекроактивен), либо электрогенерациититранта. Последний в необходимом количестве получают на генераторном электроде из воды, растворов солей, кислот, вспомогательных реагентов, твердых электроактивных (рабочих) электродов или амальгам металлов при контролируемом токе (косвенная гальваностатическая кулонометрия), либо при контролируемом потенциале (косвенная потенциостатическая кулонометрия). Преимуществом последнего метода является селективность электродной реакции и возможность последовательной электрогенерации нескольких титрантов при соответствующих значениях потенциала.
Прямая потенциостатическая кулонометрия
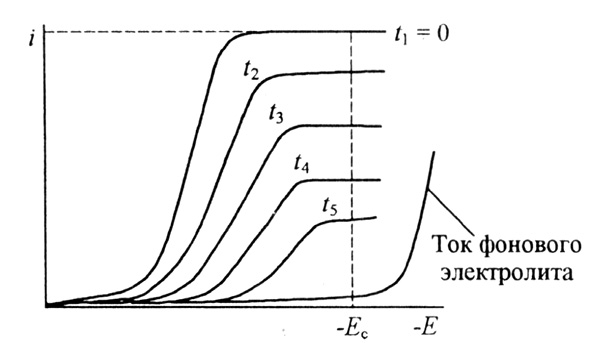
Метод основан на контроле за потенциалом рабочего электрода и на поддержании его постоянного значения в течение всего электролиза. Вследствие расхода определяемого компонента при прохождении электрического тока через ячейку его концентрация в объеме раствора непрерывно уменьшается. Это видно из серии вольтамперограмм, полученных в различное время. Постепенное уменьшение предельного тока свидетельствует об уменьшении концентрации определяемого вещества в растворе (рис. 8).
Рассмотрим электролиз вещества Ох с начальной концентрацией СО при потенциале предельного тока Ес, протекающий по схеме:
В условиях потенциостатической кулонометрии при интенсивном перемешивании ток электролиза (i) в любой момент времени определяется выражением:
где D – коэффициент диффузии Ох; С – концентрация Ох; δ – толщина диффузионного слоя; А – площадь электрода.
Величина i связана со скоростью превращения вещества Ох, dN/dt, при 100 %-й эффективности по току выражением:
где N – число молей вещества Ох в растворе.
Рис. 8. Кривые ток-потенциал раствора вещества Ох, подвергаемого электролизу различной продолжительности
Последовательность выполнения эксперимента
1. Расплавить эвтектическую смесь состава KCl – NaCl в стеклоуглеродном тигле объемом 40 мл при температуре 750 °С.
2. Включить потенциостат AutolabPGSTAT30.
3. Подключить индикаторный электрод, противоэлектрод и электрод сравнения к соответствующим разъемам на потенциостате.
4. Включить программу NOVA на ПК.
5. Провести кулонометрический анализ расплава
При каком методе титрования используют постоянную силу тока
ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА, ИХ КЛАССИФИКАЦИЯ. ПОТЕНЦИОМЕТРИЧЕСКИЙ МЕТОД АНАЛИЗА. КУЛОНОМЕТРИЯ.
В соответствии с рекомендациями ИЮПАК все электрохимические методы анализа подразделяются на две большие группы:
— методы без протекания электрохимических реакций на электродах электрохимической ячейки (кондуктометрия с использованием токов низких 50-10000 Гц и высоких частот более 1 МГЦ);
— методы с протеканием электрохимических реакций на электродах электрохимической ячейки. К ним относятся потенциометрия, кулонометрия, полярография и другие методы анализа.
Потенциометрический метод анализа основан на использовании зависимости электродвижущей силы (ЭДС) электрохимической цепи от активности (концентрации) анализируемого иона.
Зависимость электродвижущей силы Е электрохимической цепи от активности анализируемого иона описывают уравнением Нернста для цепи:
Для идеального индикаторного электрода:
Для потенциометрических измерений применяют электрохимические цепи, содержащие два электрода: индикаторный и электрод сравнения. Если оба электрода погружены в анализируемый раствор, то такая цепь называется цепью без переноса. Если электрод сравнения соединяют с анализируемым раствором через жидкостный контакт (солевой мостик), то цепь называется цепью с переносом.
В потенциометрическом анализе используют преимущественно цепи с переносом. Схематически такую цепь изображают следующим образом:
Индикаторным называют электрод, потенциал которого определяет активность анализируемого иона в соответствии с уравнением Нернста. Электродом сравнения называют электрод, потенциал которого постоянен и не зависит от концентрации ионов в растворе. Солевой мостик служит для предотвращения смешивания анализируемого раствора и раствора электрода сравнения.
В качестве солевого мостика используют насыщенные растворы солей KCl, КNО3 и других с близкими значениями подвижностей катиона и аниона. Это позволяет снизить диффузионный потенциал Едиф жидкостного соединения практически до нуля.
Электродвижущую силу Е электрохимической цепи, приведенной выше, определяют по уравнению:
Подставим в это уравнение значение Еин выраженное через уравнение Нернста, с учетом соотношения
Получаем уравнение, лежащее в основе всех потенциометрических методов анализа:
Электроды для потенциометрического анализа
В качестве индикаторных в потенциометрическом анализе применяют:
2. Электроды, на поверхности которых протекают реакции обмена иона. Их называют ионообменными, или ионоселективными электродами. Основным элементом ионоселективных электродов является ионочувствительная мембрана. Поэтому их также иногда называют мембранными.
Ионоселективные электроды изготавливают:
— с твердыми мембранами;
— со стеклянными мембранами;
— с жидкостными мембранами.
Электроды с твердыми мембранами. В таких электродах мембрана изготовлена из малорастворимого кристаллического вещества с ионным типом электрической проводимости. Конструктивно электрод представляет собой трубку диаметром около 1 см из инертного полимера (обычно поливинилхлорида), к торцу которой приклеена тонкая (
Электроды со стеклянными мембранами. Их изготавливают из специального электродного стекла, в состав которого входят оксиды алюминия, натрия, калия, бора и др. Мембрана таких электродов представляет собой тонкостенный шарик (
Электроды с жидкостными мембранами. В таких электродах жидкие мембраны, представляющие собой растворенные в органических растворителях ионообменные вещества, отделяют от анализируемого раствора гидрофобными мелкопористыми пленками, пористыми дисками или гидрофобизированными керамическими диафрагмами. Их основным недостатком является постепенное вымывание анализируемым раствором ионообменника, что сокращает срок работы электрода.
В качестве электродов сравнения в настоящее время используют хлорсеребряные электроды. Хлорсеребряный электрод представляет собой серебряную проволоку, покрытую слоем АgСl и погруженную в насыщенный раствор КС1. Современная конструкция электродов сравнения совмещает с собой и солевой мостик.
Измерение ЭДС электрохимических цепей
ВИДЫ ПОТЕНЦИОМЕТРИЧЕСКОГО АНАЛИЗА
Потенциометрические методы анализа подразделяются на два вида:
— прямая потенциометрия, или ионометрия;
Метод прямой потенциометрии основан на определении концентрации иона непосредственно по измеренной ЭДС электрохимической цепи, содержащей соответствующий ионоселективный электрод.
Расчет может быть выполнен по указанному выше уравнению Нернста, известны все параметры, входящие в это уравнение. Однако величины fан и Едиф заранее неизвестны, поэтому используют приемы, позволяющие обойти эти трудности (метод градуировочного графика и метод добавок).
В этом случае fан и Едиф остаются постоянными и график становится линейным. Затем по той же ионной силе измеряют ЭДС цепи с анализируемым раствором и по графику определяют концентрацию раствора. Пример определения приведен на рис. 1.
Рис.1. Градуировочный график для определения концентрации методом прямой потенциометрии
Рассмотрим принцип этого метода на примере единичной добавки. Для этого предварительно определяют крутизну S электродной функции применяемого ионоселективного электрода. Затем измеряют ЭДС и Ех в точно отмеренном объеме Vaн анализируемого раствора. После этого в раствор вводят точно отмеренный объем добавки Vдоб с концентрацией Сан анализируемого иона и измеряют изменение ЭДС ∆E. Если Vан >> Vдоб, то разведением раствора пренебрегают и концентрацию анализируемого раствора Сан рассчитывают по формуле:
Введение добавки при указанных условиях существенно не изменяет ионную силу раствора. Следовательно, величины Едоб и fан остаются прежними при нахождении ∆E сокращаются. Поэтому при применении метода добавок нет необходимости регулировать ионную силу раствора для поддержан постоянства Едоб и fан. Метод добавок в ионометрии используют наиболее часто и в различных его вариантах.
Ионометрия характеризуется высокой экспрессностью, достаточно высокой точностью и селективностью.
Метод нашел применение в различных областях химии, в биохимии, медицине и фармации. Этот метод рекомендуется для фармацевтического анализа Европейской фармакопеей и Государственной фармакопеей Украины.
Метод потенциометрического титрования основан на определении точки эквивалентности по резкому изменению в ней ЭДС электрохимической цепи, содержащей индикаторный электрод.
Как следует из основного уравнения потенциометрии, при резком изменении концентрации иона в точке эквивалентности происходит и резкое изменение ЭДС.
Из этого следует, что индикаторный электрод должен быть селективным к одному из реагирующих ионов титруемой системы.
В потенциометрическом титровании можно использовать все виды титрования: кислотно-основное, осадительное, комплексиметрическое и окислительно-восстановительное.
Точку эквивалентности при потенциометрических титрованиях определяют графическим методом на кривой титрования. Обычно используют одну из следующих видов кривых титрования: интегральную, дифференциальную или кривую Грана, вид которых приведен на рис. 2.
Рис. 2. Кривые потенциометрического титрования:
Интегральная кривая титрования (рис. 2, а) строится в координатах E — VТ. Точка эквивалентности находится в середине скачка титрования.
Дифференциальная кривая титрования (рис. 2, б) строится в координатах:
∆Е / ∆V- VT . Точка эквивалентности находится в вершине кривой титрования. Дифференциальная кривая титрования дает более точное определение точки эквивалентности, чем интегральная.
Метод потенциометрического титрования более точен, чем ионометрия. Его возможности существенно расширились с разработкой новых ионоселективных электродов как индикаторных. Метод применяют при анализе мутных, загрязненных и окрашенных растворов в смешанных и неводных растворителях.
Все методы потенциометрии могут быть легко автоматизированы. Промышленность выпускает ряд автоматических потенциометрических титраторов как лабораторного, так и промышленного назначений.
Количество электричества рассчитывается по формуле:
В кулонометрии различают два вида анализа:
1) прямую кулонометрию;
2) кулонометрическое титрование.
Метод прямой кулонометрии основан на непосредственном окислении или восстановлении анализируемого вещества на рабочем электроде, исключающем прохождение побочных электрохимических реакций.
Прямая кулонометрия может быть выполнена в одном из следующих режимов:
В методе прямой кулонометрии в потенциостатическом режиме сила тока в течение всего времени электролиза непрерывно уменьшается, так как происходит уменьшение концентрации анализируемого вещества. Электролиз заканчивают при уменьшении силы тока практически до нуля.
При выполнении кулонометрического анализа в амперометрическом режиме сила тока на протяжении всего времени электролиза поддерживается постоянной. Количество электричества в этом случае легко рассчитывается по уравнению:
Этот режим более экспрессный, чем потенциостатический, но его можно менять лишь в том случае, если есть возможность установить момент, а электролиз анализируемого вещества полностью завершен.
Методом прямой кулонометрии определяют ионы меди, свинца, висмута, мышьяка, урана и других металлов. Этот метод нашел применение также анализа органических соединений, в том числе и лекарственных препаратов (аскорбиновой кислоты, новокаина, пикриновой кислоты, оксихинолина и пр.).
Кулонометрическое титрование основано на электрохимическом получении титранта (электрогенерировании титранта) с последующей реакцией его с анализируемым веществом. Если титрант электрогенерируется непосредственно в растворе анализируемого вещества, то такое титрование называется кулонометрическим титрованием с внутренней генерацией. Если титрант получают электрогенерированием в отдельном сосуде, а затем подают его в анализируемый раствор, такое титрование называют кулонометрическим титрованием с внешней генерацией. Этот вид титрования используется очень редко.
Кулонометрическое титрование всегда проводят в амперостатическом режиме и применяют большие токи для электролиза, что позволяет выполнять кулонометрическое титрование экспрессно. Затраченное количество электричества на генерацию титранта будет эквивалентно содержанию анализируемого вещества в анализируемой пробе.
Рассмотрим процесс кулонометрического титрования на примере определения церия (IV). В ячейку для титрования помещают точный объем раствора церия и вводят избыток соли железа (III). В раствор погружают два плановых электрода и подсоединяют их к источнику постоянного тока.
После подачи на электроды напряжения на катоде начнут восстанавливаться ионы железа (III):
Ионы Се 4+ при этом восстанавливаться не будут, так как в растворе находится большой избыток ионов Fe 3+
Образовавшиеся ионы Fe 2+ сейчас же вступают в титриметрическую peaкцию с Се 4+ :
Се 4+ + Fe 2+ → Fe 3+ + Се 3+
Этот процесс будет продолжаться до тех пор, пока все ионы церия ( IV ) не будут оттитрованы. Момент эквивалентности определяют обычными индикаторным, потенциометрическим, амперометрическим методами.
Количество электричества, затраченное на электрогенерирование титранта в виде ионов Fe 2+ будет эквивалентно содержанию ионов церия ( IV ) в анализируемой пробе.
Кулонометрическое титрование имеет существенное преимущество перед обычным титрованием. Его применение исключает необходимость приготовления и стандартизации титранта, становится возможным применение нестойких титрантов: серебра ( I ), олова ( I I), меди ( I I), титана ( I II) и др.