при какой рабочей температуре электролита протекает электроэкстракция меди
Электролит
Состав электролита
Электролитом для электролиза меди служит водный раствор сульфата меди и серной кислоты. В растворе также содержатся примеси.
Концентрации CuSO4 и H2SO4, а также соотношение между ними имеет большое практическое значение для технологического процесса. С повышением концентрации сульфата меди до определенного предела электропроводность электролита возрастает, а с превышением этого предела начинает понижаться.
Рационально поддерживать концентрацию CuSO4 на предельно низком, но достаточном для нормального процесса электролиза, уровне. При этом решающее значение имеет плотность тока: чем выше плотность тока, тем выше должна быть концентрация CuSO4.
На растворимость медного купороса влияет концентрация содержащейся в электролите серной кислоты.
С возрастанием концентрации серной кислоты растворимость медного купороса сильно понижается.
При повышении температуры растворимость медного купороса возрастает. Так как электролит периодически охлаждается до температуры окружающей среды (в отключенных сериях и отдельных ваннах, в запасных баках и др.), концентрацию медного купороса следует поддерживать с учетом этих температурных изменений. Если концентрация медного купороса будет повышенной, то при охлаждении электролита он будет кристаллизоваться и осаждается на днищах и стенках ванн, в запасных баках, трубах и на электродах включенных ванн.
Присутствие примесей в электролите понижает растворимость медного купороса. При этом особенно большое влияние оказывает никель. Так как одна часть никеля эквивалентна 1,67 части серной кислоты, то нужно считать, что при содержании 10г Ni в 1л электролита содержание свободной H2SO4 увеличивается на 16,7г и соответственно снижается растворимость CuSO4 • 5H2O. Уменьшают растворимость медного купороса и другие примеси, имеющиеся в электролите.
Практически концентрацию CuSO4 • 5H2O следует поддерживать в зависимости от плотности тока в предела 130-160г/л.
От концентрации серной кислоты в электролите в значительной степени зависит электрическое сопротивление ванны. С повышением кислотности увеличивается электропроводность электролита, причем это продолжается до определенного предела концентрации серной кислоты. При дальнейшем повышении кислотности сопротивление электролита возрастает. Максимальная концентрация H2SO4 при температуре электролита 70єС составляет 220г/л.
При высокой кислотности электролита происходят некоторые отрицательные процессы.
Однако повышенное содержание серной кислоты в электролите экономически выгодно, так как достигающийся эффект снижения расхода электроэнергии с избытком компенсирует все отмеченные выше недостатки.
Температура электролита
Преимуществом повышенной в допустимых пределах температуры состоит в том, что электролиз может протекать нормально при более высоких плотностях тока, так как подвижность ионов возрастает. Повышенная плотность тока уменьшает отрицательное влияние высокой температуры на кристаллическую структуру катодного осадка. Следует считать, что наиболее приемлема температура в пределах 55-70єС.
ЭЛЕКТРОЭКСТРАКЦИЯ МЕДИ ИЗ СЕРНОКИСЛЫХ РАСТВОРОВ
4.1. КОМПЛЕКСНАЯ ГИДРОЭЛЕКТРОМЕТАЛЛУРГИЧЕСКАЯ ТЕХНОЛОГИЯ
Исторически сложилось таким образом, что классическая схема извлечения меди, состоящая из этапов обогащения, плавки и электрорафинирования, была применена для переработки богатых сульфидных медных и полиметаллических медьсодержащих руд. Особенностью такого вида сырья является наличие в нем драгоценных металлов. Это обстоятельство являлось решающим для использования технологии, в которой драгоценные металлы коллектируются в черновых медных анодах и извлекаются в продукт их электролитического рафинирования. Одновременно с этим имеются значительные запасы окисленных медных руд и смешанных окислено-сульфидных с невысоким содержанием меди. Такие руды тоже перерабатывались, но в значительно меньшем количестве и по упрощенной технологии, включающей выщелачивание в атмосферных условиях слабыми растворами серной кислоты с получением растворов, содержащих медь на уровне 5-10 г/л и избыточную кислоту. Затем раствор подвергался переработке с целью осаждения и обогащения по меди в той или иной форме, например, методом цементирования с использованием металлического железа или методом осаждения с использованием H2S. Полученный концентрат шел на дальнейшую переработку плавлением или электрорафинированием. Несмотря на очевидную простоту такой технологии, она имеет существенный недостаток, состоящий в том, что она не позволяет получать высококачественную медь, объем потребления которой, как видно из раздела 1, неуклонно возрастает.
Технология жидкостной экстракции явилась завоевавшей популярность альтернативой традиционному методу. В середине 1960-х годов на базе широко известного класса Cu-селективных гидроксиоксимных реагентов, используемых в аналитической химии, были впервые разработаны экстрагенты для экстракции меди в промышленных условиях. Эти экстрагенты (LIX®63, LIX®64 и LIX®65N) обладали способностью осуществлять селективный перенос меди из разбавленного раствора кислотного выщелачивания в концентрированный раствор CuSO4 (50 г/л Сu и 150-180 г/л H2SO4) с минимальным попутным извлечением Fe (основная примесь). Далее осуществляется электроэкстракция меди из раствора CuSO4, получаемого в результате реэкстракции. После извлечения кислотный рафинат поступает на выщелачивание. Сказанное поясняется схемой (рис.6).
Рис. 6. Принципиальная схема потоков технологии L-SX-EW
Согласно схеме первой ее операцией является выщелачивание исходного медьсодержащего полупродукта (окисленная руда или бедный сульфидный концентрат) растворами серной кислоты (рафинат), получаемыми с операции экстракции. Получаемый после выщелачивания медьсодержащий продукционный раствор поступает на операцию экстракции, при которой медь этого раствора выводится в экстрагент, а в водный раствор в эквивалентном количестве поступает ион водорода. Выделение меди из экстрагента осуществляется при реэкстракции отработанным электролитом электроэкстракции меди (электролит 1), в результате которой получается электролит 2 – раствор сульфата меди, направляемый на электроэкстракцию.
Схемы превращений потоков входных веществ в выходные, протекающие в этой технологии:
1. Выщелачивание (L – leaching) – растворение исходных минералов меди с получением разбавленных (5-10 г/л Cu) растворов, содержащих примеси железа, щелочноземельных металлов, марганца и прочих.
В указанных схемах вещества, обозначенные индексом оф – молекулы органического катионообменника, ионы водорода которого при экстракционном взаимодействии обмениваются на ионы меди. В результате осуществления переделов выщелачивания и экстракции-реэкстракции на электроэкстракцию поступает электролит, содержащий медь в виде CuSO4 и серную кислоту на уровне 150-180 г/л. В результате электролиза на катоде получается катодная медь, на аноде выделяется серная кислота и кислород. Выходящий раствор содержит до 30 г/л меди и 180-210 г/л H2SO4.
Анодный процесс осуществляется с использованием нерастворимых свинцовых анодов, легированных серебром или кальцием.
Входящий электролит содержит из примесей первой группы в основном железо, второй группы – мышьяк, висмут и сурьму. Он не содержит частиц твердого, и поэтому, в принципе, катодная медь получается чище, чем при ЭР. Коллоидный режим электролита – аналогичный коллоидному режиму ЭР. Лидирующей примесью является железо, содержание которого не должно превышать 1,5-2 г/л. Регулирование содержания железа в электролите осуществляется на переделе выщелачивания.
Выход по току близок к его значениям при ЭР.
Удельный расход электроэнергии вследствие протекания анодной реакции окисления воды, выше примерно на 1200-1400 кВт час/т.
Наращивание катодов ведется в течение 7 суток, как правило, используются технологии ISA или Kidd Kreck.
Дата добавления: 2015-08-05 ; просмотров: 171 ; Нарушение авторских прав
Способ электроэкстракции меди из серно-кислых электролитов
Владельцы патента RU 2246563:
Изобретение относится к цветной металлургии, в частности к электролитическому осаждению меди из сернокислых электролитов с нерастворимыми анодами. Способ электроэкстракции меди включает создание на поверхности электролита защитного слоя пены при введении в него поверхностно-активного вещества. В качестве поверхностно-активного вещества используют алкилсульфонат с концентрацией 5,5-7,5 мг/л, который вводят непосредственно в ванну совместно с циркулирующим электролитом через подвесной карман, прикрепленный к внутренней стенке ванны, обеспечивается снижение концентрации меди, никеля и серной кислоты в пробах воздуха над поверхностью электролизной ванны. 1 з.п. ф-лы, 1 табл.
Изобретение относится к области цветной металлургии, в частности к электролитическому осаждению меди из сернокислых растворов с нерастворимыми анодами. При электролизе меди с нерастворимыми анодами на аноде выделяется кислород, на катоде при глубоком обезмеживании возможно выделение водорода. Образующиеся в процессе регенерации меди газы и пары воды в виде пузырьков выделяются с зеркала ванны в атмосферу, увлекая за собой капли электролита (аэрозоли).
Содержание вредных примесей, таких как медь и серная кислота, в пробах воздуха над поверхностью ванн превышает предельно допустимые концентрации в несколько раз, а никеля в десятки раз.
Известен способ покрытия зеркала ванн регенерации тонким слоем (0,5 мм) трансформаторного масла или солидола, которые уменьшают поверхностное натяжение электролита, свободно пропуская образующиеся в ванне газы (В.Т.Исаков. Электролиз меди. Металлургия, 1970, стр.96).
Недостатки данного способа:
— загрязнение поверхности катодов трансформаторным маслом или солидолом, а также продуктами их разложения;
— накопление в электролите органических соединений, отрицательно влияющих на качество катодного осадка.
Известно использование фторорганических алифатических поверхностно-активных веществ (ПАВ), образующих пену на поверхности электролита, для подавления выделения аэрозолей при электролитическом получении меди (патент США № 4484990, кл. С 25 С 1/12, опубл. 27.11.84). Однако такой электролит использовать невозможно из-за токсичности и коррозионной активности фторорганических соединений.
Известен способ электролитической регенерации меди из сернокислых электролитов по а.с. СССР № 579348, кл. С 25 С 1/12.
Наиболее близким к изобретению по технической сущности и достигаемому результату является способ электролитической регенерации меди из сернокислых растворов, который принят в качестве прототипа (патент РФ №2075547, кл. С 25 С 1/12, опубл. 20.03.1997). Способ включает образование на поверхности электролита защитного слоя пены при введении в него в качестве поверхностно-активного вещества алкилсульфата в количестве 0,05-0,100 г/л.
К причинам, препятствующим достижению указанного ниже технического результата при использовании известного способа, относят недостаточную эффективность влияния поверхностно-активного вещества на уменьшение содержания аэрозолей в рабочей зоне над поверхностью ванны, высокую стоимость предложенного реагента, токсичность и большой расход.
Авторами настоящей заявки на изобретение создан способ электроэкстракции меди из сернокислых электролитов с достижением указанного выше технического результата.
Сущность заявляемого способа заключается в том, что на поверхности электролита создается защитный слой пены за счет введения в качестве поверхностно-активного пенообразующего вещества алкилсульфоната с концентрацией 5,5-7,5 мг/л. Алкилсульфонат вводится непосредственно в ванну регенерации совместно с циркулирующим электролитом через подвесной карман, прикрепленный к внутренней стенке ванны.
Критерием эффективности заявляемого способа является концентрация серной кислоты, меди и никеля в пробах воздуха над поверхностью электролизных ванн в рабочей зоне.
При концентрации ПАВ менее 5,5 мг/л через час на поверхности ванны образуются свободные от пены участки электролита. Плотный слой пены появляется только при концентрации 5,5 мг/л ПАВ. При этой концентрации отсутствуют свободные от пены участки, поэтому нижним пределом концентрации ПАВ является 5,5 мг/л.
При концентрации ПАВ выше 7,5 мг/л наблюдается избыточное ценообразование в баковой аппаратуре и в электролизных ваннах, ухудшается качество электроосажденной меди как по химсоставу, так и по качеству поверхности.
Введение алкилсульфоната непосредственно в ванну совместно с циркулирующим электролитом через подвесной карман, прикрепленный к внутренней стенке ванны, обеспечивает равномерное распределение ПАВ в объеме и на поверхности зеркала электролита. Выделяющиеся на электродах газообразные продукты способствуют подъему и поддержанию плотного слоя пены на поверхности электролита, заметно снижающего выделение аэрозолей компонентов электролита в воздушную среду.
В таблице приведены примеры реализации предлагаемого технического решения.
Электроэкстракцию меди проводили из электролита состава, г/л: серная кислота 150-180, медь 35-50, никель 8-15.
В каждом опыте вводили непосредственно в ванну через подвесной карман алкилсульфонат с концентрацией от 4,5 до 8,0 мг/л, добиваясь сплошного покрытия поверхности электролита ванны устойчивой пеной.
Пробы воздуха анализировали на содержание серной кислоты, меди и никеля.
Пример 6. Электроэкстракцию меди проводили при условиях примеров 1-5, но алкилсульфонат вводили с электролитом в циркуляционные баки.
Пример 7 (прототип). Электроэкстракцию меди проводили при условиях примеров 1-5, но вводили в качестве пенообразующей добавки алкилсульфат.
Как следует из данных, приведенных в таблице, содержание кислоты, меди и никеля в пробах воздуха над ваннами регенерации в несколько раз меньше, чем в прототипе. В заявленном интервале концентраций добавки содержание серной кислоты снижается в 5-6 раз, меди в 10-40 раз, никеля в 1,4-4,2 раза.
Кроме того, введение в электролит заявленных концентраций алкилсульфоната позволило уменьшить расход стандартных ПАВ: тиомочевины на 18%, желатина на 16%.
| Таблица | ||||
| № примера | Концентрация ПАВ, мг/л | Концентрация над ванной в рабочей зоне, мг/л | ||
| серная кислота | медь | никель | ||
| 1 | 4,5 | 0,2 | 0,04 | 0,03 |
| 2 | 5,5 | 0,18 | 0,03 | 0,02-0,03 |
| 3 | 6,0 | 0,15-0,02 | 0,01-0,03 | 0,01-0,02 |
| 4 | 7,5 | 0,02-0,016 | 0,01-0,008 | 0,01-0,015 |
| 5 | 8,0 | 0,02-0,03 | 0,01 | 0,015 |
| 6 | 7,5 | 2,5 | 1,8 | 0,08 |
| 7 | 1,76 | 0,2 | 0,042 |
1. Способ электроэкстракции меди из серно-кислых электролитов, включающий создание на поверхности электролита защитного слоя пены при введении в него поверхностно-активного вещества, отличающийся тем, что в качестве поверхностно-активного вещества используют алкилсульфонат с концентрацией 5,5-7,5 мг/л.
2. Способ по п.1, отличающийся тем, что алкилсульфонат вводят в ванну совместно с циркулирующим электролитом через подвесной карман, прикрепленный к внутренней стенке ванны.
Выщелачивание меди
Выщелачивание руд меди
Окисленные медные руды плохо подвергаются обогащению, поэтому их перерабатывают преимущественно гидрометаллургическими способами. Гидрометаллургические методы в металлургии меди находят также широкое применение для смешанных окисленно-сульфидных руд, при извлечении меди из рудничных отвалов, «хвостов» обогатительных фабрик и рудничных вод.
Общая схема гидрометаллургической переработки сырья состоит из трех основных операций: выщелачивания, подготовки растворов и экстракции металла из раствора. Цель выщелачивания — перевод извлекаемого металла в раствор путем обработки исходной руды тем или иным растворителем, способным достаточно полно растворять только этот металл.
В качестве растворителей при выщелачивании медьсодержащего сырья применяю разбавленную серную кислоту или подкисленные серной кислотой растворы сульфата окиси железа, а также аммиачные растворы.
Выщелачивание разбавленной серной кислотой. Разбавленная серная кислота хорошо растворяет почти все природные окисленные соединения меди (закись меди Cu 2О и самородную медь растворяет только в присутствии кислорода воздуха).
Помимо соединении меди, серная кислота при обработке ею массы руды растворяет и некоторые породообразующие минералы. К ним относятся, в первую очередь, гидраты окиси железа общей формулы Fe2О3 • /nН2О.
Интенсивное растворение железа увеличивает расход серной кислоты. К бесполезному расходу серной кислоты приводит также содержание в исходной руде карбонатов и основных солей кальция, магния, железа и др.
Следовательно, выщелачиванию серной кислотой подлежат только руды окисленной меди, не содержащие в значительных количествах растворимых в серной кислоте соединений трехвалентного железа, карбонатов и основных солей.
Разбавленная серная кислота не действует на сульфидные соединения меди, поэтому прямое сернокислотное выщелачивание руды, содержащей значительное количество медных сульфидных минералов, невыгодно.
Выщелачивание растворами Fe2(SО4 )3. Сульфат железа является растворителем для сульфидных минералов меди. При этом наиболее хорошо растворяются в сульфате так называемые вторичные сульфиды (CuS, Cu2S):
В нейтральных растворах сульфат окиси железа легко гидролизуется с выпадением в осадок гидрата или основных солей окиси железа. Чтобы воспрепятствовать этому, растворы сульфата окиси железа всегда подкисляют серной кислотой, и при этом растворяющее действие на руду оказывает уже не только сульфат, но и кислота.
Подготовка растворов меди к электролизу
Цементация железом применяется в основном для экстракции меди из бедных или сильно загрязненных растворов сернокислотного выщелачивания.
Электролиз с нерастворимыми анодами является основным методом экстракции меди, который применяют на большинстве заводов, перерабатывающих руду гидрометаллургическим способом.
Растворы, получающиеся при выщелачивании, содержат всегда целый ряд примесей (железо, хлор-ион, мышьяк, алюминий и пр.). Некоторые из них отрицательно влияют на дальнейший процесс электроэкстракции, поэтому они должны быть либо удалены, либо обезврежены.
Ликвидировать вредное действие железа можно, удалив его из раствора. Для этого раствор иногда обрабатывают дробленым известняком, который вначале нейтрализует свободную серную кислоту
а затем взаимодействует с сульфатом железа
Закисное железо предварительно окисляют в окисное пиролюзитом МnО2 или кислородом воздуха. Окисление проводят в чанах с мешалками.
Одновременно известняк осаждает также в виде труднорастворимых соединений часть алюминия, большую часть мышьяка и фосфора. Обработка растворов известняком может полностью очистить электролит от железа и большей части других примесей, но одновременно ведет к осаждению некоторого количества меди и к безвозвратным потерям серной кислоты в виде CaSO4, и п о этому применяется редко.
Однако чаще всего вредное действие железа уничтожают восстановлением окисного железа до закисного. Наличие в электролизере только одного закисного железа устраняет реакции химического растворения катодной меди и катодного восстановления железа. Снижение в этом случае выхода по току происходит только за счет обратного восстановления окисного железа, образовавшегося непосредственно в ванне на аноде. Этому стремятся воспрепятствовать, проводя электролиз с очень высокой скоростью циркуляции электролита.
Наиболее распространенным способом восстановления ионов Fe 3+ является обработка раствора цементной медью
приводящая также к удалению ионов Сl — из электролита в виде труднорастворимой полухлористой меди:
удаления иона NO3 — из раствора не существует. При наличии его обычные свинцовые аноды приходится заменять анодами, отлитыми из кремнистого сплава «Чилекс» (53% Сu, 23% Fe, 23% Si) или из плавленого магнетита.
Электролиз меди с нерастворимыми анодами
Особенностью катодного процесса является большая величина катодной поляризации вследствие низкого содержания ионов Сu 2+ в электролите. В результате, при глубоком удалении меди из раствора начинается с выделение водорода и ухудшается качество катодного осадка: он становится рыхлым. Поэтому приходится, во-первых, экстрагировать медь далеко не полностью, чтобы не допустить чрезмерного обеднения электролита в целом, и, во-вторых, применять весьма интенсивное перемешивание, чтобы предотвратить местное обеднение раствора у катода.
Анодный процесс при электроэкстракции совершенно иной, чем при электролитическом рафинировании — он проводится с нерастворимыми (преимущественно свинцовыми) анодами.
На свинцовом аноде возможны следующие реакции (кроме окисления Fe 2+ ):
В первую очередь должна идти реакция растворения металлического свинца, как обладающая наиболее отрицательным равновесным потенциалом (стандартный потенциал φРb/Рb2+ = — 0,13 в).
Это в действительности и наблюдается в первый момент электролиза с новыми свинцовыми анодами. Однако перешедшие в рас твор ионы Рb 2+ образуют с ионами SO 2- 4 нерастворимый сульфат свинца PbSO4, который отлагается на поверхности анода. Пленка PbSO4, будучи непроводником, вызывает местную солевую пассивацию анода; поэтому на свободных еще участках поверхности анода резко возрастает плотность тока, обусловливая поляризацию, приводящую к возрастанию анодного потенциала.
Увеличение потенциала анода и наличие около анода в растворе ионов Рb 2+ делает возможным протекание еще одной окислительной реакции, равновесный потенциал которой более положителен, чем потенциал растворения анода, но более отрицателен, чем потенциал выделения кислорода, а именно процесса окисления двухвалентного свинца в четырехвалентный:
Образующийся при этом в первый момент сульфат четырехвалентного свинца гидролизуется
образуя двуокись свинца.
Двуокись свинца, в свою очередь, отлагается на аноде в порах защитной пленки PbSO4, образуя прочный проводящий слой, препятствующий дальнейшему растворению анода. Вследствие этого потенциал анода еще более возрастает и достигает, наконец, потенциала выделения кислорода. С этого момента процесс выделения кислорода становится доминирующим.
Таким образом, химическая реакция, протекающая в ванне для электроэкстракции меди, аналогична реакции в регенерационной ванне:
Теоретическое напряжение разложения для этой реакции дает величину 0,89 в. Практически, благодаря катодной поляризации, значительному кислородному перенапряжению и падению напряжения в электролите, напряжение на ванне составляет 1,8—2,0 в.
Для получения приемлемых катодного выхода по току и напряжения на ванне растворы, идущие на электролиз, должны содержать не менее 20 г/л Сu и 25—35 г/л свободной H 2SO4. Если при выщелачивании получаются более бедные по меди растворы, то их перерабатывают цементацией. После выщелачивания содержание серной кислоты в богатом медью растворе обычно очень низкое, он почти нейтрален. Чтобы довести кислотность электролита до оптимальной, в него добавляют чистую серную кислоту или отработанный электролит, имеющий повышенную кислотность.
В отличие от процесса рафинирования меди температурный режим процесса электроэкстракции специально не регулируется. Поступающий в ванну электролит имеет температуру окружающей среды, отработанный раствор имеет обычно температуру на 5—10град выше.
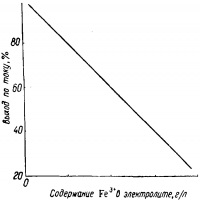
Скорость циркуляции электролита поддерживают всегда, как указывалось, очень высокой. Это приводит к тому, что в обычного размера ваннах при однокаскадной системе электролит не успевает обезмеживаться. Чтобы довести извлечение меди до нужной величины, применяют многокаскадную систему циркуляции и вытянутые по длине ванны. При этом состав электролита в разных ваннах каскада оказывается неодинаков. В наиболее тяжелых условиях работы находятся последние ванны в каскаде. В последней ванне концентрация меди обычно 12—15 г/л. Пройдя через каскад ванн, отработанный электролит, обогащенный серной кислотой, поступает на выщелачивание руды и вновь возвращается на электролиз. В процессе многократного оборачивания электролит постепенно обогащается растворенными при выщелачивании примесями, не удаляющимися в ходе обычной очистки. Поэтому часть циркулирующего электролита следует выводить из цикла. Основной примесью, определяющей отбор электролита, является железо. Содержание его в растворе допускается до 4—5 г/л.
Из отобранного электролита медь извлекают цементацией железом.
Ванны для электролиза с нерастворимыми анодами изготовляют преимущественно из железобетона, футеруют кислотоупорным асфальтом или рольным свинцом. Размеры ванн колеблются в широких пределах; обычно они имеют большую длину (до 20м).
Расстояние между анодами составляет 90—100 мм. Аноды изготовляют из свинца с добавкой сурьмы (6%), придающей им большую прочность и стойкость, или из сплава «Чилекс», реже магнетитовые. Свинцовые аноды делают сплошными или решетчатыми, в последнем случае уменьшается расход металла на изготовление анода, но возрастает анодная плотность тока, а следовательно, и расход электроэнергии. Расход анодов при электролизе составляет 0,4—1,0% от веса катодной меди.
Катодными основами служат медные листы, которые получают в ваннах с растворимыми анодами. Длительность наращивания катодов колеблется от 5 до 14 дней.
Статья на тему Выщелачивание меди
Похожие страницы:
Понравилась статья поделись ей

