при какой температуре разрушается белок в мясе
Белки и их правильная тепловая обработка: смотрим с точки зрения диетологии
Как приготовить продукты питания, чтобы организм получил достаточное количество самого необходимого для него вещества
Белки являются основной составной частью всех тканей организма и каждой его клетки. Белки пищи расходуются, прежде всего, на восстановление износившихся белковых частиц в организме и на рост новых клеток. Их невозможно заменить даже потребляемыми в значительном количестве углеводами и жирами, в то время как последние могут в значительной своей части заменяться друг другом или белком.
О цепочках аминокислот начистоту
Белки представляют собой сложные химические вещества, которые при пищеварении в кишечнике распадаются на более простые составные части — аминокислоты, всасывающиеся в кровь. Полноценными являются белки, содержащие все аминокислоты, из которых строятся белки тела человека и которые не образуются в человеческом организме. Обычно считают, что таковыми являются только белки животного происхождения. Тем не менее, советским ученым удалось доказать, что, например, белки картофеля и капусты также содержат все необходимые для организма аминокислоты. Признано, что в пищевом рационе не менее одной трети белка должно быть животного происхождения, при этом большое значение имеет разнообразие продуктов, сочетание которых обеспечивает организм всеми необходимыми аминокислотами. Так, например, сочетание гречневой каши с молоком создает наиболее благоприятный для организма аминокислотный состав; то же дает сочетание капусты, хлеба и яйца (знаменитые «бабушкины» пирожки с капустой и яйцом).
Помощь при болезнях
Здоровый взрослый человек в обычных условиях не накапливает в своем организме белка, а расходует весь белок пищевого рациона. Однако в период активного роста у подростков, при беременности, после тяжелых заболеваний, приводящих к истощению, при заживлении ран после операций организм задерживает часть белка, поступающего с пищей, используя его для нового построения тканей. В лечебном питании белок широко применяется при различных заболеваниях: так, при болезнях печени используется свойство творожного белка уменьшать вредное накопление жира в печени. Белки мяса способствуют укреплению сердечной мышцы.
Белок имеет большое значение в лечебном питании при туберкулезе, малокровии, при язвенной болезни желудка и двенадцатиперстной кишки, протекающей при явлениях истощения и витаминной недостаточности. Животный белок назначается при лечении тучности, так как он усиливает окислительные процессы в организме и тем самым способствует использованию организмом собственного жира.
Нет такого заболевания, при котором белки исключались бы полностью из пищевого рациона. При некоторых болезнях (воспаление почек и др.) применение белков резко ограничивается, но только на короткий срок. У здорового человека норма белка в пищевом рационе зависит от возраста и профессии, а у больного — от характера заболевания и состояния организма.
В детском питании норма белка колеблется от 2—2,5 до 4 г на 1 кг веса ребенка (в раннем возрасте дают наибольшее количество белка на 1 кг веса). Норма белка для взрослого не меньше 1 г на 1 кг веса; при средней физической нагрузке норма повышается до 1,5—1,8 г на 1 кг веса, т. е. до 100—110 г на день, а при тяжелом труде, требующей большого расхода сил, — до 2—2,5 г, т. е. до 140 г на день. В санаториях и домах отдыха средней нормой белка в суточном рационе считается 120— 125 г, высшей — 140—150 г. Нецелесообразно включать в рацион больше 150 г белка на длительный срок, так как это вредно отражается на нервной системе, печени, почках и на обмене веществ.
Готовим правильно!
Большое воздействие на количество и качество белков в пищевых продуктах оказывает кулинарная обработка. Для иллюстрации значения правильной кулинарной обработки для вкусовых и питательных качеств блюд приведем некоторые данные по обработке мяса.
При замораживании мяса соки выходят в межклеточные пространства; однако мышечные волокна мяса способны вновь впитать в себя эти соки, если процесс оттаивания производится постепенно. Быстрое оттаивание мяса снижает питательную ценность продукта и вкусовые свойства готовых блюд: мясо становится жестким, волокнистым и невкусным. Особенно негативно влияет оттаивание мороженого мяса в воде: потери белка становятся в 10 раз больше, чем при оттаивании мяса на воздухе, к тому же увеличиваются потери в полуфабрикатах, приготовляемых из мяса, размороженного в воде.
Потери сока, а вместе с ним и белка, достигают 10%, если мороженое мясо разрезают на небольшие куски. Таким образом, медленным оттаиванием мороженого мяса на воздухе при невысокой температуре можно в значительной мере сократить потери белка и сохранить вкусовые свойства пищи. Питательная ценность мяса снижается, а вкус блюд ухудшается, если мясо пропустить через мясорубку с тупыми ножами, так как при этом мясо не режется, а мнется и теряет сок.
Процесс перехода нерастворимых веществ в глютин начинается при температуре продукта в 70°; он быстро происходит в нежных сортах мяса (вырезка, спинная часть), в мясе молодых животных, птиц. Значительно медленнее этот процесс происходит в более грубых сортах мяса (грудинка, шея и др.) и в мясе старых животных. Жарение, т. е. тепловая обработка при температуре около 130° без воды, грубых сортов мяса приводит к тому, что коллаген высыхает, прежде чем он переходит в глютин, и поэтому усвояемость белков мяса снижается. Такие сорта мяса необходимо тушить или варить. Переход коллагена в глютин совершается более интенсивно при кислой реакции, поэтому грубые сорта мяса и особенно мясо диких животных предварительно маринуют). Не растворимые в воде вещества рыбы быстро переходят в «клей», поэтому сроки тепловой обработки рыбы по сравнению с мясом должны быть значительно сокращены.
При тепловой обработке белки мяса, рыбы, яиц денатурируются (свертываются и становятся нерастворимыми в воде), и усвояемость их повышается. Значительно возрастает также усвояемость растительных белков при тепловой обработке, так, например, белки бобовых усваиваются в 2 раза больше (от 30 до 60%). Однако излишняя тепловая обработка или неправильный температурный режим приводит к вторичной денатурации белков, и в связи с этим их усвояемость снижается.
При жарении мяса и рыбы образуются ароматические вещества, которые повышают вкусовые свойства продукта и их усвоение. Однако если температура продукта при жарении значительно превышает 130°, то в корочке образуются химические соединения, имеющие «пригорелый» запах и вкус. Длительность жарения, температурный режим, размер обжариваемых кусков влияют на качество белков, их усвояемость и продолжительность пребывания пищи в желудке.
Варка мяса и рыбы в воде сопровождается переходом в отвар экстрактивных азотистых (белковых) веществ, которые при одних заболеваниях исключаются из пищевого рациона, а при других используются для возбуждения аппетита и усиления образования пищеварительных соков.
Варка на пару приводит к меньшему «выщелачиванию», нежели варка в воде; при тушении выщелачивание ниже, чем при варке (влияет количество жидкости); варка при температуре 85-90° после закипания воды уменьшает потерю мясом сока по сравнению с варкой при слабом кипении; варка при длительном, сильном кипении приводит ко вторичной денатурации белков (влияние температурного режима).
Таким образом, строгое соблюдение технологического режима приготовления пищи является важнейшим моментом, определяющим количество и качество белков в пищевых продуктах и в связи с этим вкусовые качества пищи и ее питательную ценность.
Как жар убивает клетки
При превышении определённой температуры клетка приходит в негодность и умирает. Одно из простейших объяснений такой непереносимости жары состоит в том, что необходимые для жизни белки – те, что извлекают энергию из еды или солнечного света, обороняются от вторжений, уничтожают отходы и т.п. – часто обладают удивительно точной формой. Начинаясь как длинные нити, они затем скручиваются в виде спиралей, «заколок для волос» и других форм, диктуемых последовательностью их составных частей. И эти формы играют огромную роль в их деятельности. Но когда температура начинает расти, связи, удерживающие белковые структуры, нарушаются: сначала самые слабые, а затем и сильные. Логично, что распространяющаяся потеря белковой структуры должна быть летальной, но до последнего времени детали того, как именно это убивает перегретые клетки, были неясны.
Теперь же биофизики из Швейцарской высшей технической школы Цюриха изучили поведение каждого белка в клетках четырёх различных организмов при повышении температуры. Это исследование и богатый набор собранных данных, опубликованный в журнале Science, показали, что при температуре, достаточной для смерти клетки – человеческой, или же клетки кишечной палочки Escherichia coli – разрушаются лишь несколько ключевых белков. Более того, обилие белков в клетках оказалось неожиданным образом связанным с их стабильностью. Исследования позволили учёным бегло ознакомиться с фундаментальными правилами, по которым выстроена работа белков и их упорядочивание, и последствия которых, как стало понятно, простираются гораздо дальше простой смерти от жары.
Паола Пикотти, биофизик, руководивший работой, объяснила, что эксперименты отталкивались от старых и нерешённых вопросов: почему некоторые клетки выживают при высоких температурах, а другие – умирают? Бактерия Thermus thermophilus счастливо живёт в горячих источниках и в домашних нагревателях [при оптимальной температуре в 65 °C – прим. перев.], тогда как клетки E. coli чахнут при температурах выше 40 °C. Убедительные доказательства говорят о том, что дело тут в разной стабильности белков этих организмов. Но следить за белком, находящимся в живой клетке, что было бы идеальным методом изучения, очень неудобно. Изолирование белка в пробирке не даёт всех ответов, поскольку внутри организма белки сбиваются вместе и влияют на химию друг друга, или же поддерживают друг друга в необходимой форме. Чтобы понять, что именно и почему разваливается, необходимо наблюдать за белками в то время, когда они всё ещё влияют друг на друга.
Как тепло уничтожает белки

1) Первичная структура белков – это длинные цепочки аминокислот, объединённые в заданные генами последовательности.
2) Вторичная структура – это аминокислота, которая также свёртывается в конфигурации, удерживаемые слабыми межмолекулярными связями.
3) Третичная структура – слабые связи, стабилизирующие расположение прямых и скрученных участков трёхмерной структуры белка. Их расположение позволяет белку соединяться с нужными молекулами.
Чтобы решить поставленную задачу, команда разработала автоматизированную процедуру наблюдения. Они разрезали клетки и нагревали их содержимое поэтапно, выпуская на каждом этапе ферменты, разделявшие белки. Эти ферменты особенно хорошо разрезают развернувшиеся белки, поэтому исследователи на основе остатков разрезанных белков могли судить о том, какие белки развалились при заданной температуре. Таким образом им удалось построить денатурационные кривые для каждого из тысяч изученных белков. Дуги кривых идут от нетронутой структуры белка при комфортабельной для него температуре до полностью развёрнутого состояния при высокой температуре. Для поиска различий между кривыми разных видов живых существ, были проведены эксперименты над клетками людей, E. coli, T. thermophilus и дрожжей. «Исследование было прекрасным», – сказал Алан Драммонд [Allan Drummond], биолог из Чикагского университета, имея в виду как масштаб, так и точность процесса.
Во время наблюдений было ясно видно, что белки всех живых существ не разворачиваются все сразу при повышении температуры. «Мы увидели, что лишь небольшое подмножество белков разрушилось на самых ранних стадиях, – сказала Пикотти, – и это были ключевые белки». На диаграмме с переплетениями межбелковых связей самые хрупкие белки из этого небольшого подмножества часто обладали большим количеством связей, что означает, что они влияют на множество процессов, происходящих в клетках. «Без этих белков клетки не могут работать, – сказала Пикотти. – Когда они пропадают, вся сеть разрушается». И вместе с ней, очевидно, останавливается и жизнь клетки.
Этот парадокс – самые важные белки оказываются самыми хрупкими – может быть отражением того, как эволюция создала их для выполнения соответствующих задач. Если у белка есть множество ролей, его нестабильность и склонность к разворачиванию и повторному сворачиванию может стать преимуществом, поскольку она может позволить ему принимать разные формы, подходящие к разным задачам. «Многие из этих ключевых белков обладают большой гибкостью, что и делает их менее стабильными», но при этом наделяет их способностью связываться с различными целевыми молекулами в клетке, пояснила Пикотти. «Скорее всего, именно так они справляются со своими функциями. Это некий компромисс».
Тщательнее изучив E. coli, для которой собранные данные получились наиболее качественными, исследователи обнаружили и связь между обилием белка – количеством его копий в клетке – и его стабильностью. Чем больше копий белка делает клетка, тем больше температура требуется для его уничтожения. При этом оказывается, что большое количество копий не коррелирует с критичностью белка для выживания. Некоторые ключевые белки встречаются очень редко. Эта связь между обилием и надёжностью подтверждает идею, выдвинутую Драммонд ещё лет десять назад – у клеточной системы, изготавливающей белки, есть тенденция к тому, чтобы периодически допускать ошибки. Ошибка обычно дестабилизирует белок. Если этот белок оказывается распространённым, и такой белок в клетке появляется сотню или тысячу раз в день, тогда неправильно свернувшиеся копии, произведённые в больших количествах, могут засорить клетку. Таким образом организму выгодно было бы эволюционировать так, чтобы наиболее распространённые белки были бы и наиболее стабильными, что подтверждают полученные командой Пикотти данные.
Чтобы понять, какие качества белка делают его стабильным, исследователи сравнили данные E. coli и T. Thermophilus. Белки E. coli начали разваливаться при 40 °C, и практически полностью деградировали при 70 °C. Но при этой температуре белки T. thermophilus только начинали испытывать дискомфорт – некоторые из них держали форму и при 90 °C. Команда обнаружила, что у T. thermophilus белки обычно были короче, и некоторые типы форм и компонентов белка чаще встречались в самых стабильных из них.
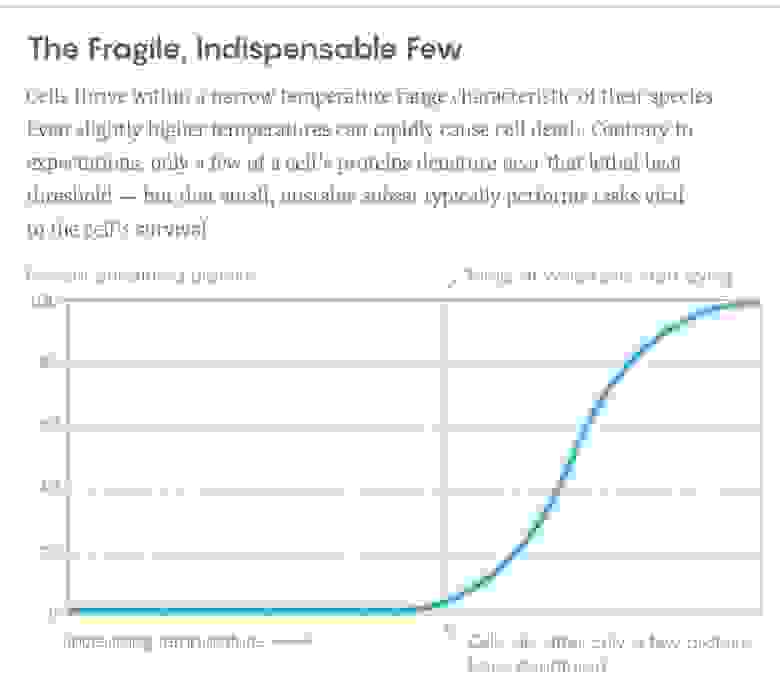
Пример кривой из эксперимента. По вертикали – процент развернувшихся белков, по горизонтали – температура. Вертикальная черта – температура, при которой клетки начинают умирать. Для этого нужно развернуться всего нескольким ключевым белкам.
Открытия могут помочь исследователям разработать белки, чья стабильность подстроена под их задачи. Во многих промышленных процессах, где используются бактерии, повышение температуры повышает и отдачу – но довольно скоро бактерии начинают умирать от жары. Было бы интересно узнать, сможем ли мы стабилизировать бактерии, сделав ключевые белки более устойчивыми к температуре – сказала Пикотти.
Обилие информации по поводу того, насколько легко разворачиваются определённые белки, сильно порадовало некоторых биологов. От стабильности белка напрямую зависит вероятность его агрегации: появления комков неразвернувшихся белков, прилипающих друг к другу. Агрегаты белков могут обернуться кошмаром для клеток и мешать выполнению главных задач. К примеру, их обвиняют в появлении некоторых серьёзных неврологических проблем, таких, как болезнь Альцгеймера, при которой бляшки развернувшихся белков засоряют мозг.

Паола Пикотти
Но это не значит, что агрегация происходит только у организмов, страдающих определёнными заболеваниями. Наоборот, исследователи поняли, что возможно, она происходит постоянно, и что у здоровых клеток есть методы, при помощи которых они справляются с нею. «Я думаю, что всё чаще это явление признаётся очень распространённым», – сказал Микель Вендрусколо [Michele Vendruscolo], биохимик из Кембриджского университета. «Большинство белков неправильно сворачиваются и агрегируют внутри клеток. Самое важное, что установила команда Пикотти, это тот отрезок времени, в котором какой-либо выбранный белок находится в развёрнутом состоянии. Это время определяет степень возможной агрегации белка». Некоторые белки почти никогда не разворачиваются и не агрегируют, другие ведут себя так в определённых условиях, а иные делают так постоянно. По словам биохимика, детальное описание белков в новой работе сильно облегчит изучение и понимание этих различий между белками. Некоторые из денатурационных кривых говорят о том, что их белки агрегируют после того, как развернулись. «У них получилось отследить оба этапа – как развёртывание, так и последующую агрегацию, – сказал Вендрусколо. – В этом вся прелесть этого исследования».
И хотя многие учёные интересуются агрегатами из-за наносимого ими ущерба, некоторые смотрят на это явление с другой точки зрения. Драммонд говорит, что становится ясным, что некоторые агрегаты – это не просто кусочки мусора, болтающиеся в клетке. Они содержат активные белки, продолжающие выполнять свои функции.
Представьте, что вы издалека видите дым, поднимающийся из какого-либо здания, говорит Драммонд. Вокруг здания вы видите некие фигуры, и вы представляете себе, что это тела, извлечённые из руин. Но если вы подойдёте ближе, вы можете обнаружить, что это живые люди, спасшиеся из горящего здания, ждущие, пока происшествие закончится. Так получается с исследованием агрегатов, говорит Драммонд: исследователи обнаруживают, что белки в агрегатах оказываются не жертвами, а выжившими. «Сейчас вообще появляется новая область науки, растущая взрывными темпами», – говорит он.
Комкование белков может оказаться не признаком повреждений, а способом для белка сохранять свои функции в сложной ситуации. Оно может, к примеру, защищать их от окружающей среды. А когда условия улучшаются, белки могут покидать агрегаты и сворачиваться заново. «Их форма меняется в зависимости от температуры таким образом, что на первый взгляд это кажется неправильным сворачиванием, – говорит Драммонд. – Но в этом есть какой-то иной смысл». В статье в журнале Cell от 2015 года он с коллегами определил 177 белков дрожжей, сохранивших свои функции уже после попадания в агрегаты. В работе, вышедшей в марте, эта команда описала, что если изменить один из белков так, чтобы он не смог агрегировать, то это приводит к серьёзным проблемам в функционировании клетки.
В общем и целом, работа утверждает, что белки – удивительно динамичные структуры. Сначала они могут показаться жёсткими машинами, работающими над зафиксированными задачами, для которых подходит одна определённая форма. Но на самом деле белки могут принимать несколько различных форм во время своей нормальной работы. И в нужное время их форма может меняться так сильно, что может показаться, будто они портятся, хотя на самом деле они наоборот укрепляются. На молекулярном уровне жизнь может представлять собой постоянные соединения и разъединения связей.
ИЗМЕНЕНИЕ ПИЩЕВЫХ ПРОДУКТОВ ПРИ ТЕПЛОВОЙ ОБРАБОТКЕ
БЕЛКИ
При температуре 70 С происходит коагуляция ( свертывание ) белков. Они теряют способность удерживать воду ( набухать ), т.е. из гидрофильных становятся гидрофобными, при этом уменьшается масса мяса, рыбы и птицы. Частично разрушается третичная и вторичная структура белковых молекул, часть белков превращается в полипептидные цепочки, что способствует лучшему их расщеплению протеазами желудочно-кишечного тракта.
Белки, находящиеся в продуктах в виде раствора, при варке свертываются хлопьями и образуют пену на поверхности бульона. Коллаген и эластин соединительной ткани превращаются в глютин ( желатин ). Общие потери белка при тепловой обработке составляют от 2 до 7%.
Превышение температуры и времени обработки способствует уплотнению мышечных волокон и ухудшению консистенции изделий, особенно приготовленных из печени, сердца и морепродуктов. При сильном нагреве на поверхности продукта происходит деструкция крахмала, и идут реакции между сахарами и аминокислотами с образованием меланоидов, которые придают корочке темный цвет, специфический аромат и вкус.
Мясопродукты при варке и жаренье в результате уплотнения белков, плавления жира и перехода в окружающую среду влаги и растворимых веществ теряют до 30-40% массы. Наименьшие потери свойственны панированным изделиям из котлетной массы, так как выпрессованная белками влага удерживается наполнителем ( хлебом ), а слой панировки препятствует ее испарению с обжариваемой поверхности.
ЖИРЫ
При нагреве жир из продуктов вытапливается. Пищевая ценность его снижается из-за распада жирных кислот. Так, потери линолевой и арахидоновой кислот составляют 20-40%. При варке до 40% жира переходит в бульон, часть его эмульгирует и окисляется. Под действием содержащихся в бульоне кислот и солей эмульгированный жир легко разлагается на глицерин и жирные кислоты, которые делают бульон мутным, придают ему неприятный вкус и запах. В связи с этим варить бульон следует при умеренном кипении, а скапливающийся на поверхности жир надо периодически удалять.
Глубокие изменения жира происходят при жаренье. Если температура сковороды превышает 180 С, то жир распадается с образованием дыма, при этом резко ухудшаются вкусовые качества продуктов. Жарить продукты следует при температуре на 5-10 С ниже температуры дымообразования.
При жаренье основным способом жир теряется за счет его разбрызгивания. Это связано с бурным испарением воды при нагревании жира более 100 С. Потери жира при разбрызгивании называются угаром, и они значительные у жиров, в состав которых входит много воды ( маргарин ), а также при жаренье увлажненных продуктов ( сырой картофель, мясо и др. ). Общие потери жира меньше у панировочных изделий.
Самые значительные химические изменения жиров наблюдаются при жаренье во фритюре. В результате гидролиза, окисления и полимеризации накапливаются вредные соединения, придающие жиру неприятный запах и прогорклый вкус. Токсические продукты термического окисления жиров ( альдегиды и кетоны ) адсорбируются на поверхности обжариваемых изделий. Кроме того, жир загрязняется частицами попадающего в него продукта.
Для предупреждения нежелательных изменений жира используют фритюрницы, в нижней части которых имеется так называемая холодная зона, где температура жира значительно ниже, и попадающие туда частицы продукта не сгорают. Для предохранения фритюра от порчи используют ряд технологических приемов: фритюр периодически процеживают, руки и инвентарь смазывают растительным маслом, предназначенные для жаренья во фритюре изделия не панируют в сухарях.
При какой температуре разрушается белок в мясе

Денатурацию пищевого белка мы видим во время готовки яичницы или жарки мяса. И это не уменьшает их пищевую ценность, а наоборот позволяет легче и эффективнее усваиваться. На примере яиц, если мы не будем их варить или жарить, а съедим сырыми, то они подвергнутся тому же самому разрушению молекулярных связей уже в нашем желудке за счет пищеварительных ферментов.
А вот с витаминами и минералами все немного сложнее, так как они при температурном воздействии легко разрушаются.
Но протеин мы пьем не ради витаминов, а ради содержащихся в нем аминокислот, с которыми ничего плохого не происходит и качество их усвоения и ценность не теряется.
Идея, что с протеином что-то может быть не так под влиянием температуры, возникла в попытке сделать с помощью протеина и кипятка протеиновый чай. Получалось что-то невнятное.
Происходило это из-за того, что сывороточный белок (самый популярный вид исходного сырья для высокобелковых смесей) под влиянием температуры сворачивается. Этот процесс называется коагуляцией.
Воздействие высокой температуры приводит к образованию нерастворимого коллоидного фосфата кальция, который выпадает в осадок. И получается пенка на молоке вместо протеинового чая.
Но вся эта технология прекрасно используется в сыроварении и нисколько не мешает нам наслаждаться этим вкусным продуктом. Поэтому протеиновый горячий чай пить можно, но не нужно.
А выпекать блины и кексы с протеином нужно!
Изменение белковых веществ в пищевых продуктах при тепловой обработке
Правильно проведенная тепловая обработка, как правило, повышает пищевую ценность продуктов питания в результате улучшения их вкусовых качеств и усвояемости. Кроме того, тепловое воздействие обеспечивает санитарное благополучие пищи.
Для рекомендации наиболее целесообразного способа тепловой обработки того или иного продукта и получения готового кулинарного изделия с заданными свойствами необходимо знать, какие физико-химические изменения протекают в продуктах.
Однако поскольку пищевые продукты являются сложными композициями, состоящими из многих веществ (белки, жиры, углеводы, витамины и др.), целесообразно предварительно рассмотреть изменения каждого из них в отдельности.
Изменения белковых веществ
При тепловой обработке продуктов входящие в их состав белковые системы подвергаются различным изменениям.
Нарушение нативной вторичной и третичной структур белков носит название «денатурации белков». Денатурация белков может произойти вследствие нагревания, механического воздействия (при взбивании), увеличения концентрации солей в системе (при замораживании, посоле, сушке продуктов) и некоторых других факторов.
Глубина нарушения структуры белков зависит от интенсивности воздействия различных факторов, возможности одновременного действия нескольких из них, концентрации белков в системе, pH среды, влияния различных добавок.
Денатурация белков влечет за собой изменение их гидратационных свойств — водосвязывающей способности, которая определяет вкусовые качества готовых изделий.
При денатурации растворимых белков их водосвязывающая способность понижается в разной степени, что зависит от глубины денатурационных изменений. Правильное регулирование факторов, определяющих денатурацию и гидратационные свойства белков при технологическом процессе, позволяет получать кулинарные изделия высокого качества.
Так, на практике часто используют зависимость денатурации и водосвязывающей способности белков от pH среды. Денатурация мышечных белков мяса и рыбы при pH среды, близком к изоэлектрической точке, происходит при более низких температурах и сопровождается значительной потерей воды.
Поэтому путем подкисления белковых систем при некоторых способах обработки рыбы и мяса (маринование и др.) создают условия для снижения глубины денатурации белков при тепловой обработке.
Одновременно кислая среда способствует денатурации и дезагрегаций соединительнотканого белка коллагена и образованию продуктов с повышенной влагоудерживающей способностью. В результате сокращается время тепловой обработки продуктов, а готовые изделия приобретают сочность и хороший вкус.
При денатурации изменяется также физическое состояние белковых систем, которое обычно определяют термином «свертывание белков». Свертывание различных белковых систем имеет свою специфику.
В одних случаях свернувшиеся белки выделяются из системы в виде хлопьев или сгустков (образование пены при варке бульонов, варенья), в других — происходит уплотнение белковой системы с выпрессовыванием из нее части воды вместе с растворенными в ней веществами (производство творога из простокваши) или увеличение прочности системы без уплотнения и выделения влаги (свертывание яичных белков).
Наряду с физическими изменениями при нагревании белковых систем происходят сложные химические изменения в самих белках и во взаимодействующих с ними веществах.
Белки овощей и фруктов
Количество белковых веществ в овощах и фруктах не превышает 2—2,5%. Белки являются основными структурными элементами цитоплазмы, ее органоидов и ядер растительных клеток.
При тепловой обработке белки цитоплазмы свертываются и образуют хлопья; клеточная мембранная структура разрушается. Ее разрушение способствует диффузии растворенных в клеточном соке веществ в бульон или другую жидкость, в которой овощи подвергались тепловой обработке или хранились, и проникновению в них веществ, растворенных в бульоне или другой жидкости.
Белки зерномучных продуктов
Горох, фасоль, чечевица содержат около 20—23% белковых веществ, соя — 30%. В крупах их количество достигает 11%, а в пшеничной муке высшего и первого сортов— 10—12%.
В зерномучных продуктах белки находятся в обезвоженном состоянии, поэтому при замачивании зернобобовых, варке круп или замешивании теста они способны поглощать влагу и набухать.
При нагревании до 50—70° С набухшие белки свертываются и выпрессовывают часть поглощенной влаги, которая связывается клейстеризующимся крахмалом.
Используемое в кулинарной практике пассерование пшеничной муки с жиром или без него при температуре 120° С и выше оказывает влияние па содержащиеся в ней белки, которые денатурируются и утрачивают способность к набуханию и образованию клейковины.
Белки куриного яйца
Яичный белок содержит 11 —12% белковых веществ, желток—15—16%. При температуре 50—55° С яичный белок начинает свертываться, что проявляется в виде местных помутнений, которые при дальнейшем повышении температуры распространяются на весь объем; по достижении 80° С свернувшийся белок сохраняет свою форму.
Дальнейший нагрев увеличивает прочность белковой системы, и особенно заметно в интервале температур от 80 до 85° С. По достижении 95— 100° С прочность белка с течением времени изменяется незначительно.
Яичный желток свертывается при более высоких температурах. Для увеличения его вязкости желток необходимо нагреть до 70°С.
Смесь белка с желтком проявляет себя, аналогично желтку. Свернувшийся белок, желток или их смесь удерживает влагу в связанном состоянии и не выпрессовывает ее. Характер свертывания яичных белков не изменяется, если их разбавить некоторым количеством воды и смесь тщательно перемешать, однако механическая прочность системы понижается.
Способность яичных белков связывать при свертывании влагу используют в кулинарной практике. Добавление к белкам яиц, воды или молока при изготовлении омлетов позволяет понижать механическую прочность белковых систем и получать кулинарные изделия с более нежным вкусом, чем изделия из натуральных яиц.
Механические свойства свернувшихся яичных белков используют также для структирования (связи) некоторых кулинарных изделий (овощные котлеты и др.).
Белки молока
Основными белками молока являются казеин (2,3—3,0%), лактальбумин (0,5—1,0%) и лактоглобулин (0,1%).
При нагревании молока с нормальной кислотностью заметные изменения наблюдаются только с альбумином, который свертывается и осаждается в виде хлопьев на стенках посуды. Процесс начинается при температуре 60° С и заканчивается практически при 85° С.
Нагревание молока фактически не оказывает влияния на растворимость казеина: лишь небольшое количество его в нерастворимой форме присутствует в образующейся на молоке пенке. В сквашенном молоке нагревание вызывает свертывание казеина и разделение системы на две фракции: творог (свернувшийся казеин) и сыворотку.
Казеин свертывается также при нагревании молока с повышенной кислотностью. Творог при нагревании выделяет часть влаги. Для связи ее в кулинарные изделия из творога добавляют крупу или муку.
Белки мяса, птицы, рыбы
Технологическая обработка указанных продуктов в значительной степени обусловлена морфологическим строением и составом их белковых систем.
Особенности строения и состава мышечной ткани. Основную массу перерабатываемого в кулинарной практике мяса составляет скелетная мускулатура. Отдельные скелетные мышцы состоят из мышечных волокон, соединенных в единое целое соединительноткаными прослойками.
Мышечное волокно представляет собой специализированную сократительную клетку, длина которой может достигать 12 см и более, а толщина до 120 мм. Содержимое волокна состоит из двух частей: жидкой (гомогенной) — саркоплазмы и студенистой (в виде студнеобразных нитей)—миофибрилл. Снаружи волокно покрыто оболочкой — сарколеммой (рис. 3).
В мышцах волокна собраны в пучки: первичные, состоящие из мышечных волокон; вторичные, состоящие из первичных пучков; пучки высшего порядка, которые составляют мышцу.
Белки, входящие в состав мышечных волокон мяса, птицы, рыбы, называются мышечными. Часть из них в жидком состоянии содержится в саркоплазме, в том числе белок миоглобин, который окрашивает мясо в красный цвет, часть в студнеобразном состоянии входит в состав миофибрилл. Содержание белков в некоторых мясных и рыбных продуктах приведено в табл. 12.
Мясо баранины (1-й категории) и свинины за счет повышенного количества жира содержит относительно меньше белков, чем говядина.
Мышечные белки имеют высокую биологическую ценность: соотношение незаменимых аминокислот в них близко к оптимальному. Содержание мышечных белков в скелетной мускулатуре крупного рогатого скота 1-й категории составляет в среднем 13,4% с колебаниями от 6,1 до 14,3% в различных частях туши (рис. 4).

1 — миофибрилла; 2 — саркоплазма; 3 — ядро 
Соединительная ткань мышцы называется мизием. Та ее часть, которая соединяет мышечные волокна в первичных пучках, называется эндомизием, объединяющая пучки мышечных волокон между собой — пер им из и ем, а наружная оболочка мышцы — эпимизием
Важными компонентами соединительной ткани являются фибриллярные белки — коллаген и эластин.
Посредством рентгеноструктурного анализа установлено, что молекула коллагена состоит из трех полипептидных цепочек (триплет), скрученных вместе вокруг общей оси.
Прочность тройной спирали обусловлена главным образом водородными связями. Отдельные молекулы коллагена и эластина образуют волокна. В свою очередь, пучки коллагеновых и эластиновых волокон совместно с веществом, объединяющим их в единое целое и состоящим из белково-полисахаридного комплекса, образуют пленки эндомизия и перимизия.

Строение эндомизия практически не зависит от сократительной способности мышцы и характера выполняемой ею работы. Входящий в его состав коллаген образует очень тонкие и слегка волнистые волокна. Эластин в эндомизии развит слабо.
На строение перимизия большое влияние оказывает характер выполняемой мышцами работы. В мускулах, которые при жизни животного испытывали небольшие нагрузки, перимизий по строению близок к эндомизию.
Перимизий мускулатуры, выполняющей тяжелую работу, имеет более сложное строение: увеличено количество эластиновых волокон, коллагеновые пучки толще, в перимизии некоторых мышц волокна перекрещены и образуют сложное ячеистое плетение. В мышцах увеличено процентное содержание соединительной ткани.

Таким-образом, соединительная ткань эндомизия и перимизия образует своеобразный остов или каркас мышечной ткани, в который включены мышечные волокна. Характер этого остова и определяет механические свойства, или, как принято говорить, «жесткость» или «нежность» мяса.
Содержание и характер строения соединительной ткани обусловливают тот или иной способ обработки мяса.
В среднем большая часть мускулатуры крупного скота содержит от 2 до 2,9% коллагена, однако количество его в различных частях туши весьма неодинаково (рис. 6).

У мелкого скота различие в строении перимизия у разных частей туши выражено в значительно меньшей степени, чем у крупного скота, и, кроме того, перимизий имеет более простое строение. К особенностям анатомического строения мускульной ткани птицы следует отнести невысокое содержание и лабильность соединительной ткани.
Мышечная ткань рыбы также состоит из мышечных волокон и соединительной ткани, но имеет свои особенности. Мышечные волокна у нее объединены перимизием в зигзагообразные миокомы, которые с помощью соединительнотканых прослоек (септ) формируют продольные мышцы тела. Септы бывают поперечными и продольными (рис. 7).
Подобно мышечной ткани теплокровных животных, мускулатура рыб, имеющая повышенную нагрузку (мышцы, прилегающие к голове и хвосту), содержит более развитую соединительную ткань, однако вследствие ее невысокой прочности рыбу при разделке делят по сортам и кулинарному назначению, как это принято для мяса убойных животных. Основным белком соединительной ткани рыб является коллаген (от 1,6 до 5,1%), эластина в ней очень мало.
Помимо мышечной ткани, коллаген в значительных количествах входит в состав органического вещества хрящей, костей, кожи и чешуи. Так, его содержание в костях достигает 10—20%, в сухожилиях —25—35 %. Коллаген, содержащийся в костях, называется оссеином.
Как белок, коллаген имеет низкую биологическую ценность, так как практически лишен триптофана и содержит очень мало метионина; в его составе преобладают гликокол, пролин и оксипролин.
Основными компонентами мяса разных видов животных являются (в %): вода —48—80, белки—15—22, жиры—1—37, экстрактивные вещества—1,5—2,8 и минеральные вещества — 0,7—1,5.
Количество воды зависит от возраста животного и содержания в мясе жира. Чем моложе животное и чем меньше в его мясе жира, тем больше в мышцах влаги.
Большая часть влаги (около 70%) связана в мышцах с белками миофибрилл. Меньшее количество влаги с растворенными в ней белками, экстрактивными и минеральными веществами содержит саркоплазма мышечных волокон. Некоторое количество влаги содержится в межклеточных полостях мышечной ткани.
Экстрактивные вещества являются продуктами метаболизма. Они состоят из аминокислот, дипептидов, глюкозы, некоторых органических кислот и др. Экстрактивные вещества и продукты их превращения участвуют в создании свойственного мясу вкуса и аромата.

Так, растворы глутаминовой кислоты и ее солей обладают мясным вкусом, поэтому глутамат натрия используют в качестве одного из компонентов сухих супов, соусов и других концентратов. Такие аминокислоты, как серии, аланин, глицин, имеют сладкий вкус, лейцин — слегка горьковатый и т. д.
При нагревании экстрактивные вещества подвергаются раз личным химическим изменениям — реакциям меланоидинообразования, окисления, гидролитическому расщеплению и др. Образующиеся при этом вещества также принято рассматривать как экстрактивные: их вкус, запах и цвет оказывают влияние на органолептические показатели, готовой продукции.
Экстрактивные вещества мышечной ткани рыбы значительно отличаются по составу от экстрактивных веществ мяса. В ней мало глутаминовой кислоты и больше гистидина, фенилаланина, триптофана, цистина и цистеина. Принято считать, что вкус и запах рыбы обусловлены главным образом азотистыми основниями экстрактивных веществ, которых особенно много в морской рыбе и мало или совершенно не содержится в мясе наземных животных.
Среди минеральных веществ мышечной ткани наземных животных и рыбы значительный удельный вес приходится на соли натрии, калия, кальции и магния.
Изменение белков при тепловой обработке
При тепловой обработке мышечные и соединительнотканые белки претерпевают значительные изменения.
Мышечные белки мяса и рыбы начинают денатурироваться и свертываться при температуре около 40° С. При этом содержимое мышечных волокон уплотняется, так как из них выделяется влага с растворенными в ней минеральными, экстрактивными веществами и неденатурированными при данной температуре растворимыми белками.
Выделение влаги и уплотнение мышечных волокон увеличивает их прочность: они труднее режутся и разжевываются.
Если мясо или рыбу нагревают в воде, то перешедшие в нее белки по достижении соответствующих температур денатурируются и свертываются в виде хлопьев, образуя так называемую пену.
Около 90% растворимых белков мяса и рыбы денатурируется при температурах 60—65° С. При этих температурах диаметр мышечных волокон в говядине сокращается на 12—16% от первоначальной величины. Последующее повышение темпера туры влечет за собой дополнительные потери влаги, уплотнение мышечных волокон и повышение их прочности.
При тепловой обработке мяса происходит денатурация белка миоглобина, который определяет окраску мяса. Денатурация миоглобина сопровождается изменением цвета мышечной ткани, что позволяет косвенно судить о кулинарной готовности мяса.
Красную окраску мясо сохраняет при температуре до 60° С, при 60—70° С оно окрашивается в розовый цвет, а при 70—80° С становится серым. Доведенное до кулинарной готовности мясо сохраняет серый цвет или приобретает коричневую окраску.
Нагревание соединительной ткани вызывает дезагрегацию содержащегося в ней коллагена и изменяет структуру самой ткани. Начальным этапом этого процесса является денатурация коллагена и нарушение фибриллярной структуры белка, которые определяют термином «сваривание коллагена».
Температура денатурации или сваривания коллагена тем выше, чем больше в нем содержится пролина и оксипролина. Для мяса сваривание наблюдается при температуре около 65° С, для рыбы —около 40° С.
При этих температурах происходит частичный разрыв поперечных связей между полипептидными цепочками молекул фибриллярного белка. В результате цепи сокращаются и принимают энергетически более выгодное свернутое положение.
В выделенных из соединительной ткани коллагеновых волокнах сваривание коллагена происходит при определенных температурах и имеет характер скачка. В пленках перимизия сваривание коллагена растянуто в температурном интервале. Процесс начинается при указанных выше температурах и заканчивается при более высоких, причем температура тем выше, чем сложнее строение соединительной ткани.
Изменения на молекулярном уровне влекут за собой изменения структуры коллагеновых волокон и соединительнотканых прослоек. Волокна коллагена деформируются, изгибаются, длина их сокращается и они становятся более эластичными и прозрачно-стекловидными.
Изменяется и структура самих соединительнотканых прослоек: они также деформируются, увеличиваются в толщину, становятся более эластичными и прозрачно-стекловидными.
Сваривание коллагена сопровождается поглощением им некоторого количества влаги и увеличением объема соединительнотканых прослоек. Сжатие соединительнотканых прослоек в значительной степени способствует выпрессовыванию из мышечной ткани жидкости, выделяемой при денатурации и свертывании мышечных белков.
При дальнейшем нагреве соединительной ткани происходит частичный или полный разрыв поперечных связей между поли пептидными цепочками денатурированного коллагена, при этом часть из них переходит в бульон, образуя раствор желатина; структура соединительнотканых прослоек в значительной степени нарушается, а прочность их снижается.
Ослабление прочности перимизия является одним из факторов, определяющих готовность мяса. Мясо, достигшее готовности, не должно оказывать значительного сопротивления разрезанию или раскусыванию его вдоль мышечных волокон.
Подобно температуре сваривания, скорость дезагрегации коллагена зависит от строения перимизия. Так, за 20 мин варки в поясничной мышце, перимизий которой слабо развит, дезагрегировалось и перешло в бульон 12,9% коллагена, а в грудной мышце с более грубым перимизием при тех же условиях дезагрегировалось только 3,3% коллагена.
За 60 мин варки эти цифры увеличились: для поясничной мышцы до 48,3%, для грудной— лишь до 17,1 Незначительное влияние на скорость дезагрегации коллагена и размягчение перимизия оказывает температура, при которой осуществляется процесс тепловой обработки.
Например, при варке плечевой мышцы при температуре 120° С (в автоклаве) количество дезагрегированного коллагена вдвое превышает содержание его в аналогичной мышце, которая варилась обычным способом при температуре 100° С.
Однако необходимо заметить, что при увеличении температуры варки одновременно с сокращением срока тепловой обработки происходит излишнее уплотнение мышечных белков, что отрицательно сказывается на консистенции и вкусе мяса.
При использовании для жаренья мышц со сложным перимизнем мясо обрабатывают кислотами (маринование) или ферментными препаратами. Для маринования обычно используют лимонную или уксусную кислоту. В маринованном мясе заметно ускоряются дезагрегация коллагена и ослабление перимизия.
Жареные изделия получаются сочными, с хорошим вкусом.
В качестве размягчителей мяса успешно используются протеолитические ферменты растительного, животного и микробиального происхождения: фицин (из инжира), папаин (из дынного дерева), трипсин (животного происхождения) и др.
Тепловая обработка незначительно понижает прочность эластиновых волокон, поэтому мышечная ткань с повышенным содержанием эластина (шея, пашина) после тепловой обработки остается жесткой и ее используют главным образом для приготовления котлетной массы.