пробиотики для кишечника при беременности какие можно
Кишечная микробиота беременной женщины, как фактор здоровья будущего ребёнка

Но, что кроется за этими словами? И нужна ли на самом деле такая пробиотическая поддержка? Как выбрать качественный и правильный пробиотик для беременных, кормящих женщин, а также тех, кто только планирует стать мамой?
В попытке разобраться с этим вопросом, мы обратились к видному российскому учёному, профессору РАН, врачу акушеру-гинекологу, д.м.н., профессору кафедры акушерства и гинекологии медико-профилактического факультета Первого МГМУ им. И.М. Сеченова Виктории Омаровне Бицадзе.
– Виктория Омаровна, расскажите пожалуйста, почему вопрос применения пробиотических продуктов в особый период жизни женщины становится всё более актуальным?
Виктория Анатольевна, спасибо, что пригласили меня для разговора и затронули столь важную и перспективную тему. Вопрос находится на стыке акушерства и педиатрии, поскольку речь идёт не только о состоянии здоровья мамы, но и её будущего малыша.
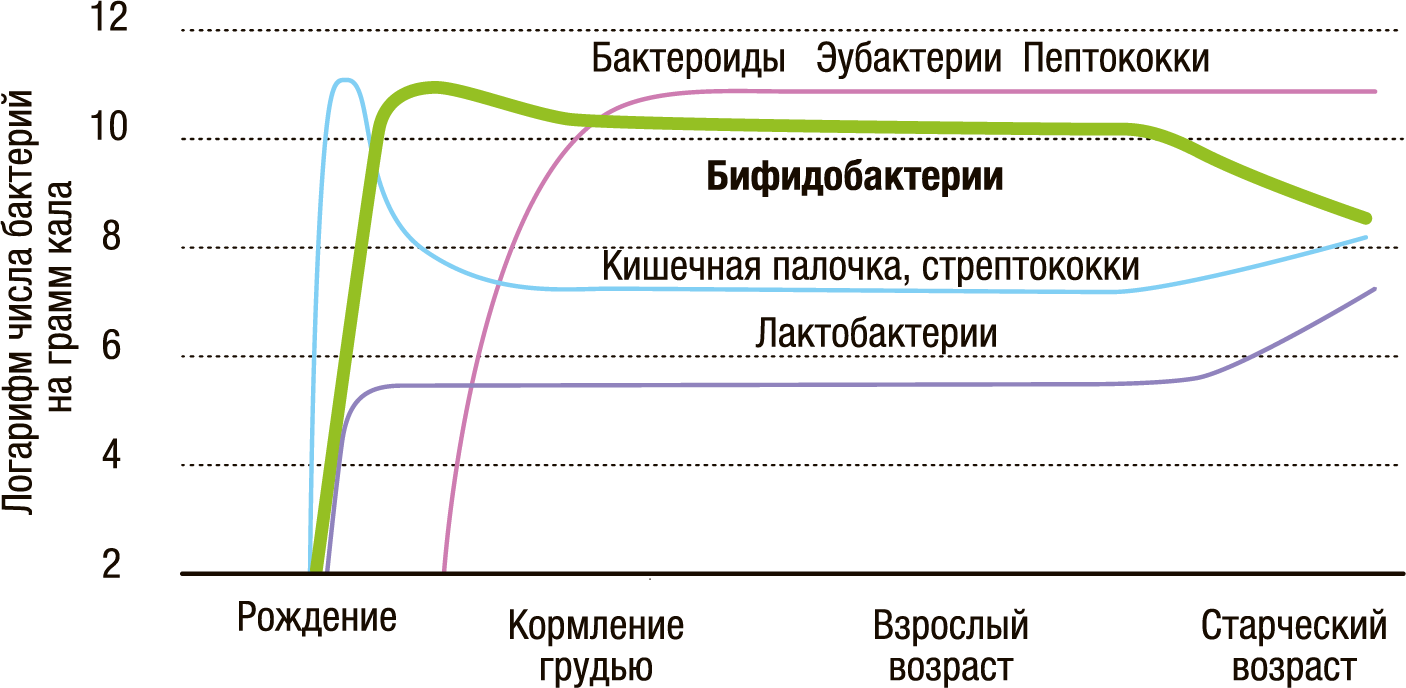
Микробиота кишечника плода начинает формироваться внутриутробно еще во время беременности, а затем в период родов и грудного вскармливания. При этом микробный «пейзаж» у мамы максимально влияет на микробный состав молока и микробиоту кишечника новорожденного. В период рождения и кормления грудью в кишечнике у ребенка доминируют бифидобактерии, которые во многом определяют состояние его здоровья в начальный период жизни.
Конечно же, ребенок получает их от мамы. А если у мамы не все в порядке с кишечной микробиотой, что она передаст своему будущему малышу и насколько он будет здоров?
Запоры и диареи, слабый иммунитет, высокий риск инфекций, гестационный диабет, инсулинорезистентность и избыточный вес, нарушения липидного обмена – вот те проблемы, которые обусловлены состоянием кишечной микробиоты и, которые мы стремимся минимизировать, как на этапе подготовки, так и во время беременности. Делается это, в том числе, для профилактики младенческих колик, инфекций, пищевой аллергии, атопического дерматита и других заболеваний будущего ребенка.
– Это действительно очень серьёзные проблемы, как для мамы, так и для малыша. Правильно ли я понимаю, что бифидобактерии способны позитивно влиять на решение этих проблем?
Совершенно верно! Но не любой штамм бифидобактерий, а только тот, который имеет серьёзную доказательную базу.
Роль бифидобактерий, в качестве полезной добавки к пище, изучается уже порядка 40 лет. Есть изученные штаммы с огромной достоверной доказательной базой. В частности, Bifidobacterium animalis ssp. Lactis (DSM 15954) – так называемый штамм ВВ-12®. Он клинически протестирован, и способен благотворно влиять на кишечную микрофлору матери и плода, снижать риск младенческих колик, оказывать целый ряд других положительных эффектов для мамы и малыша. Этот штамм известен с 1983 года, и в настоящее время это, пожалуй, самый изученный пробиотик в мире: около 400 научных публикаций и более 150 контролируемых клинических исследований. ВВ-12® способен предупреждать и помогать при всех тех заболеваниях и состояниях, которые я выше упомянула.
– Виктория Омаровна, как известно, запорами страдает каждая третья беременная женщина, а по некоторым данным их до 50%. Неужели проблему можно решить при помощи бифидобактерий ВВ-12®?
Как правило, запоры связаны с исходными заболеваниями желудочно-кишечного тракта. А во время беременности они чаще всего возникают с 17 по 36 неделю беременности в силу различных дополнительных причин: гормональных, связанных с кровоснабжением и нейрогуморальной регуляцией матки и толстой кишки.
Исследование 2015 года у 1248 здоровых взрослых с низкой частотой дефекаций убедительно продемонстрировало позитивное влияние B. lactis BB-12® на частоту стула (D. Eskesen et al., 2015). А в исследовании 2005 года у женщин с запорами штамм BB-12® успешно влиял на частоту дефекаций и консистенцию стула. (Uchida, K. et al., 2005).
Я широко использую в своей практике бифидобактерии ВВ-12® в составе комплекса ДАМОРЕ и вижу эффект практически у всех женщин, которым рекомендую, включая беременных.
– Отдельная тема, которая волнует большинство мамочек – младенческие колики. Что делать в этом случае: профилактировать, лечить или наблюдать? Какую стратегию выбираете Вы?
Штамм B. lactis BB-12® успешно применяется, как с целью начального заселения ЖКТ младенца полезной микрофлорой, в том числе, для устранения младенческих колик, так и для коррекции микробиоты у детей более старшего возраста. В исследовании 2015 года показано, что новорожденные с низкими титрами B. lactis BB-12® в кишечнике, и особенно при ее отсутствии, страдали мучительными эпизодами колик, сопровождавшихся пробуждением, плачем, криком, характерными движениями ножками. Длительность кишечных колик составляла от 10 мин до 3 часов. При полном отсутствии или сниженной концентрации B. lactis BB-12®, младенцы на искусственном вскармливании страдали обострением колик при введении прикормов, а дети на грудном вскармливании – обострением колик при расширении рациона кормящей матерью, при появлении в ее меню новых для ребенка продуктов (Cruchet S. et al., 2015).
Мое твердое убеждение – лучше предупредить, чем потом лечить. При сборе анамнеза у повторно беременных женщин, я обращаю внимание на состояние их ЖКТ, а так же на наличие колик и проблем с кишечником у их старших детей. В таких ситуациях всегда рекомендую ДАМОРЕ, и уже накоплен значительный положительный опыт не только в отношении мам, но и их новорожденных детей. Проблем с коликами у младших детей, как правило, не возникает.

Благодаря многолетнему опыту работы акушером-гинекологом я знакома с подавляющим большинством пробиотиков и витаминных комплексов.
ДАМОРЕ отличает уникальная концепция – объединение в одной капсуле пробиотика ВВ-12® с принципиально важными для здоровья матери и ребенка Омега-3 жирными кислотами, витаминами группы В (фолиевая кислота, витамин В6) и витамином Д3.
Все компоненты в комплексе обладают синергичными противовоспалительными и противоаллергическими эффектами.
Я рекомендую ДАМОРЕ беременным и кормящим женщинам, как с целью нормализации кишечной микрофлоры и устранения запоров, одной из мер профилактики гестационного диабета, так и с целью начального заселения ЖКТ младенца полезной микрофлорой, в том числе, для профилактики и устранения младенческих колик. А в последнее время, и многим женщинам, планирующим беременность, которые имеют проблемы с кишечником, лишний вес, нарушения со стороны иммунной системы.
– ДАМОРЕ – это БАД к пище. Вы не боитесь рекомендовать своим пациентам продукт, не являющийся лекарством?
Понимаю Вашу озабоченность, и многих наших коллег-врачей по данному вопросу.
ДАМОРЕ – это продукт, официально зарегистрированный в РФ, а не предлагаемый многими, порой сомнительными, сайтами. Надо сказать, что сегодня нередко беременные самостоятельно заказывают и назначают себе те или иные БАДы. Сейчас это стало очень «модным».
ДАМОРЕ прошёл все необходимые тесты по показателям подлинности и безопасности (химические и микробиологические исследования), и разрешен для применения в период беременности и кормления грудью в качестве добавки к пище.
– Виктория Омаровна, что бы Вы хотели сказать в заключение нашим читателям?
Хочу еще раз подчеркнуть: Профилактическая медицина – одно из самых приоритетных направлений современной медицинской науки. Нам куда проще предупреждать заболевания и патологические состояния, чем их лечить.
В этой связи, профилактика должна начинаться на этапе планирования беременности, либо когда ребёнок ещё в утробе матери. В идеале, эта профилактика должна быть двунаправленной: на маму и малыша. Удачным современным примером такого профилактического комплекса является ДАМОРЕ, состав которого соответствуют современным требованиям для БАД к пище, основан на научных данных и может программировать здоровье матери и ребенка на многие годы вперед.
Эффективность комплексных пробиотиков при запорах у беременных женщин
Резюме
Сегодня известно, что почти каждая третья беременная женщина страдает от запоров, которые, несомненно, снижают качество жизни. Генез запоров при беременности более или менее изучен. Однако поиск новых фармакоагентов для коррекции запоров ограничен понятными рамками — препарат должен быть безопасен для здоровья беременной женщины и плода. Существующие или предлагаемые методы коррекции зачастую имеют слабую доказательную базу либо не могут широко использоваться из-за нежелательных явлений у женщин (боли, диарейный синдром). Все вышесказанное требует поиска новых эффективных методов профилактики и коррекции запоров. В связи с тем, что запоры нередко возникают по причине нарушения нормального состава микрофлоры кишечника, в ближайшей перспективе видится более широкое применение пробиотиков для коррекции запоров у беременных. В статье приводится теоретическое обоснование применения пробиотиков у беременных женщин с запорами и доказательная база эффективного и безопасного применения некоторых пробиотических штаммов во время беременности.
Ключевые слова: пробиотики, запоры, беременность.
Abstract
Today we know that almost one of three pregnant women suffer from constipation, which undoubtedly reduces quality of life. Genesis of constipation during pregnancy is more or less studied. However, searching for new agents to correct constipation is limited by clear framework — drugs must be safe for the health of the pregnant woman and fetus. Existing or proposed correction methods often have weak evidence base or can’t be widely used due to adverse events in women (pain, diarrhea syndrome). All of this requires search for new effective methods of prevention and correction of constipation. Constipation often occur due to disruption of the intestinal microflora in the short term seems more widespread use of probiotics for the correction of constipation in pregnancy. The article provides a theoretical basis for the use of probiotics in pregnant women with constipation and evidence of effective and safe use of certain probiotic strains during pregnancy.
Key words:probiotics, constipation, pregnancy.
Изучению проблемы нарушений микрофлоры и моторики кишечника во время беременности длительное время не уделялось должного внимания. Отчасти это объясняется тем, что во многих случаях течение беременности требует коррекции более серьёзных с точки зрения клиницистов состояний, нежели дисбактериоз. Лишь в последнее десятилетие беременные женщины были отнесены к контингенту пациентов, у которых нарушение микробиоценоза кишечника имеет особое значение (наряду с новорождёнными, детьми раннего возраста и пациентами с нарушениями иммунитета) [1].
Данные о распространённости запоров у беременных женщин разнятся: в иностранной литературе она колеблется в пределах 11-38%, отечественные авторы указывают цифры до 66,8% [2]. У беременных женщин запоры регистрируются в основном во время третьего триместра, хотя симптомы могут обнаруживаться уже с 12-й недели [3, 6, 9, 22]. Диагностические характеристики функционального запора в соответствии с Римскими критериями III общеизвестны и приведены в таблице, стоит лишь добавить, что при физикальном исследовании нередко можно пропальпировать фекальные массы в брюшной полости или области прямой кишки [16, 29]. Однако при наблюдении беременных женщин этот объективный симптом не рекомендуется определять.
Механизм развития функциональных запоров у беременных
Такая актуальная проблема, как широкая распространённость запоров среди беременных женщин, привела к необходимости изучения механизмов нарушения моторики кишечника у данной группы пациентов. Несомненно, патофизиология функциональных запоров многофакторна и не изучена полностью. В качестве возможных причин можно назвать повышение уровня прогестерона и эстрогенов [6, 26, 33]. Так, в исследованиях на животных было показано, что женские половые гормоны, в частности, прогестерон, угнетают сокращения гладкой мускулатуры кишечника, снижая тем самым перистальтику [6, 8]. Определенное значение может иметь недостаточное потребление жидкости и клетчатки. Было даже высказано предположение, что беременные женщины потребляют меньше клетчатки, чем рекомендовано для среднестатистического представителя популяции, однако впоследствии эта гипотеза не подтвердилась [4, 12]. Были попытки сформировать доказательную базу в пользу того, что увеличение потребления клетчатки во время беременности может улучшить состояние за счёт увеличения частоты дефекации. Но и эти испытания не увенчались успехом: клетчатка не показала достоверной эффективности в сравнении с плацебо [18]. Кроме эндокринных и алиментарных причин в качестве предрасполагающих факторов запоров у беременных называют вынужденное ограничение подвижности, нередко сопряжённое с угрозой прерывания беременности, приём препаратов железа в целях профилактики и лечения анемии, сдавливание кишечника увеличивающейся маткой, а также применение некоторых препаратов для коррекции экстрагенитальной патологии у беременных (антигипертензивные и пр.).
Таблица. Римские критерии III диагностики функционального запора [24]
| I. | Присутствуют хотя бы 2 или более из следующих критериев: — натуживание при > 1/4 дефекаций; — комковатый или твёрдый стул при > 1/4 дефекаций; — ощущение неполного опорожнения кишечника при > 1/4 дефекаций; — чувство аноректальной обструкции при > 1/4 дефекаций; — мануальная помощь при осуществлении дефекации при > 1/4 дефекаций; — стул менее 2 раз в неделю. |
| II. | Жидкий стул редко появляется без применения слабительных средств. |
| III. | Недостаточно симптомов для диагностики синдрома раздражённого кишечника. |
Сегодня в литературе упоминаются лишь несколько эффективных способов профилактики и коррекции запоров у беременных. Авторы недавно опубликованного обзора оценки эффективности различных слабительных средств утверждают, что стимулирующие слабительные могут быть более эффективными в лечении запоров во время беременности, чем средства, увеличивающие объём каловых масс, т.к. они стимулируют дефекацию и размягчают стул [32]. Однако нежелательные эффекты, такие как боль в животе и диарея, существенно ограничивают их использование. Нужно также подчеркнуть, что упомянутые в обзоре исследования имеют низкую степень доказательности [32]. Раздражающие слабительные, как справедливо замечают некоторые авторы, могут вызвать рефлекторные схватки [15]. Таким образом, сегодня есть потребность в средствах, безопасных и для будущей матери, и для плода. Они должны вписываться в общепринятую концепцию лечения запоров во время беременности, согласно которой первым шагом в лечении всегда являются нефармакологические меры [14]. Так, в отечественной практике лечение запоров начинают с рекомендации частого (5-6 и более раз в день) дробного питания, включения в рацион богатых клетчаткой продуктов (хлеб грубого помола, сливы, яблоки, бобовые, морковь, свёкла, тыква, кабачки, орехи и т.п.), кисломолочных продуктов (кефир, йогурт). Следует ограничить употребление риса, белого хлеба, кондитерских изделий. Если нет отёков, не нужно ограничивать приём жидкости, но рекомендуется исключить чёрный чай и кофе. При отсутствии противопоказаний целесообразно увеличить физическую активность, например, рекомендовать плавание в бассейне, йогу, гимнастику для беременных (желательно под контролем специалиста). К сожалению, зачастую немедикаментозные меры могут рассматриваться только в качестве вспомогательных, как дополнение к применению высокобезопасных и эффективных средств. Всё больше специалистов России и зарубежья сходятся во мнении, что такими средствами являются пробиотики — именно эта группа средств может считаться оптимальным решением проблемы запоров у беременных женщин. Кроме того, с позиций доказательной медицины есть целый ряд веских доводов в пользу достаточной безопасности пробиотиков для матери и плода:
Наиболее изученными на сегодняшний день являются различные штаммы Bifidobacterium и Lactobacillus. Bekkali и соавт. [5] описали эффективность комбинации Bifidobacterium bifidum W23, Bifidobacterium lactis W52, Bifidobacterium longum W108, Lactobacillus casei W79, Lactobacillus plantarum W62 и Lactobacillus rhamnosus W71 при запорах у детей. Другое рандомизированное контролируемое исследование с использованием Lactobacillus Rhamnosus и Propionibacterium freudenreichii, проведённое среди пациентов старшего возраста, страдающих запорами, показало положительные результаты по показателю увеличения частоты дефекации у больных [27]. Прочие рандомизированные контролируемые испытания также показывают, что упомянутая комбинация оказывает значительное влияние на частоту дефекации и консистенцию стула у взрослых [11, 19, 34]. Ввиду положительных результатов коррекции запоров у детей, пациентов старшего возраста пробиотиками, регистрации нежелательных эффектов многих других методов лечения запоров во время беременности, появились основания полагать, что комбинация пробиотиков может оказывать положительный эффект при запорах у беременных женщин.
С нашей точки зрения, значительное увеличение частоты дефекаций у беременных женщин на фоне приёма комбинированного пробиотика, а также существенное уменьшение ощущения неполного опорожнения кишечника, ощущения аноректальной обструкции, напряжения во время дефекации, болей в животе и эпизодов рефлюкса необходимо расценивать как существенные доводы в пользу дальнейшего изучения комбинированных пробиотиков и более широкого внедрения их во врачебную практику. В ходе исследования не было сообщений о нежелательных явлениях, что также немаловажно. Кроме того, эти данные соответствуют результатам упомянутого выше исследования Bekkali и соавт., в котором изучалась аналогичная комбинация пробиотиков (исследование показало значительную активацию кишечной перистальтики, уменьшение числа эпизодов самопроизвольной дефекации и появления болей в животе [5]). Пока есть уверенность, что применение такой комбинации может быть эффективным и безопасным методом выбора для улучшения качества жизни у беременных женщин, это позволяет с оптимизмом надеяться на решение проблемы запоров при беременности.
Профилактика дисбактериоза и взаимосвязанных патологий у будущего ребенка и уже рожденного малыша
ПРОБИОТИКИ. БЕРЕМЕННОСТЬ И ПОСТНАТАЛЬНЫЙ ПЕРИОД
1. Возможность пробиотической коррекции нарушений микрофлоры матери для профилактики возможных осложнений у ребенка. Влияние микрофлоры матери на формирование здоровья будущего ребенка
1.1. Введение
Хорошо известно, что формирование микробиоты человека начинается еще в период внутриутробного развития. При этом генная последовательность микроорганизмов, обнаруженных у матери в тканях матки и плаценте, повторяется у новорожденного [1,2]. Хотя ранее считалось, что амниотическая жидкость стерильна, на основании генных методов исследования выявлены некоторые общие признаки бактериального профиля полости рта у матери и амниотической жидкости плода и плацентарных образцов [3]. Установлено, что бактерии присутствуют в амниотической жидкости, меконии, кишечнике у здоровых новорожденных. После рождения, примерно до 3 лет, происходят дифференцировка и формирование уникального состава микросреды кишечника индивидуума, которая практически не меняется в течение всей жизни.
Множество факторов влияет на формирование микробиоты кишечника младенца: в период внутриутробного развития микрофлора матери, состояние ее здоровья, в дальнейшем условия и способы ведения родов, грудное или искусственное вскармливание и т.д. До 80% информации о микробиоте матери передается к плоду. Первые несколько дней после родов микробиота у здоровых младенцев, рожденных естественным путем, содержит большое количество лактобацилл, пропорциональное числу лактобактерий в вагинальной флоре. Между тем доля лактобактерий в кишечнике у младенцев, рожденных кесаревым сечением, быстро истощается; наблюдается задержка колонизации рода Bacteroides, но происходит колонизация факультативными анаэробами, такими как Clostridium species, свойственными для лиц зрелого возраста, но в детском организме приобретает патогенные свойства.
Неблагоприятные факторы внешней среды нарушают у новорожденных заселение бифидобактериями, приводят к длительному персистированию аэробов (протеобактерий), что нарушает формирование иммунной толерантности растущего организма.
У детей с манифестацией атопического дерматита в первые 6 мес жизни уже изначально регистрируется активная колонизация кишечника протеобактериями, аэробными грамотрицательными бактериями, спектр которых практически идентичен таковому у их матерей с патологическим течением беременности, обусловлен также дисбиозом, снижением нормальной колонизации лактобатериями. У аэробных грамотрицательных бактерий кишечного происхождения (цитобактер, клебсиелла, протей, кишечная палочка с измененными свойствами) у матери и младенцев с нарушениями становления кишечной микробиоты выявлена высокая интенсивность продукции гистамина. Этот признак относят к дополнительным, прогностически значимым критериям реализации аллергической настроенности организма ребенка на заболевание [6].
1.2. Роль бактериальных метаболитов в детском возрасте и механизмы биологической активности пробиотиков
В норме в микробном сообществе детей раннего возраста в тонком кишечнике преобладает Lactobacillaceae, в толстой кишке доминируют Prevotellaceae, Lachnospiraceae и Rikenellaceae. Применение пробиотических препаратов может быть рекомендовано для коррекции нарушений микрофлоры матери и профилактики возможных осложнений у ребенка [7].
С учетом процессов метилирования ДНК установлено, что организм особенно уязвим в критические периоды развития, включая внутриутробную и раннюю послеродовую жизнь, которая относится к концепции «первые 1000 дней жизни» [8]. Одна из основных причин может заключаться в том, что это период, когда делящимся клеткам требуется относительно высокий уровень метильных доноров для метилирования позиций CpG в новообразованной цепи ДНК для поддержания установленных образцов метилирования. В отсутствие достаточного количества метильных доноров метиловые метки затем могут быть полностью потеряны [9].
Эпигенетически уязвимые периоды различаются для разных органов. Органы, подобные сердцу, формируются в начале эмбриогенеза, когда воздействие бактериальных метаболитов происходит только косвенно через мать, поэтому могут быть почти инертными по отношению к этим факторам. С другой стороны, органы, которые формируются и дифференцируются в более поздний период, как мозг, или с высокой скоростью деления клеток, как, например, клетки кишечника, могут быть более восприимчивыми к влиянию метаболитов из микробиоты матери.
Представители нормальной микрофлоры кишечника у детей обладают адгезивными свойствами, фиксируясь на эпителии слизистой оболочки кишечника, они образуют пристеночный слой, что обеспечивает колонизационную резистентность организма. Они устойчивы к неблагоприятным внешним воздействиям за счет образования клеточного муцина и бактериального полисахарида, синтезируют антибиотикоподобные вещества ( бактериоцины ). Продукты жизнедеятельности нормальной микрофлоры кишечника, закисляя его содержимое, стимулируют его моторную функцию. Кроме того, метаболиты микрофлоры задействованы в энергообеспечении эпителиоцитов, регуляции нормальной пролиферации и дифференцировки клеток кишечника и др.
Ученые из педиатрической клиники Бостона и Гарвардского университета в сотрудничестве с учеными из медицинского университета Нью-Йорка (США) провели исследование, позволившее доказать, что применение пробиотиков у детей младше 5 лет сокращает продолжительность диареи.
Избыточный вес и ожирение, развитие сахарного диабета чаще отмечаются у детей с малым весом при рождении, не получавших грудного молока и рожденных от матерей с различными вариантами дисбиоза (гарднереллез, низкое содержание лактобактерий в кишечнике) [12]. Напротив, грудное вскармливание, здоровая микробиота в кишечнике матери определяют нормальное физическое и психическое развитие [14, 15]. Показано важное значение пробиотиков женщиной во время беременности и в период грудного вскармливания, так как предупреждает истощение лактобактерий (LGG) в постнатальном периоде. Показано, что микробиота матери вне зависимости от колонизации бактерий в неонатальном периоде стимулирует формирование иммунного ответа с помощью иммуноглобулинов грудного молока [16].
1.3. Коррекция микробиоты матери для профилактики возможных осложнений у ребенка
Большое число исследований посвящено изучению эффективности приема пробиотиков кормящими матерями. Доказано, что прием пробиотиков, содержащих LGG или бифидобактерии, во время беременности увеличивает содержание интерферона-гамма в крови и грудном молоке, что положительно влияет на иммунитет новорожденных 18. На основании рандомизированных контролируемых исследований R. Boyle и соавт. показали, что прием пробиотиков, содержащих Lactobacillus GG, во время беременности благоприятно влиял на иммунный статус и предупреждал развитие бронхиальной астмы и экземы у новорожденных [20].
Таким образом, прием пробиотиков женщиной в перинатальном периоде и в период лактации для улучшения колонизации кишечника ребенка является обоснованным на основании доказательств того, что бактерии передаются от матери к новорожденному через прямой контакт с материнской микрофлорой во время родов и через молоко в период грудного вскармливания.
S. Rautava и соавт. показали, что пробиотики в течение беременности и грудного вскармливания повышают устойчивость к атопии в дальнейшем [22]. Эффективность пробиотиков для профилактики атопических заболеваний продемонстрирована в систематических обзорах и метаанализе 23. По данным анализа базы Cochrane, проведенного D. Osborn, J. Sinn, было показано, что про- и пребиотики эффективны у младенцев для профилактики аллергии [24].
К настоящему моменту различные исследования продемонстрировали эффективность использования пробиотиков как амбулаторно, так и в стационаре во время подготовки к беременности и родам. Пробиотики, содержащие штаммы Lactobacillus acidophilus NCFM, L. paracasei Lpc-37, Bifidobacterium lactis Bi-07, B. lactis BI-04, Streptococcus thermophilus STY-31, Lactobacillus acidophilus W37 и W55, L. paracasei W72, L. plantarum W62, L. rhamnosus W71 и L. salivarius W24, благоприятно влияют на формирование микрофлоры в ранний неонатальный период и могут быть использованы для профилактики будущих заболеваний у ребенка (см. таблицу ) [26,27]. P. Mastromarino и соавт. показали, что комплексный пробиотик VSL#3, содержащий 8 штаммов пробиотиков (1 штамм Streptococcus thermophilus, 4 штамма Lactobacillus spp. и 3 штамма Bifidobacterium spp.), эффективно влияет на свойства грудного молока в зависимости от способа родоразрешения 30.
Таким образом, включение указанных штаммов в программу предродовой подготовки, периода беременности, вскармливания.
Клинические исследования, в которых изучались эффекты перорального приема пробиотиков у беременных женщин и рожденных ими детей, представлены в таблице.
Также пренатальный прием пробиотиков был связан со значительным увеличением количества Bifidobacterium и Lactococcus lactis (здоровая кишечная флора) в кишечнике матери и неонатальном кале ребенка. Побочных эффектов пробиотиков в этих исследованиях отмечено не было [33].
Введение матерям в течение 4 нед до и 3 нед после родов L. rhamnosus GG индуцировало специфические изменения в колонизации бифидобактериями кишечника новорожденных по сравнению с теми, кто получал плацебо. Младенцы в возрасте 5 дней, чьи матери получали L. rhamnosus GG, имели более высокую распространенность B. breve и низкую распространенность В. adolescentis, чем новорожденные, матери которых получали плацебо.
Эффективность пробиотиков в профилактике преждевременных родов оценивалась у женщин с их высоким риском, который достигал уровня 30—50%; полученные результаты свидетельствуют о снижении риска половых инфекций на 81% у этих женщин после приема пробиотиков [36,37].
Использование пробиотических бактерий во время беременности было предложено в качестве средства модуляции иммунной системы развивающегося плода для снижения риска иммунных аберраций и улучшения защиты хозяина. У матерей, принимающих пробиотики, было обнаружено значительное увеличение естественных клеток-киллеров в периферической крови и незначительное увеличение Т-лимфоцитов и В-лимфоцитов. В материнском молоке было выявлено снижение медиаторов инициального повреждения фактора некроза опухолей-альфа ( TNFα ). У грудных детей, матери которых употребляли L. casei, также было зарегистрировано меньше проблем с пищеварением, в том числе меньше случаев кандидоза полости рта, срыгивания, диареи, колик, запоров в период от 2 до 6 мес [34, 38].
Применение пробиотика L. rhamnosus GG беременными женщинами и их детьми уменьшило риск развития атопической экземы в течение первых 7 лет жизни [39]. L. rhamnosus GG назначался беременным женщинам, которые имели, по крайней мере, одного родственника первой степени родства с атопическим дерматитом, аллергическим ринитом или астмой, в течение 4 нед до предполагаемых родов и в течение 6 мес в послеродовом периоде. При приеме пробиотика беременной и кормящей женщиной увеличивалось количество противовоспалительного цитокина TGF-2 в молоке матери, что улучшало ее иммунозащитный потенциал и было связано с уменьшением риска атопической экземы в течение первых 2 лет жизни ребенка (15% по сравнению с 47%). Дети «атопических» матерей, особенно находящиеся на исключительно грудном вскармливании в течение 2,5 или 6 мес, имеют более высокий риск сенсибилизации в течение 1-го года жизни. Однако этот риск может быть снижен за счет использования пробиотиков во время беременности и в период лактации [40,41].
В группе детей, матери которых получали во время беременности пробиотики, было выявлено меньше случаев иммуноглобулин Е(IgE)-ассоциированных экзем в течение 2-го года жизни (8% по сравнению с 20%). Сравнительное изучение эффектов 2 пробиотиков — L. rhamnosus HN001 и Bifidobacterium animalis подвид lactis HN019 — проведено у беременных женщин и их детей. Младенцы, получавшие в этом исследовании L. rhamnosus, имели значительно меньший риск развития экземы [38]. Смесь пробиотических бактерий (Bifidobacterium bifidum W23, Bifidobacterium lactis W52 и Lactococcus lactis W58) назначалась беременным женщинам за 6 нед до родов и в течение 12 мес после, а также их младенцам, наблюдение продолжалось 24 мес. Частота экземы у детей «пробиотической» группы в течение первых 3 мес жизни была значительно ниже, чем в группе плацебо. Однако в возрасте 3 мес и до 2 лет заболеваемость экземой была одинаковой в обеих группах [39, 40].
C. Pelucchi и соавт. провели метаанализ рандомизированных контролируемых исследований по влиянию пробиотиков, применяемых во время беременности и в послеродовом периоде, на заболеваемость атопическим дерматитом и IgE-зависимым атопическим дерматитом. Получены доказательства эффективности пробиотиков в профилактике атопического дерматита и IgE-ассоциированного атопического дерматита у младенцев и детей. Благоприятный эффект не зависел от времени использования пробиотика (беременность или период лактации), а также объекта получения пробиотиков (мать, ребенок или оба) [44].
R. Bertelsen и соавт. изучали взаимосвязи между потреблением пробиотических молочных продуктов матерями во время беременности и лактации и развитием атопического дерматита, риноконъюнктивита и бронхиальной астмы у 40 614 детей. Потребление пробиотиков во время беременности было связано со снижением относительного риска (ОР) развития у младенцев атопического дерматита в первые 6 мес (ОР 0,94; 95% ДИ 0,89—0,99) и риноконъюнктивита между 18 и 36 мес (ОР 0,87; 95% ДИ 0,78—0,98) по сравнению с детьми, матери которых не принимали пробиотики [45].
K. Laitinen и соавт. исследовали эффекты пробиотиков в сочетании с диетой на метаболизм глюкозы у беременных женщин. Исследование включало три подгруппы беременных женщин в I триместре беременности. 1-я группа соблюдала диету (диета—плацебо), женщины 2-й группы получали пробиотики и соблюдали диету (L. rhamnosus GG и B. lactis BB12, диета—пробиотики), а 3-я группа получала плацебо (привычное питание и плацебо). Концентрация глюкозы в крови оставалась низкой в группе «диета—пробиотики» во время беременности и в течение 12 мес послеродового периода. Толерантность к глюкозе была в группе «диета—пробиотики» также выше, чем в группе «привычное питание—плацебо» в течение последнего триместра беременности и в период 12 мес после родов [46]. R. Luoto и соавт. обнаружили, что дети, рожденные женщинами, которые принимали пробиотики в III триместре беременности, имели статистически значимое снижение риска ожирения (p=0,035) и большой длины тела при рождении (p=0,028) [47].
Z. Asemi и соавт. провели сравнение показателей инсулинорезистентности (HOMA-IR) у женщин в III триместре беременности. Часть из них в течение 9 нед потребляли 200 г/сутки обычного йогурта, а другая часть — пробиотик, содержащий два штамма (Lactobacillus acidophilus LA5 и Bifidobacterium animalis BB12) с общим количеством 1×107 колонийобразующих единиц (КЕ). В отличие от обычного йогурта ежедневное потребление пробиотического йогурта в течение 9 нед снижало у беременных женщин сывороточный уровень инсулина и риск развития инсулинорезистентности [48].
1.4. Заключение
Таким образом, пробиотики показаны для беременных и кормящих женщин, так как:
Литература по 1-й части раздела (по 48 пункт) здесь →
2. НЕКОТОРЫЕ ФАКТЫ И РЕКОМЕНДАЦИИ
Изложенный выше материал убедительно показывает значимость пробиотической профилактики для мам и их будущих, а также новорожденных детей с целью укрепления иммунитета и предотвращения различных заболеваний в дальнейшей жизни. Однако краткий обзор основан на небольшом количестве исследований, а потому количество и виды используемых штаммов пробиотических микроорганизмов, указанные как рекомендуемые (с позиции доказательной медицины) ограничены рамками проанализированных работ. В связи с этим мы решили дополнить данный раздел некоторыми полезными заметками.
2.1 Пробиотики при беременности и подготовке к беременности
Микробиом младенца начинает развиваться в утробе матери.
Ведущая парадигма колонизации в раннем возрасте гласит, что плод развивается в стерильной среде внутриутробного развития и становится колонизированным микробами после рождения в процессе вагинального родоразрешения, кормления грудным молоком матери и других воздействий окружающей среды. Однако результаты исследования американских педиатров, в котором секвенирование следующего поколения выявило ДНК из различных ассоциированных с человеком бактерий в человеческой плаценте, амниотической жидкости (околоплодных водах) и меконии младенцев, позволяет утверждать, что первые столкновения с микробами могут происходить пренатально даже в условиях здоровой беременности.
Было установлено, что успешная беременность требует координации и баланса между материнским и развивающимся иммунитетом плода. Микробы играют важную роль в иммунном гомеостазе и регуляции. Наличие эмбриональных организмов или их молекулярных сигнатур может стимулировать иммунитет слизистой оболочки плода и подготавливать ткани к колонизации после рождения.
Микробиота беременной женщины обеспечивает ей метаболизм, необходимый для вынашивания здорового ребенка. Тип и количество бактерий, содержащихся в различных микробиоценозах и амниотической полости будущей матери, имеют важное значение для исходов беременности и рождения здорового ребенка.
При привычным невынашивании беременности (ПНБ) по данным МСММ у женщин в кишечнике наблюдается избыточный рост условно-патогенной флоры (УПФ) на фоне дефицита всей нормобиоты, особенно бифидобактерий и лактобацилл. Также, избыточный рост УПФ в сочетании с дефицитом нормофлоры напрямую был связан с сальпингитом и эндометритом. Выявленные зависимости свидетельствуют о значимой роли микробиоты кишечника в развитии дисбиоза матки и формировании ПНБ.
Во многом благодаря этим познаниям, репродуктологи, работающие по методике МСММ и учитывающие микробный фактор, стали иметь больше положительных результатов беременности, даже в случае обращений пациенток к таким специалистам после ряда неудачных ЭКО – ред..
Таким образом, пробиотики должны быть показаны не только беременным и кормящим женщинам, но и женщинам при подготовке к беременности, особенно из группы риска на инфекционные осложнения.
2.2. Постнатальное пробиотическое лечение детей.
Ведущая роль бифидобактерий и грудное вскармливание
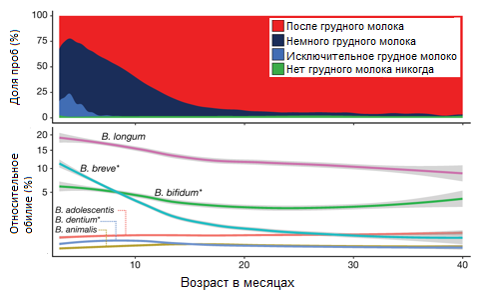
Младенцы, лишенные грудного вскармливания имеют больший риск развития многих заболеваний в более позднем возрасте, таких как аллергия и ожирение. Исследования укрепили важную роль грудного вскармливания в обеспечении хороших бактерий кишечника для младенцев на ранних стадиях их жизни. Так, например, группа специалистов из Университета Ньюкасла, Великобритания, установила, что Бифидобактерии изобилуют грудном в молоке и быстро сокращаются в кишечнике младенцев после прекращения грудного вскармливания. Нацеливание на питательные вещества в грудном молоке, которые стимулируют рост здоровых бактерий в кишечнике ребенка, или предоставление пробиотиков, содержащих бифидобактерии, представляют собой важные направления для вмешательств, направленных на восстановление полезных свойств грудного вскармливания, когда грудное молоко недоступно.
Рис. 1. Графики, показывающие получение грудного молока в возрасте от 3 до 40 месяцев по сравнению с относительным обилием шести наиболее распространенных видов бифидобактерий за тот же период (n = 11,717)
Пробиотическая защита недоношенных детей от некротизирующего колита (НЭК) и сепсиса
Дополнительная информация о пропионовокислых бактериях!
Потребление грудного молока человека (HBM) снижает частоту развития некротического энтероколита (NEC), который остается ведущей и трудноизлечимой причиной смертности недоношенных детей. В работе Colliou et al., 2017 сообщается, что это уменьшение коррелирует с изменениями в микробиоте кишечника, особенно с обогащением видов молочных пропионибактерий:
Предотвращение задержки роста детей
Что касается недоношенных детей, находящихся в отделении реанимации и интенсивной терапии, то чем более аномален (дисбиотичен) их кишечный микробиом, тем более вероятно, что они будут испытывать замедление роста даже в 4-летнем возрасте, что было установлено в исследовании Университетом Южной Флориды (USF Innovation).
В отношении других детей с задержкой роста влияние кишечного микробиома на их рост продемонстрировали сразу несколько независимых исследовательских коллективов, которые установили 3 основные причины:
Эксперт по инфекционным заболеваниям и кишечной микробиоте из Университета Виргинии в Шарлотсвилле Уильям Петри (William Petri) подчеркнул важность полученных данных, назвав их «переломным моментом в глобальном здравоохранении в целом и в диетологии в частности». Основная идея в лечении та же – обязательная пробиотическая профилактика (пробиотикотерапия).
2.3. Доказательства безопасности пробиотиков для будущих мам и новорожденных детей.
Снижение частоты инфекционных заболеваний, предотвращение аллергии, экземы и т.д.
В исследованиях была подтверждена долгосрочная безопасность и эффективность кормления пробиотической смесью. Смесь назначалась как беременным матерям, носившим детей с высоким риском развития аллергии (в течение от 2 до 4 недель до родов), так и их новорожденным младенцам (в течение 6 месяцев от рождения). В указанные смеси входили следующие пробиотические виды: Lactobacillus rhamnosus, Bifidobacterium breve и Propionibacterium freudenreichii ssp shermanii.
Следует отметить, что в рандомизированных выборках новорожденных была проанализирована бактериальная колонизация мекония (n = 131) и образцов фекалий через 3 (n = 98), 6 (n = 99) и 24 (n = 89) месяца для бактериального восстановления добавленных бактерий. Были проведены анализы на общее количество лактобацилл и бифидобактерий.
Это подтверждают и др. исследования. Так, например, в 2004 году в Индии в Махараштрском университете была проведена обширная по масштабу исследовательская работа, в которой объектами исследования служили 135 детей-добровольцев (от 2 до 5 лет) с желудочно-кишечными инфекциями. В результате данного эксперимента было установлено, что в группе детей, получавших ПКБ, выздоровление происходило быстрее, и в течении 3-х месяцев после лечения сохранялось стабильное состояние здоровья. Более того, у детей наблюдалась прибавка в весе, а через 15 дней в их кале в несколько раз возрастало количество бифидобактерий, лактобацилл и самих пропионибактерий, и резко снижалось количество клостридий, колиформных бактерий, стафилококков и энтерококков.
Дополнительная информация про безопасность бифидобактерий и классических («молочных») пропионовокислых бактерий:

Учитывая все данные изложенного выше материала, в т.ч. описанные пробиотические свойства молочных пропионовокислых бактерий P. freudenreichii и важную роль бифидобактерий в пробиотической профилактике для беременных женщин и новорожденных детей, а также доминирование среди бифидобактерий вида B. longum (в первые годы жизни ребенка), медицинским специалистам необходимо на практике (и более широко) использовать данный потенциал полезных микроорганизмов в сфере репродуктологии, акушерства и гинекологии и педиатрии. Тем более, что кроме усиления бифидогенной активности, симбиоз бифидо- и пропионовых бактерий имеет повышенные противоинфекционные и антимутагенные свойства, что ранее было установлено экспериментально.

Дополнительно см.:
Список литературы
Будьте здоровы!
ССЫЛКИ К РАЗДЕЛУ О ПРЕПАРАТАХ ПРОБИОТИКАХ