продуктом какого процесса является этилен
Этилен
Характеристики и физические свойства этилена
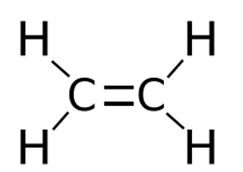
Представляет собой бесцветный горючий газ (строение молекулы показано на рис. 1), который обладает слабым запахом. Плохо растворяется в воде, но хорошо в диэтиловом эфире и углеводородах.
Рис. 1. Строение молекулы этилена.
Таблица 1. Физические свойства этилена.
Молярная масса, г/моль
Температура плавления, o С
Температура кипения, o С
Получение этилена
Способы получения этилена можно разделить на промышленные и лабораторные. В первом случае этен – это продуктдегидрирования этана, полученного при крекинге нефти.
В лабораторных условиях этилен можно получить при помощи дегидратации этанола (1), дегалогенированиямоно- и дигалогенпроизводных этана (2, 3) или при неполном гидрировании ацетилена (4):
Химические свойства этилена
Этилен способен присоединять водород (гидрирование) (5), галогены (галогенирование) (6), галогеноводороды (гидрогалогенирование) (7) и воду (гидратация) (8):
В зависимости от условий проведения реакции окисления этилена могут быть получены многоатомные спирты (9), эпоксиды (10) или альдегиды (11):
В результате горения этилена происходит разрыв всех связей в молекуле, а продуктами реакции являются углекислый газ и воды:
Этилен подвергается полимеризации:
Кроме этого, если проводить галогенирование этилена при температуре 400 o С, то разрыва двойной связи происходить не будет, будет замещаться один атом водорода в углеводородном радикале:
Применение этилена
Основное направление использование этилена — промышленный органический синтез таких соединений как галогенопроизводные, спирты (этанол, этиленгликоль), уксусный альдегид, уксусная кислота и др. Кроме этого данное соединение в производстве полимеров.
Примеры решения задач
этан → этен → этанол → этен → хлорэтан → бутан.
Получение этанола из этена осуществляют по реакции гидратации, протекающей водой в присутствии минеральных кислот (серной, фосфорной):
Для получения этена из этанола используют реакцию дегидротации:
Получение хлорэтана из этена осуществляют по реакции гидрогалогенирования:
Для получения бутана из хлорэтана используют реакцию Вюрца:
| Задание | Сколько граммов потребуется для бромирования 16,8 г алкена, если известно, что при каталитическом гидрировании такого же количества алкена присоединилось 6,72 л водорода? Каков состав и возможное строение исходного углеводорода? |
| Решение | Запишем в общем виде уравнения бромирования и гидрирования алкена: |
Рассчитаем количество вещества водорода:
n(H2) = 6,72 / 22,4 = 0,3 моль,
следовательно, алкена тоже будет 0,3 моль (уравнение 2), а по условию задачи это 16,8 г. Значит молярная масса его будет равна:
что соответствует формуле C4H8.
Найдем массу брома:
M(Br2) = 2×Ar(Br) = 2×80 = 160 г/моль;
m(MnO2) = 0,3 × 160 = 48 г.
Составим структурные формулы изомеров: бутен-1 (1), бутен-2 (2), 2-метилпропен (3), циклобутан (4).
Этилен, этен
В природе этот газ практически не встречается: он образуется в незначительных количествах в тканях растений и животных как промежуточный продукт обмена веществ. Попутно это — самое производимое органическое соединение в мире. Газ этилен служит сырьем для получения полиэтилена.
Свойства этилена
Этилен (другое название — этен ) — химическое соединение, описываемое формулой С2H4. В природе этилен практически не встречается. Это бесцветный горючий газ со слабым запахом. Частично растворим в воде (25,6 мл в 100 мл воды при 0°C), этаноле (359 мл в тех же условиях). Хорошо растворяется в диэтиловом эфире и углеводородах.
Этилен является простейшим алкеном (олефином). Содержит двойную связь и поэтому относится к ненасыщенным соединениям. Играет чрезвычайно важную роль в промышленности, а также является фитогормоном.
Сырье для полиэтилена и не только
Этилен — самое производимое органическое соединение в мире; общее мировое производство этилена в 2005 году составило 107 миллионов тонн и продолжает расти на 4–6% в год. Источником промышленного получения этилена является пиролиз различного углеводородного сырья, например, этана, пропана, бутана, содержащихся в попутных газах нефтедобычи; из жидких углеводородов — низкооктановые фракции прямой перегонки нефти. Выход этилена – около 30%. Одновременно образуется пропилен и ряд жидких продуктов (в том числе ароматических углеводородов).
Применение
Этилен является одним из базовых продуктов промышленной химии и стоит в основании ряда цепочек синтеза. Основное направление использования этилена — в качестве мономера при получении полиэтилена (наиболее крупнотоннажный полимер в мировом производстве). В зависимости от условий полимеризации получают полиэтилены низкого давления и полиэтилены высокого давления.
Этилен используют для ускорения созревания плодов — например, помидоров, дынь, апельсинов, мандаринов, лимонов, бананов; дефолиации растений, снижения предуборочного опадения плодов, для уменьшения прочности прикрепления плодов к материнским растениям, что облегчает механизированную уборку урожая.
Этилен
Полезное
Смотреть что такое «Этилен» в других словарях:
Этилен — Этилен … Википедия
ЭТИЛЕН — (греч.). Маслородный газ, бесцветный, состоит из углерода и водорода. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. ЭТИЛЕН бесцветный горючий удушливый газ. Полный словарь иностранных слов, вошедших в… … Словарь иностранных слов русского языка
Этилен-N — Этилен N,N динитрамин Этилен N,N динитрамин Этилен N,N динитрамин (этилендинитрамин, ЭДНА, гейлеит) химическое соединение C2H6 … Википедия
Этилен — – простейший представитель олефиновых углеводородов, представляющий собой бесцветный газ со слабым приятным запахом; легче воздуха, плохо растворим в воде, горит светящимся пламенем. Этилен является одним из основных продуктов… … Нефтегазовая микроэнциклопедия
этилен — а, м. éthylène m. Бесцветный горючий газ, состоящий из углерода и водорода. БАС 1. Лекс. Толль 1864: этилен; СИС 1937: этиле н … Исторический словарь галлицизмов русского языка
ЭТИЛЕН — (CH2=CH2) простейший представитель олефинов; бесцветный газ со слабым запахом; легче воздуха, плохо растворим в воде, горит слегка светящимся пламенем. В больших количествах (до 20%) содержится в газах нефтепереработки, входит в состав коксового… … Российская энциклопедия по охране труда
ЭТИЛЕН — ЭТИЛЕН, см. ЭТЕН … Научно-технический энциклопедический словарь
ЭТИЛЕН — ЭТИЛЕН, этилена, мн. нет, муж. (см. этил) (хим.). Горючий газ со сладковатым запахом, одна из составных частей светильного газа. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
ЭТИЛЕН — ЭТИЛЕН, а, м. Бесцветный газ Ч один из основных продуктов нефтехимической промышленности. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
ЭТИЛЕН — С2Н4, ненасыщенный углеводород. В незначит, кол ве образуется в тканях растений и животных как промежуточный продукт обмена веществ. Содержащийся в разл. органах высших растений (плодах, цветках, листьях, стеблях, корнях) Э. антагонистически… … Биологический энциклопедический словарь
Этилен — структурная формула, химические свойства, применение
В данной статье мы расскажем вам о многочисленных химических свойствах такого органического вещества, как этилен. Во всех подробностях разберем химические реакции с этим веществом. Помимо химических свойств обязательно рассмотрим и общее строение этилена, а также применение данного алкена, основанное на его качествах и способностях.
Характеристики этилена
Этилен, или этен, имеет структурную формулу C2 H4 и является простейшим представителем непредельных этиленовых углеводородов:

В обычных условиях данное органическое вещество является газом без цвета и запаха. А теперь можем перейти к главной теме — химическим свойствам этилена.
Главные химические свойства C2 H4
Изучение химических способностей этена будет разделено на отдельные блоки, в которых четко и детально будут расписаны подробности взаимодействий.
Реакции присоединения
Если для предельных органических соединений характерны реакции замещения, то для алкенов, в частности этилена, типичны реакции присоединения:

Реакция полимеризации
Полимеризация — это процесс соединения одинаковых простых молекул — мономеров, в более сложные — полимеры. Берется неограниченное количество молекул этилена, и при повышенных давлении и температуре, в присутствии катализатора образуется полиэтилен.
Важно! Обратите внимание, что в полиэтилене уже нет кратной связи, она разрывается в процессе реакции.
Реакции окисления
Реакция изомеризации
Данная реакция не может протекать с этиленом, потому что у него не существует изомеров.
Механизм реакции электрофильного замещения
Мы уже рассмотрели реакцию присоединения галогена к этилену. Но стоит отдельно рассказать о механизме данной реакции, который необходимо знать. В результате отталкивания от пи-связи этена в молекуле хлора происходит поляризация, благодаря которой один атом хлора становится частично положительно заряженным, а другой — частично отрицательно заряженным. Это приводит к смещению пи-связи и образованию пи-комплекса.

Применение этилена
Почему мы выделяем этот вопрос при изучении химических свойств этилена? Потому что применение данного органического вещества основано на всех его химических свойствах:
Благодаря этой статье, вы изучили и подробно рассмотрели все химические реакции, которые характерны для этилена — простейшего представителя алкенов. Перед этим кратко узнали о строении этого органического соединения, что позволило более четко взглянуть на его химическую активность в различных взаимодействиях. Мы оценили важность и пользу этена, а также его необходимость в современной жизни человека. Чтобы закрепить изученный материал, рекомендуем вам пройти тест, расположенный ниже и посмотреть познавательное видео.
Что такое молекула этилена? Какое имеет строение молекула этилена?
Содержание:
Этилен, или этен (Н2С=СН2) – первое соединение из класса алкенов. Он представляет собой бесцветный горючий газ со сладким запахом. У него низкая растворимость в воде, но высокая в органических растворителях.
Строение этилена
Молекула этилена имеет линейное строение. Угол между гибридными орбиталями равен 120 °. Длина связи между углеродными атомами – 0,134 нм.
Химическая формула этена указывает на наличие двух атомов углерода и четырех атомов водорода. Между углеродными атомами присутствует двойная связь, что указывает на sp2-гибридизацию. Для каждого атома углерода характерны три гибридных и одна негибридизованная орбитали.
Таким образом, кратная связь формируется из сигма- и пи-связи.
Между атомом углерода и водорода ковалентная слабополярная одинарная сигма-связь. Между углеродными атомами ковалентная неполярная связь.
Для молекулы этилена не характерно пространственное строение, а для дальнейших представителей гомологического ряда алкенов, начиная с пропилена, оно свойственно. Это связано с тем, что у этих соединений есть углеродные атомы в sp3-гибридном состоянии. Метильный фрагмент СН3 выходит за пределы плоскости и образует тетраэдрическое строение.
Химические свойства этилена
В природе этилен играет роль фитогормона, который влияет на рост и развитие проростков, созревание плодов, опадение листьев. Его часто используют в сельском хозяйстве. Этилен получают из этанола в специальных генераторах, откуда газ поступает в камеры с растениями. Плоды в присутствии этена дозревают за 24–48 часов. Но использование газа также может спровоцировать порчу плодов, т. к. этилен ускоряет процессы старения и увядания.
Этилен служит важным сырьем для производства полиэтилена и других полимеров, уксусной кислоты, этилбензола и других органических соединений. При окислении этена в организме человека повышается вероятность образования злокачественных опухолей.
- Как носить ремень на кителе
- при каком минимальном содержании кислорода разрешены работы внутри емкости без средств защиты