раствор какого соединения в воде называется соляной кислотой
Урок №19. Соляная кислота и её соли
Соляная кислота
Физические свойства:
Концентрированная соляная кислота – это бесцветный раствор, сильно дымящий во влажном воздухе, с резким запахом.
Получение соляной кислоты:
Соляная кислота HCl получается при растворении газа хлороводорода воде. Хлороводород можно получить действием концентрированной серной кислоты на поваренную соль.
NaCl + H 2 SO 4 = HCl↑ + NaHSO 4 (хлороводород + гидросульфат натрия)
Химические свойства:
2Al + 6HCl = 2AlCl 3 + 3H 2
3) с оксидами металлов :
MgO + 2HCl = MgCl 2 + H 2 O
4) с основаниями и аммиаком :
HCl + KOH = KCl + H 2 O
3HCl + Al(OH) 3 = AlCl 3 + 3H 2 O
HCl + NH 3 = NH 4 Cl
5) с солями :
CaCO 3 + 2HCl = CaCl 2 + H 2 O + CO 2 ↑
HCl + AgNO 3 = AgCl↓ + HNO 3
2Fe + 3Cl 2 = 2FeCl 3
Mg + 2HCl = MgCl 2 + H 2
CaO + 2HCl = CaCl 2 + H 2 O
Ba(OH) 2 + 2HCl = BaCl 2 + 2H 2 O
Pb(NO 3 ) 2 + 2HCl = PbCl 2 ↓ + 2HNO 3
Большинство хлоридов растворимы в воде (за исключением хлоридов серебра, свинца и одновалентной ртути).
Применение соляной кислоты и ее солей:
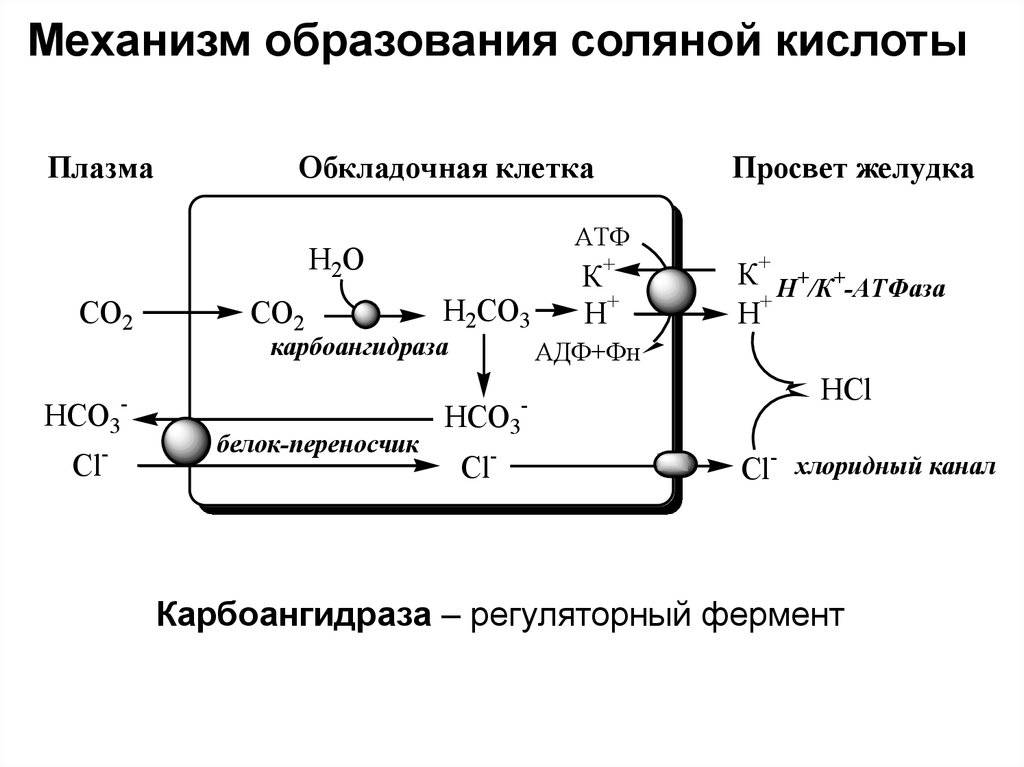
1. Соляная кислота входит в состав желудочного сока и способствует перевариванию белковой пищи у человека и животных.
2. Хлороводород и соляная кислота используются для производства лекарств, красителей, растворителей, пластмасс.
3. Применение основных солей соляной кислоты:
Задания для повторения и закрепления
№1. Осуществите превращения по схеме:
HCl → Cl 2 → AlCl 3 → Al(OH) 3 → Al 2 O 3 → AlCl 3 → Cl 2
№2. Расставьте коэффициенты методом электронного баланса в следующей реакции:
HCl + KClO 3 → KCl + H 2 O + Cl 2
Укажите окислитель и восстановитель; процессы окисления и восстановления.
Какое количество алюминия прореагирует с избытком соляной кислоты для получения 5,6 л водорода (н.у.)?
Описание соляной кислоты: формула, свойства и применение
Кислоты – это химические соединения способные отдавать протон или принимать электронную пару с образованием ковалентной связи. Данный класс веществ имеет различные классификации: по числу атомов водорода, по происхождению, по силе. Соляная кислота является сильной, одноосновной неорганической кислотой.
Формула и другие названия соляной кислоты
В состав соляной кислоты входят два химических элемента: хлор и водород. Данная кислота состоит из двух атомов и имеет формулу: HCl. Стоит отметить, что соляная кислота – это тривиальное название (т.е. название, применяемое в обиходной речи химиков, не отражающее состава). По международной номенклатуре ИЮПАК вещество с формулой HCl принято называть хлороводородной кислотой. Иногда HCl называют хлористоводородной кислотой или хлористым водородом, также приемлемо название – хлорид водорода.
Физические свойства
Физические свойства HCl коррелируют с концентрацией данного соединения в растворе. Для того, чтобы не перегружаться цифрами, рассмотрим физические свойства хлористого водорода на примере его концентрированной формы (около 36%):
Химические свойства
Химические свойства хлорида водорода можно подразделить на общие (характерные для всех соединений, основным свойство которых является отдача протона) и специфические (характерные только для HCl). Общие свойства:
Специфические свойства соляной кислоты:
Получение соляной кислоты
Промышленный способ получения хлористого водорода заключается в горении водорода в хлоре и последующим растворением образовавшегося вещества в воде. Существует и другой способ получения хлороводородной кислоты, применяемый в лабораторных условиях. Суть способа заключается в реакции поваренной соли(NaCl) с концентрированно серной кислотой при нагревании. В результате получаются следующие соединения: гидросульфат натрия и хлорид водорода, если провести химическое взаимодействие между образовавшимися продуктами, то образуется сульфат натрия и 2 молекулы хлористого водорода. Приведем общее уравнение реакции: 2NaCl + H2SO4 = Na2SO4 + 2HCl.
Области применения
Хлорид водорода является ключевым реагентом в химической промышленности, однако данное соединение нашло себе применение во многих отраслях человеческого деятельности.
В химической промышленности
В химической промышленности хлористый водород применяют для синтез хлорорганических соединений, а хлорсодержащих солей различных металлов.
В металлургии
В металлургии HCl используется с целью очистки металла после лужения (процесса нанесения олова с целью защиты металла от коррозии).
В пищевой промышленности
33% раствор HCl активно применяют в пищевом производстве в качестве регулятора pH, предназначенного для очистки воды.
В быту
В домохозяйстве HCl используют в составе моющих, хлорсодержащих средств.
В сельском хозяйстве
В сельскохозяйственной деятельности HCl применяется в составе хлорорганических веществ, которые используются в качестве органических ядохимикатов.
В медицине
В медицинской практике применяют слабые растворы хлористого водорода с целью улучшения пищеварения.
В строительстве
В строительстве HCl используют для очистки красного кирпича от грязи. Также использование растворов HCl повышает морозостойкость и влагостойкость бетонных конструкций, что способствует постройке более долгоживущих зданий.
Интересные факты
Приведем ряд фактов о хлороводородной кислоте, которые удивят обывателя:
Соляная кислота
Характеристики и физические свойства соляной кислоты
Основные физические свойства соляной кислоты приведены в таблице:
Температура плавления, o С
Температура кипения, o С
Энтальпия образования, кДж/моль
Удельная теплоемкость, кДж/(кг×К)
Получение соляной кислоты
Соляная кислота получается растворением в воде хлороводорода. В настоящее время основным способом промышленного получения хлороводорода является синтез его из водорода и хлора:
Этот процесс осуществляют в специальных установках, в которых смесь водорода и хлора непрерывно образуется и тут же сгорает ровным пламенем. Тем самым достигается спокойное (без взрыва) протекание реакции. Исходным сырьем для получения хлороводорода служат хлор и водород, образующиеся при электролизе раствора хлорида натрия.
Большие количества соляной кислоты получают также в качестве побочного продукта хлорирования органических соединений согласно уравнению реакции, представленному ниже:
где R – углеводородный радикал.
Химические свойства соляной кислоты
Соляная кислота – сильный электролит. Для нее характерны следующие химические свойства, общие для всех кислот:
— способность взаимодействовать с основаниями с образованием солей:
— способность взаимодействовать с некоторыми металлами с выделением водорода (разбавленный раствор):
— способность вступать в реакции взаимодействия с основными и амфотерными оксидами с образованием солей и воды:
— способность взаимодействовать с солями более слабых кислот:
— способность изменять цвета индикаторов, в частности, вызывать красную окраску лакмуса;
При диссоциации соляной кислоты образуются ионы водорода:
Нагревание смеси растворов соляной и азотной кислот до температуры 100-150 o С приводит к образованию очень сильного окислителя — соединения, которое называют «царская водка»:
Соляная кислота в окислительно-восстановительных реакциях может выступать и как восстановитель (за счет хлорид-аниона Cl — ) и как окислитель (за счет катиона водорода H + ). Уравнения ОВР с участием соляной кислоты приведены ниже:
Применение соляной кислоты
Соляная кислота – одна из важнейших кислот в химической практике. Ежегодное мировое производство соляной кислоты исчисляется миллионами тонн. Широкое применение находят также многие её соли.
Соляная кислота применяется в таких областях народного хозяйства как гидрометаллургия и гальванопластика, для травления, декапирования и лужения поверхности металлов; пищевом производстве, как регулятор кислотности (добавка Е507); в медицине, в качестве лекарства (смесь с ферментом пепсином) при недостаточной кислотности желудка.
Примеры решения задач
| Задание | Рассчитайте рН 0,001 М раствора соляной кислоты. |
| Решение | Для раствора сильной кислоты: |
По аналогии с раствором сильной кислоты для раствора сильного основания:
О соляной кислоте
Соляная кислота – это прозрачная бесцветная или желтоватая жидкость без взвешенных или эмульгированных частиц
Соляная кислота представляет собой раствор газообразного хлористого водорода HCl в воде. Последний представляет собой гигроскопичный бесцветный газ с резким запахом. Обычно употребляемая концентрированная соляная кислота содержит 36 – 38% хлористого водорода и имеет плотность 1, 19 г/см3. Такая кислота дымит на воздухе, так как из неё выделяется газообразный HCl; при соединении с влагой воздуха образуются мельчайшие капельки соляной кислоты. Она является сильной кислотой и энергично взаимодействует с большинством металлов. Однако такие металлы, как золото,платина, серебро, вольфрам и свинец, соляной кислотой практически не травятся. Многие недрагоценные металлы, растворяясь в кислоте, образуют хлориды, например цинк:
Чистая кислота бесцветна, а техническая имеет желтоватый оттенок, вызванный следами соединений железа, хлора и других элементов (FeCl3). Часто применяют разбавленную кислоту, содержащую 10% и меньше хлористого водорода. Разбавленные растворы не выделяют газообразного HClи не дымят ни в сухом, ни во влажном воздухе.
Применение соляной кислоты
Соляная кислота широко используется в промышленности при извлечении металлов из руд, травлении металлов и т. д. Также она используется при изготовлении паяльной жидкости, при осаждении серебра и как составная частьцарской водки.
Масштабы применения соляной кислоты в промышленности меньше, чем азотной. Связано это с тем, что соляная кислота вызывает коррозию стальной аппаратуры. К тому же летучие пары её довольно вредны и также вызывают коррозию металлических изделий. Это нужно учитывать при хранении соляной кислоты. Хранят и перевозят соляную кислоту в гуммированных цистернах и бочках, т.е. в сосудах, внутренняя поверхность которых покрыта кислотостойкой резиной, а также в стеклянных бутылях и полиэтиленовой посуде.
Соляная кислота применяется для получения хлоридов цинка, марганца, железа и других металлов, а также хлористого аммония. Соляную кислоту применяют для очистки поверхностей металлов, сосудов, скважин от карбонатов, окислов и других осадков и загрязнений. При этом используют специальные добавки — ингибиторы, которые защищают металл от растворения и коррозии, но не задерживают растворение окислов, карбонатов и других подобных соединений.
HCl применяется в промышленном производстве синтетических смол, каучуков. Используется как сырьё в производстве хлористого метила из метилового спирта, хлористого этила из этилена, хлорвинила из ацетилена.
Отравление соляной кислотой
HCl ядовит. Отравления происходят обычно туманом, образующимся при взаимодействии газа с водяными парами воздуха. HCl поглощается также на слизистых оболочках с образованием кислоты, вызывающей их сильное раздражение. При длительной работе в атмосфере HCl наблюдаются катары дыхательных путей, разрушение зубов, изъязвление слизистой оболочки носа, желудочно-кишечные расстройства. Допустимое содержание HCl в воздухе рабочих помещений не более 0, 005 мг/л. Для защиты используют противогаз, защитные очки, резиновые перчатки, обувь, фартук.
В то же время, наше пищеварение невозможно без соляной кислоты, её концентрация в желудочном соке достаточно высока. Если в организме кислотность понижена, то пищеварение нарушается, и врачи прописывают таким больным приём соляной кислоты перед началом еды.
Применение в быту соляной кислоты
Концентрированная «солянка» смешивается с водой в любой пропорции для бытовых нужд. Сильный раствор этой неорганической кислоты без труда очищает фаянсовую сантехнику от известкового налета и ржавчины, а более слабым можно убрать с тканей пятна ржавчины, чернил, ягодного сока.
Если приглядитесь, на средстве для чистки унитазов «Туалетный утенок» написано, что в состав сходит соляная кислота, поэтому работать с ним нужно в резиновых перчатках и беречь глаза от попадания в них брызг.
Кроме того, без этой кислоты немыслима жизнь ни одного человека – она содержится в желудке и именно благодаря ей пища, попавшая в желудок, растворяется (переваривается).
К тому же, эта кислота служит первым барьером от болезнетворных бактерий, попавших в желудок – они погибают в кислой среде.
Ну а людям, страдающим от гастрита с повышенной кислотностью, эта кислота тоже хорошо знакома. Они даже уменьшают ее действие, чтобы она не разрушала стенки желудка, с помощью специальных препаратов, которые взаимодействуют с ней и уменьшают ее концентрацию.
Самые популярные – это препараты, содержащие оксиды магния и алюминия, например, «Маалокс». Впрочем, есть и экстремальщики, которые пьют пищевую соду, хотя уже доказано, что это приводит лишь к временному облегчению.
Соляная кислота
Раствор хлористого водорода в воде называется соляной кислотой (HCl).
Физические свойства соляной кислоты
При обыкновенных условиях соляная кислота — прозрачная жидкость без цвета, имеет резкий неприятный запах.
В концентрированной соляной кислоте содержится 37% хлористого водорода. Такая кислота «дымит», на воздухе. Из неё выделяется хлористый водород, который с водяными парами, находящимися в воздухе, образует «туман», состоящий из мелких капелек соляной кислоты. Соляная кислота немного тяжелее воды (удельный вес 37-процентной соляной кислоты равен 1,19).
В школьных лабораториях пользуются большей частью разбавленной соляной кислотой.
Химические свойства соляной кислоты
Раствор соляной кислоты обладает кислым вкусом. Лакмус в этом растворе имеет красный цвет, а фенолфталеин остаётся бесцветным.
Вещества, окраска которых изменяется от действия щелочей и кислот, называются индикаторами.
Лакмус, фенолфталеин — индикаторы на кислоты и щёлочи. С помощью индикаторов можно определить, имеется ли в растворе кислота или щёлочь.
Соляная кислота реагирует со многими металлами. Особенно бурно происходит взаимодействие соляной кислоты с натрием. В этом легко убедиться на опыте, который можно провести в приборе.
В пробирку наливают примерно до 1 /4 её объема концентрированной соляной кислоты, укрепляют в штативе и опускают в неё небольшой кусочек натрия (величиной с горошину). Из пробирки выделяется водород, который можно поджечь, а на дно пробирки оседают мелкие кристаллики поваренной соли.
Из этого опыта следует, что натрий вытесняет водород из кислоты и соединяется с оставшейся частью её молекулы:
2Na + 2HCl = 2NaCl + H2?
При действии соляной кислоты на цинк выделяется водород, а в растворе остаётся вещество хлористый цинк ZnCl2.
Так как цинк двухвалентен, то каждый атом цинка замещает два атома водорода в двух молекулах соляной кислоты:
Zn + 2HCl = ZnCl2 + H2?
Так же действует соляная кислота на железо, алюминий и многие другие металлы.
В результате этих реакций выделяется водород, а в растворах остаются хлористые металлы: хлористое железо FeCl2, хлористый алюминий AlCl3 и др.
Эти хлористые металлы являются продуктами замещения водорода в соляной кислоте металлами.
Сложные вещества, которые можно рассматривать как продукты замещения водорода кислоты металлом, называются солями.
Реакция нейтрализации (уравнение)
Весьма важным химическим свойством соляной кислоты является ее взаимодействие с основаниями. Рассмотрим сначала взаимодействие ее со щелочами, например с едким натром.
С этой целью вольём в стеклянный стаканчик небольшое количество разбавленного раствора едкого натра и добавим к нему несколько капель раствора лакмуса.
Жидкость примет синюю окраску. Затем будем приливать небольшими порциями в тот же стаканчик раствор соляной кислоты из градуированной трубки (бюретки) до перехода окраски жидкости в стаканчике в фиолетовую. Фиолетовая окраска лакмуса показывает, что в растворе нет ни кислоты, ни щёлочи.
Na |OH + H| Cl = NaCl + H2O
Так же реагируют с соляной кислотой и другие щёлочи — едкое кали, едкий кальций.
Ознакомимся с тем, как реагирует соляная кислота с нерастворимыми основаниями, например с гидратом окиси меди. С этой целью поместим в стаканчик некоторое количество этого основания и будем приливать к нему осторожно соляную кислоту до полного растворения гидрата окиси меди.
После упаривания полученного таким образом голубого раствора получаются кристаллы хлорной меди CuCl2. На этом основании можно записать следующее уравнение:
И в этом случае произошла реакция, сходная с взаимодействием этой кислоты со щелочами: атомы водорода из молекул кислоты соединились с гидроксильными группами из молекул основания, образовались молекулы вода. Атомы меди соединились с атомами хлора (остатками от молекул кислоты) и образовали молекулы соли — хлорной меди.
Таким же образом реагирует соляная кислота и с другими нерастворимыми основаниями, например с гидратом окиси железа:
Взаимодействие кислоты с основанием, в результате которого получаются соль и вода, называется нейтрализацией.
Соляная кислота в небольших количествах содержится в желудочном соке человека и животных и играет важную роль в пищеварении.
Соляная кислота применяется для нейтрализации щелочей, получения хлористых солей. Она находит также применение в производстве некоторых пластических масс, лекарств.
Применение соляной кислоты
Соляная кислота имеет широкое применение в народном хозяйстве, и вы часто будете встречаться с ней при изучении химии.
Большие количества соляной кислоты расходуют на травление стали. В быту широко применяют никелированные, цинкованные, луженые (покрытые оловом), хромированные изделия. Для покрытия стальных изделий и листового железа слоем защитного металла с поверхности нужно сначала удалить пленку окислов железа, иначе металл к ней не пристанет. Удаление окислов достигается травлением изделия соляной или серной кислотой. Недостаток травления заключается в том, что кислота вступает в реакцию не только с окислом, но и с металлом. Чтобы этого избежать, к кислоте добавляют небольшое количество ингибитора. Ингибиторы – это вещества, которые замедляют нежелательную реакцию. Ингибированную соляную кислоту можно хранить в стальной таре и перевозить в стальных цистернах.
Раствор соляной кислоты можно купить и в аптеке. Врачи прописывают разбавленный раствор ее больным при пониженной кислотности желудочного сока.
Источник: Д.М. Кирюшкин, учебник уроков по химии для 7 класса средней школы.