супракс или сумамед что лучше при пневмонии
Врач рассказал, как защититься от бактериальной пневмонии при коронавирусе
Разбираемся, что реально помогает и нужно ли при Covid-19 сразу пить антибиотики
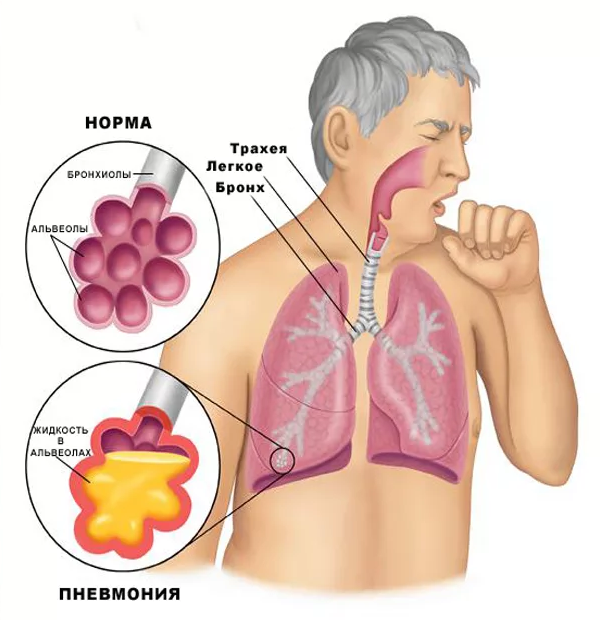
Считается, что главная угроза при коронавирусе это поражение легких. Каким образом происходит ковидное поражение, в какой момент процесс осложняется бактериальной пневмонией? Как отличить одно от другого, есть ли способ защитить себя заранее и не допустить перехода COVID-19 в пневмонию, kp.ru рассказал кандидат медицинских наук, врач-пульмонолог Сеченовского университета Владимир Бекетов.
Первое, что важно уяснить, говорит эксперт, это то, что новая коронавирусная инфекция – это инфекция вирусная и входит в группу острых респираторных вирусных инфекций. Особняком в этой группе стоит только грипп. А значит, что для COVID-19, как и для всех респираторных вирусных инфекций, поражающих верхние дыхательные пути и легкие, характерен следующий феномен. Иммунная защита в легких ослабевает. Поэтому становится возможным присоединение вторичной бактериальной супер-инфекции примерно на 5 – 9 день течения любого острого респираторного вирусного заболевания.
РИСКИ ВОЗНИКНОВЕНИЯ ПНЕВМОНИИ
Риск присоединения бактериальной инфекции при заболевании COVID-19 увеличивается, если пациент попадает в стационар и при этом имеет хроническую патологию верхних и нижних дыхательных путей (например, ХОБЛ – хроническая обструктивная болезнь легких) или сердечную недостаточность.
КАК РАЗВИВАЕТСЯ ПНЕВМОНИЯ
В условиях, сниженной дыхательной и двигательной активности, когда слизь по бронхам движется меньше, на фоне интоксикации организма и снижения иммунитета, бактерии из носоглотки спускаются в нижние отделы дыхательного тракта и могут начать там размножаться.
Таким образом, может быть вызван сначала бактериальный бронхит, потом и бронхопневмония с переходом в пневмонию. Развитию бактериальной пневмонии может способствовать и длительное нахождение пациента на аппарате ИВЛ. Не смотря на соблюдение всех строжайших мер обеззараживания аппараты ИВЛ являются факторами риска возникновения вентилятор-ассоциированных пневмоний.
ДЕЙСТВИТЕЛЬНО ЛИ ПНЕВМОНИЯ ИДЕТ СЛЕДОМ ЗА COVID-19
По словам эксперта, на сегодняшний день ряд авторитетных медицинских ассоциаций выпустили меморандумы и открытые письма с призывами к коллегам уменьшить применение антибиотиков в ходе лечения COVID-19, потому что антибиотики не дают пользы, но приносят в данном случае вред, вплоть до токсического поражения печени и развития антибиотико-ассоциированной диареи.
Сам феномен вторичной бактериальной пневмонии при коронавирусе переоценен, продолжает эксперт. Подобные процессы развиваются в основном у пациентов с сердечной недостаточностью, а для них действуют меры повышенной предосторожности, ограничения в передвижении, рекомендации по самоизоляции и лечению на дому.
ВАЖНО!
Как обезопасить себя от пневмонии?
1. Вакцинироваться от пневмококка
Самая частая причина внебольничной пневмонии – это пневмококковая инфекция. Вакцинация от пневмококка дает иммунитет на 5 – 10 лет, если вы провакцинировались 13-валентной вакциной, то она гарантирует пожизненный иммунитет. Стафилококк, стрептококк и гемофильная палочка – эти бактерии чаще всего являются причинами вторичных бактериальных пневмоний.
2. Увлажнять воздух
Увлажнение воздуха в помещении достоверно снижает риски возникновения в бронхах слизистых гнойных пробок, которые ведут к закупориванию бронхов, к образованию в бронхах сухой мокроты и развитию там инфекции. Поэтому, если влажность воздуха будет выше 40%, то есть шансы на то, что бактериальная пневмония развиваться не будет. Важно понимать, что бытовые увлажнители воздуха нужно вовремя чистить.
Антибиотики нового поколения: за и против
Антибиотики – это вещества биологического или полусинтетического происхождения. Применяются в лечебной практике для борьбы с болезнетворными микробами, вирусами. До появления этих медпрепаратов статус неизлечимых болезней был у брюшного тифа, дизентерии, пневмонии, туберкулеза. Сегодня лечение заболеваний инфекционного характера возможно с применением 1-6 поколения антибиотиков.
На этот момент фармакологическая индустрия выпускает более 2000 разновидностей лекарственных средств подобного типа. Медики описали действие около 600 позиций, а во врачебной практике используются порядка 120-160 препаратов.
Важно! При любом заболевании принимать антибиотики рекомендуется после консультации с врачом. В противном случае может развиться антибиотикорезистентность (снижение чувствительности патогенных микроорганизмов к антибактериальным средствам).
Классификация антибиотиков
Все антибактериальные средства можно разделить на 5 категорий по характеристикам и спектру применения. Рассмотрим эту классификацию подробнее:
Спектр действия
Различают антибактериальные средства:
По составу
Антибактериальные препараты делят на 6 групп:
Поколения препаратов. У передовых антимикробных препаратов насчитывается уже шесть генераций. Например, пенициллин был первым средством природного происхождения, тогда как третья или шестая генерация – это уже улучшенная версия, которая включает в состав сильнейшие ингибиторы. Зависимость прямая: чем новее генерация, тем эффективнее воздействие препаратов на патогенную микрофлору.
По способу приема. Пероральные – принимают через рот. Это различные сиропы, таблетки, растворимые капсулы, суспензии. Парентеральные – вводятся внутривенно или внутримышечно. Они быстрее дают эффект, чем пероральные лекарства. Ректальные препараты вводятся в прямую кишку.
Важно! Принимать антибиотики допускается только после консультации с врачом, иначе разовьется антибиотикорезистентность.
Антибактериальные средства нового поколения
Отличие последних генераций антибиотиков от их ранних версий в более совершенной формуле действующего вещества. Активные компоненты точечно устраняют только патологические реакции в клетке. Например, кишечные антибиотики нового поколения не нарушают микрофлору ЖКТ. При этом они борются с целой «армией» возбудителей инфекций.
Новейшие антибактериальные препараты делятся на пять групп:
Рассмотрим несколько известных противомикробных средств импортного и российского производства.
Амоксициллин – импортный противомикробный препарат из группы пенициллинов. Используется во врачебной практике для лечения бактериальной инфекции. Эффективен при кишечных инфекциях, гайморите, ангине, болезни Лайма, дизентерии, сепсисе.
Авелокс – медпрепарат последней генерации из группы фторхинолонов. Отличается сильнейшим воздействием на бактериальные и атипичные возбудители. Не вредит почкам и ЖКТ. Используется при острых, хронических заболеваниях.
Цефалоспорины – антибиотики третьего поколения. К этой группе относят Цефтибутен, Цефтриаксон и другие. Используются для лечения пиелонефрита, пневмонии. В целом это безопасные средства с малым количеством побочных действий. Однако их нужно принимать только после консультации с врачом. Медпрепаратов много, а какой именно выбрать – порекомендует специалист.
Дорипрекс – импортный противомикробный препарат синтетического происхождения. Показал хорошие результаты при лечении пневмонии, запущенных интраабдоминальных инфекций, пиелонефритах.
Инваз – антибактериальное средство из группы карбапенемов. Выпускается в ампулах для парентерального способа применения. Показывает быстрый эффект при лечении бактериальных расстройств кожи, мягких тканей, инфекциях мочевыводящих путей, пневмонии, септицемиях.
Аугметин – полусинтетический пенициллин третьей генерации с добавлением усиливающих ингибиторов. Педиатрами признается лучшим комплексным медпрепаратом для лечения детских гайморита, бронхита, тонзиллита и других инфекций дыхательных путей.
Цефамандол – антибактериальное средство российского производства. Относится к группе цефалоспоринов третьего поколения. Используется для лечения кишечных инфекций, возбудителей инфекций половых органов. Как противомикробное средство обширного диапазона воздействия применяется при простудных заболеваниях.
Лучшие антибактериальные препараты широкого диапазона действия
Противомикробные средства новой генерации обычно синтезируют из природного сырья и стабилизируют в лабораториях. Это помогает усилить эффект лекарства на патогенную микрофлору.
Какие препараты самые сильные? Врачи относят к таким антибактериальные средства широкого спектра воздействия. Приведем ниже краткий список препаратов по названиям:
Резюме
Мы рассмотрели российские и импортные антибиотики широкого спектра действия, кратко описали классификацию препаратов. Ответим на вопрос: какие антибактериальные средства выбрать?
Важно понимать, противомикробные лекарства для обширного применения обладают токсичностью, поэтому негативно влияют на микрофлору. Кроме того, бактерии мутируют, а значит препараты теряют свою эффективность. Поэтому антибактериальные средства с новейшей структурой будут в приоритете, чем их ранние аналоги.
Самолечение антибиотиками опасно для здоровья. При инфекционном заболевании первым делом нужно обратиться к врачу. Специалист установит причину болезни и назначит эффективные антибактериальные средства. Самолечение «наугад» приводит к развитию антибиотикорезистентности.
Современные методы терапии воспаления легких
Антимикробные препараты для лечения пневмонии:
β-лактамные антибиотики
• Незащищенные амоксициллины (Амоксициллин, Амоксикар, Флемоксин солютаб)
• Защищенные амоксициллины (Амоксиклав, Аугментин, Амоклав)
• Цефуроксим аксетил (Зиннат, Зинацеф, Аксеф, Цефоктам)
Макролиды
• Кларитромицин (Фромилид, Клацид, Клабакс)
• Рокситромицин (Рулицин, Рулид, Ромик)
• Азитромицин (Азибиот, Сумамед, Азимицин)
Фторхинолоны (при легочной патологии)
• Левофлоксацин (Таваник, Лебел, Левоксимед)
• Моксифлоксацин (Моксифур, Авелокс, Симофлокс)
• Гемифлоксацин (Фактив)
В структуре возбудителей внебольничной пневмонии лидирует пневмококк. Лечение подразумевает назначение защищенных β-лактамов, например, Аугментина, Амоксиклава, Уназина, Сулациллина. Спектр их активности включает стафило- и стрептококки, кишечную группу бактерий, гемофильную палочку, анаэробы.
При отсутствии устойчивости применяют цефалоспорины 3 поколения (цефотаксим, цефтриаксон, цефиксим, цефтибутен). Применяют и альтернативные вспомогательные препараты: макролиды (кларитромицин, азитромицин), фторхинолоны для лечения легочной патологии (левофлоксацин, моксифлоксацин, гемифлоксацин). В тяжелых случаях назначают резервные АПМ: ванкомицин, линезолид.
Важно! Применение нереспираторных фторхинолонов (пефлоксацин, ципрофлоксацин, норфлоксацин и др.) считается нерациональным.
Схожие принципы лечения и у внебольничной пневмонии, вызванной гемофильной палочкой или кишечной группой бактерий.
В случаях, когда возбудителем выступает золотистый стафилококк, особое внимание уделяют такому фактору, как MRSA/MSSA (метициллинрезистентный/чувствительный стафилококк). При чувствительной к метициллину разновидности MSSA применяют стандартную терапию, и выбирают один из следующих препаратов:
амоксициллин/клавуланат (Аугментин, Амоксиклав),
амоксициллин/сульбактам (Уназин, Сулациллин), цефалоспорины 3 поколения (цефотаксим, цефтриаксон, цефиксим, цефтибутен), линкозамиды (линкомицин, клиндамицин).
Если же форма пневмонии тяжёлая и обнаружен MRSA, то используют препараты резерва: линезолид, ванкомицин. Атипичные формы пневмонии лечат медикаментами из группы макролидов или тетрациклинов (доксициклин), или респираторных фторхинолонов.
Патогенетическая
Специфическая патогенетическая терапия актуальна при выявлении тяжелых и затяжных форм внебольничной пневмонии у взрослых. Патогенетическая терапия подразумевает:
• иммунозаместительную терапию;
• дезинтоксикационную терапию;
• лечение сосудистой недостаточности;
• лечение гипоксии или эффективная респираторная поддержка;
• коррекция перфузионных нарушений;
• лечение бронхиальной обструкции;
• противовоспалительная терапия.
В тяжелых случаях течения внебольничной пневмонии целесообразно усиление защитных сил. С данной целью ее можно вылечить применяя препараты иммуномодулирующего назначения (интерфероны, Левамизол, Зимозан, Диуцифон, Т-активин, Тималин, Полиоксидоний, Изопринозин).
Иммунозаместительная и иммуномодулирующая терапия назначается только по рекомендации врача, так как при сильном ослаблении организма пациента данный вид препаратов может ухудшить состояние.
При ассоциации бактерии и вируса в организме пациента целесообразно назначить антигриппозный у-глобулин, противовирусные средства (Рибавирин, интерфероны). Вирусную гриппозную пневмонию лечат препаратом Тамифлю.
В случае тяжелого стафилококкового воспаления проводят пассивную иммунизацию сывороткой (гипериммунная антистафилококковая) или стафилококковым антитоксином.
Из других способов патогенетической терапии важным является коррекция бронхиальной обструкции.
Возбудители пневмонии способствуют тому, что проходимость бронхов значительно уменьшается за счет сужения их просвета, особенно при атипичных формах воспаления.
Назначают Беродуал, Пульмикорт, Беротек, Сальбутамол, Атровент. Средства с бронхолитическим действием, т.е. направленные на расширение бронхов, лучше вводить ингаляционно. Так повышается их эффективность. Из таблетированных препаратов эффективны Теопэк и Теотард.
Используют средства, разжижающие мокроту: амброксол, АЦЦ, бромгексин Средство сочетанного действия Джосет позволяет расширить бронхи и облегчить выведение мокроты. Благоприятно воздействует и теплое щелочное питьё: молоко, минеральная вода.
К средствам неспецифической терапии относятся витамины А, С, Е, группы В. Также благоприятно влияют на восстановление организма адаптогены: элеутерококк, настойки лимонника и женьшеня.
Дезинтоксикационная
Данный вид терапии проводится с целью устранения токсического влияния на организм продуктов распада бактерий. Специфические процедуры, такие как внутривенные капельные вливания физиологического раствора, глюкозы проводятся при тяжелом состоянии. В большинстве случаев эффективным является обильное питьё.
Немедикаментозная
Наряду с лечением антибактериальными препаратами актуальна немедикаментозная поддержка организма. В первую очередь больным рекомендуют обильное щелочное питьё. Можно использовать теплое молоко или минеральную воду.
Эффективны дыхательные упражнения. Они улучшают дыхательную подвижность грудной стенки, укрепляют дыхательные мышцы. ЛФК проводят с помощью различных специальных приборов или непосредственно гимнастикой. Упражнения, так же как и другие вспомогательные мероприятия, начинают проводить не раньше 3 дня после нормализации температуры.
Возможно применение массажа (вибрационного или вакуумного). Данные процедуры проводятся также после стабильного улучшение состояния. Вибрационный массаж выполняется с помощью специальных вибромассажёров с заданной амплитудой. Для вакуумного массажа используют банки, которые благодаря созданию отрицательного давления улучшают местное кровообращение и вызывают рефлекторное раздражение, расширение сосудов. Такие процедуры облегчают дренирование лёгких, и уменьшают воспалительный процесс в альвеолярной ткани.
Физиотерапия
В качестве мероприятий, целью которых считается восстановление дренажной способности бронхов, улучшение отхождения мокроты и нормализация резистентности организма, используют физиотерапию.
Данное вспомогательное лечение назначается только после достижения показателей температуры 37°С. Среди процедур наиболее эффективными считаются:
• ингаляции бронхолитиков через небулайзер или ультразвуковой ингалятор;
• местная УВЧ терапия;
• местное УФО;
• электрофорез антимикробного препарата.
Эффективность цефалоспорина III поколения цефиксима (супракса) при заболеваниях органов дыхания у детей
Лечение острых, рецидивирующих и хронических воспалительных бронхолегочных заболеваний у детей, несмотря на достигнутые успехи, остается одной из важных и далеко не решенных проблем педиатрии и детской пульмонологии. Антибиотикотерапия является одним из
Лечение острых, рецидивирующих и хронических воспалительных бронхолегочных заболеваний у детей, несмотря на достигнутые успехи, остается одной из важных и далеко не решенных проблем педиатрии и детской пульмонологии. Антибиотикотерапия является одним из важнейших компонентов комплексного лечения заболеваний органов дыхания у детей. Оптимизация антибиотикотерапии при лечении заболеваний органов дыхания должна подчиняться основным принципам, с одной стороны, соответствия строгим показаниям и адекватного выбора наиболее эффективного препарата с учетом антибиотикограммы и, с другой — отказа от необоснованного назначения антибиотика. Необходимо учитывать тяжесть течения и период заболевания, чувствительность микрофлоры бронхов к назначенному препарату, наличие и характер побочных явлений антибиотика, а также дозу препарата с учетом возрастных особенностей. Выбор антибактериального препарата и путей его введения у детей до сих пор представляет сложную задачу для врача, особенно при рецидивирующих и хронических бронхолегочных заболеваниях.
В настоящее время фармацевтическая промышленность располагает огромным арсеналом антибактериальных пероральных средств, которые находят широкое применение в практике в связи с наличием лекарственных форм, предназначенных для детей, в виде суспензий, сиропов, таблеток с соответствующей дозировкой. Оценивая классические пути введения антибиотиков, а именно парентеральный (внутривенный и внутримышечный) и пероральный, в ряде случаев у детей следует отдать предпочтение последнему, как наиболее щадящему, исключающему психотравмирующий эффект. Парентеральный путь введения препарата, зарекомендовавший себя как основной метод лечения болезней органов дыхания, при многих несомненных достоинствах (точность дозирования, высокие пиковые концентрации) не лишен недостатков. Это, в первую очередь, связано с опасностью возможного переноса инфекции, вероятностью послеинъекционных осложнений, а также психотравмирующим действием инъекций как болезненного фактора. Все это диктует необходимость дифференцированного подхода к выбору методов введения антибиотиков и разумного ограничения показаний к парентеральному введению препаратов у детей.
Особого внимания заслуживает также внедрение в детскую практику «ступенчатого» метода лечения, сокращающего сроки парентерального введения антибиотиков до 2–5 дней. Он заключается в переходе на прием адекватного антибиотика внутрь перорально при наметившемся положительном клиническом эффекте.
Трудно переоценить значение создания новых пролонгированных форм антибиотиков, способствующих сокращению кратности их введения и обладающих не только широким спектром действия, но и низкой токсичностью, что особенно важно для детей.
Использование антибиотиков внутрь, особенно пролонгированных форм, значительно уменьшает риск распространения инфекционных заболеваний, снижает нагрузку на медицинский персонал и позволяет шире применять препараты как в стационаре, так и в поликлинических условиях.
Однако следует подчеркнуть, что прием антибиотиков внутрь (оральная антибактериальная терапия) как стартовое лечение наиболее показано при легких и среднетяжелых формах болезни, в том числе при заболеваниях верхних дыхательных путей, неосложненных острых пневмониях и обострениях хронических и рецидивирующих воспалительных бронхолегочных заболеваний.
Многолетний клинико-бактериологический мониторинг, проведенный в НИИ педиатрии НЦЗД РАМН, позволил установить, что микробный спектр при хронических бронхолегочных заболеваниях у детей в периоде обострения представлен в основном 3 пневмотропными микроорганизмами [1]. При этом Haemophilus influenzae является доминирующим причинным фактором инфекционного процесса, составляя 61–70%, из которых в 27% случаев она находится в ассоциации с Streptococcus pneumonia. Streptococcus pneumoniae выделяется у 36% больных. Значительно реже определяется участие в этиологии хронического воспаления Branchamella catarrhalis — 4–10%, Рroteus mirabilis — 2,2%, Klebsiella pneumoniae — 1,1%, Streptococcus pyogenes — 1,1%, Staphylococсus aureus — 0,1% [1].
Учитывая распространенность устойчивых к препаратам пенициллинового ряда и макролидам штаммов микроорганизмов, а также их высокую b-лактамазную активность, в том числе Haemophilus influenzae и Branchamella catarrhalis, препаратами выбора при рецидивирующих и хронических заболеваниях органов дыхания являются цефалоспорины II и III поколения.
Сравнительное изучение бактериологической активности цефалоспоринов I, II и III поколений по отношению к пневмотропным бактериям, выделяемым при бронхолегочных заболеваниях у детей, позволило установить высокую бактериологическую активность цефалоспоринов III поколения (табл. 1). При этом четко показано отсутствие существенной разницы в активности парентеральных и пероральных форм антибиотиков по отношению к основным этиологически значимым микробам при данной патологии [2]. Все это обосновывает применение пероральных форм цефалоспориновых антибиотиков III поколения при рецидивирующих и хронических бронхолегочных заболеваниях.
В последние годы внимание педиатров привлечено к полусинтетическому оральному цефалоспориновому антибиотику III поколения цефиксиму (супраксу), характеризующемуся широким спектром действия и высокой активностью в отношении грамотрицательных микроорганизмов: Haemophilus influenzae, Branchamella catarrhalis, в том числе лактамазообразующих бактерий, большинства штаммов энтеробактерий, таких, как Klebsiella pneumoniae, Escherichia coli и пр., а также в отношении протеев [3,4,5].
Супракс обладает бактерицидным механизмом действия, и по степени активности против Haemophilus influenzae и Branchamella catarrhalis он не уступает парентеральным цефалоспоринам III поколения, характеризуется пролонгированной фармакокинетикой, созданием эффективной концентрации в крови и очагах воспаления, в тканях и жидкостях организма. Важным является образование эффективной концентрации цефиксима в мокроте (0,016-0,04), в легочной ткани (0,04-0,22) и в других тканях верхних дыхательных путей. Минимальная подавляющая концентрация цефиксима составляет: в отношении Streptococcus pneumoniae — 0,01-0,25, Haemophilus influenzae — 0,06-0,25, Branchamella catarrhalis — 0,01-0,8 (3,6). Достоинство препарата заключается также в наличии детской лекарственной формы для приема внутрь в виде суспензии (для детей в возрасте от 6 месяцев до 8 лет в дозе 8 мг на 1 кг массы) и капсул (для детей старше 12 лет в дозе 400 мг), обладающих пролонгированным действием, что обеспечивает однократный прием антибиотика.
Основными показаниями для назначения цефиксима (супракса) у детей являются заболевания верхних и нижних дыхательных путей при установленной или вероятной этиологии воспаления, вызванной чувствительными штаммами микробов (табл. 2).
Курс лечения цефиксимом (супраксом) при острой пневмонии составляет 7–10 дней, при обострении рецидивирующего бронхита — 7–10 дней, при обострении хронических воспалительных бронхолегочных заболеваний — 10–14 дней и более.
Высокая клиническая и бактериологическая эффективность цефиксима (супракса) доказана, в том числе при многоцентровых исследованиях у детей при заболеваниях органов дыхания [4, 5, 6, 7, 8].
Нами проведено изучение эффективности и безопасности супракса у 61 ребенка в возрасте 3–15 лет при обострениях рецидивирующего бронхита (15 детей), хронических воспалительных бронхолегочных заболеваний (46 детей), развившихся в результате неблагоприятного исхода острых пневмоний с формированием хронического бронхита на основе пневмосклероза, деформации бронхов и бронхоэктазов, а также на фоне врожденных пороков развития бронхов и легких. Все дети в периоде обострения бронхолегочного процесса получали наряду с супраксом комплексную терапию, включающую муколитические, мукорегуляторные и бронхоспазмолитические препараты по показаниям, кинезитерапию. Клиническая эффективность выявлена у 54 из 61 (88,6%) больного. Она характеризуется:
Клиническая эффективность препарата подтверждается результатами бактериологических исследований. Эрадикация микробов из мокроты или бронхиального секрета к 6-7-му дню лечения супраксом наблюдалась:
Однако у 4 детей при эрадикации Haemophilus influenzae на фоне приема цефиксима был выделен Streptococcus pneumoniae. Возможно, у этих больных имела место реинфекция.
Как правило, дети хорошо переносили препарат, и побочных эффектов не наблюдалось.
В заключение следует отметить высокую эффективность нового перорального цефалоспоринового антибиотика III поколения цефиксима (супракса) при лечении острых, рецидивирующих и хронических воспалительных заболеваний органов дыхания у детей. Наличие детской лекарственной формы (суспензии), пероральный способ приема 1 раз в сутки, широкий спектр действия, высокая чувствительность основных этиологически значимых бактерий, отсутствие выраженных побочных эффектов, щадящий метод лечения — все это ставит препарат в число перспективных антибактериальных средств в педиатрической практике, что особенно важно при нарастании резистентности микробов к другим антибиотикам. Эти качества позволяют применять супракс у детей раннего и старшего возраста не только в стационаре, но и в амбулаторных условиях при заболеваниях органов дыхания, в том числе при лечении рецидивирующих и хронических заболеваний органов дыхания.
По вопросам литературы обращайтесь в редакцию.
Е. В. Середа, доктор медицинских наук, профессор
Л. К. Катосова, доктор биологических наук, профессор
И. К. Волков, доктор медицинских наук
Научный центр здоровья детей РАМН, Москва