таблица менделеева в хорошем качестве металлы неметаллы
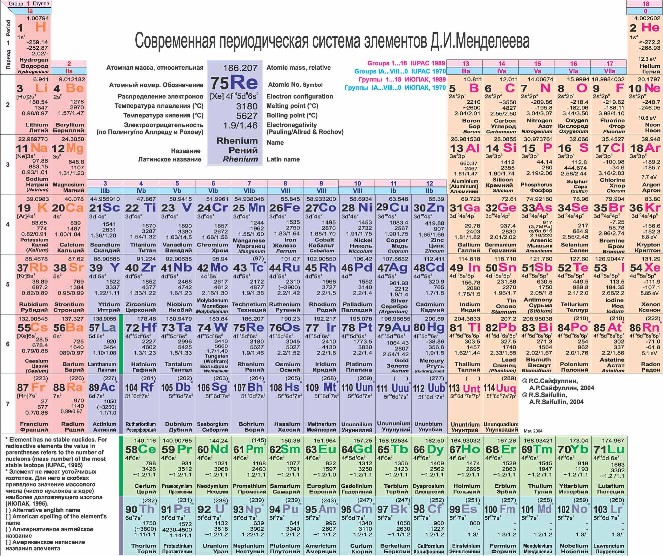
Периодическая таблица Менделеева
Щелочно земельные металлы
Периодической системой химических элементов принято называть таблицу, в которой химические элементы классифицируются по разным свойствам, определяемым зарядом атомного ядра. Называют ее периодической таблицей Менделеева, в честь российского ученого-химика Д.И. Менделеева. Именно он в 1869 году открыл периодический закон химических элементов.
В 1869-1871 был разработан самый первый вариант таблицы, в котором определялась зависимость свойств химических элементов от атомной массы. Было выдвинуто множество предложений относительно того, как изображать свойства элементов. Это были различные геометрические фигуры, графики с аналитическими кривыми.
Но ученые приняли решение, что удобнее всего двухмерная химическая таблица, где каждый столбик указывает на физико-химические свойства определенного элемента, а в строках определяются периоды элементов, максимально близких один к другому.
Значение таблицы Менделеева для науки
Развитие химии в значительной степени обязано открытию, сделанному Менделеевым, в частности, оно способствовало развитию учения про атомы и молекулы.
Благодаря этому было получено понятное представление про простые и сложные химические соединения. Человек может понять, что такое элементы, которые используются сегодня. В ХХ веке периодическая система начала играть прогнозирующую роль, когда оцениваются химические свойства трансурановых элементов, которую показал еще сам Менделеев.
Периодическая таблица позволила систематизировать типы атомов, что имела большое значение для развития физики (атом и его ядро) в ХХ веке. Так, в начале века ученые проводили исследования, в ходе которых было установлено, что порядковый номер элемента является мерой электронного заряда его атомного ядра.
Номер же периода в таблице указывает на число электронных оболочек, которыми обладает атом. На фото было установлено, что номером вертикального ряда таблицы определяется квантовая структура внешней оболочки элемента (этим обусловлен тот факт, что химические свойства у элементов, которые находятся в одном ряду, схожи между собой).
Сделанное Менделеевым открытие положило начало новой эры в мировой науке, что позволило сделать огромный прорыв в химии и ряде других направлениях науки. Таблица Менделеева в хорошем качестве стала основой сведений про элементы, ее использование позволило делать важные выводы в науке, прогнозировать открытия.
В чем особенность периодической таблицы Менделеева?
Одним из важных свойств таблицы можно назвать то, что у группы элементов (колонка) более выражена периодическая тенденция, если сравнивать с периодами или блоками.
Также можно увидеть, что по мере того, как возрастает атомная масса, стабильно изменяются свойства. Так, к примеру, фотография таблицы дает возможность увидеть, что в блоках D и F более явно выражены горизонтальные свойства, а не вертикальные.
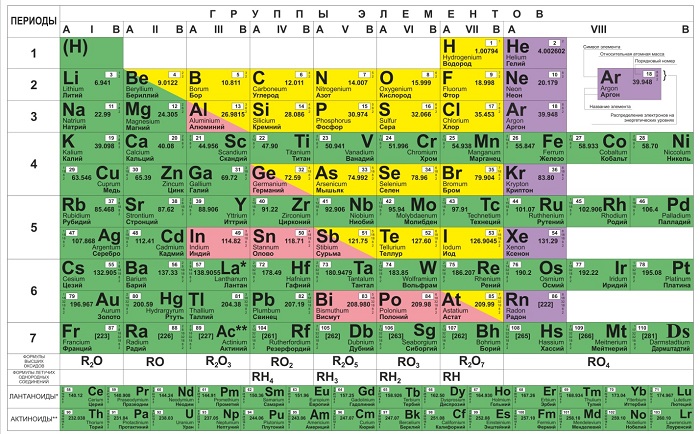
Группам таблицы Менделеева с лева на право присвоено номера 1-18, в соответствии с международной системой названия групп. Ранее использовались римские цифры.
Вступление в силу новой системы нотации ИЮПАК (1988 г.), которой пользуются и сегодня, привело к тому, что прежние идентификаторы групп перестали существовать.
У многих групп появились травиальные несистематические названия, к примеру, «галогены», «щелочноземельные металлы» и др.
Химические элементы из одной группы периодической таблицы Менделеева проявляют тенденции по таким параметрам:электроотрицательность, атомный радиус, энергия ионизации.
Так, картинка химической таблицы показывает, что в одной группе сверху в низ возрастает радиус атома, валентные электроны элемента удаляются от ядра по мере того, как заполняются энергетические уровни. Энергия ионизации при этом снижается, связи в атоме слабеют, в результате чего изымать электроны проще. Сверху вниз у элементов снижается электроотрицательность, что объясняется увеличением расстояния между ядром и валентными электронами. Но в таблице есть и исключения из таких закономерностей, к примеру, в 11 группе данный показатель растет сверху вниз.
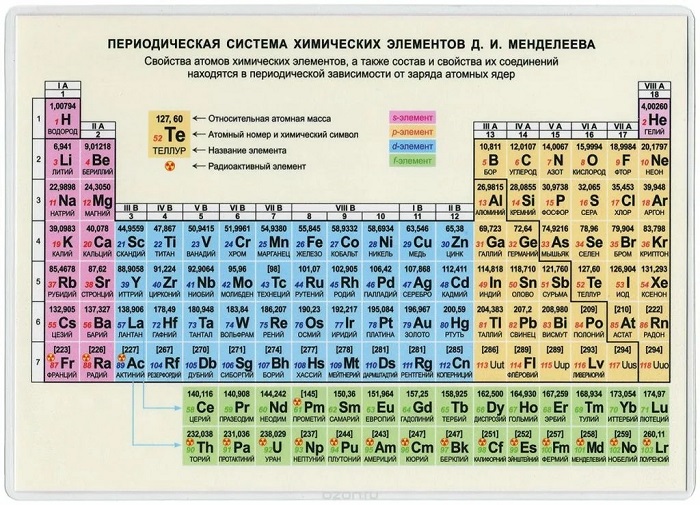
Периодическая таблица химических элементов Д.И.Менделеева
В природе существует очень много повторяющихся последовательностей:
В середине 19 века Д.И.Менделеев заметил, что химические свойства элементов также имеют определенную последовательность (говорят, что эта идея пришла ему во сне). Итогом чудесных сновидений ученого стала Периодическая таблица химических элементов, в которой Д.И. Менделеев выстроил химические элементы по возрастанию атомной массы. В современной таблице химические элементы выстроены по возрастанию атомного номера элемента (количество протонов в ядре атома).
Под таблицей расположены лантаноиды и актиноиды.
| Горизонтальные строки Периодической таблицы называют периодами. Периоды имеют номера от 1 до 7. |
| Вертикальные столбцы Периодической таблицы называют группами (семействами). Для нумерации групп изначально применялись римские цифры и буквы (IA, IIA, IIIB…). Ныне для обозначения групп используют номера от 1 до 18. |
Металлы, неметаллы, металлоиды
Металлы
Металлы расположены в Периодической таблице слева от ступенчатой диагональной линии, которая начинается с Бора (В) и заканчивается полонием (Po) (исключение составляют германий (Ge) и сурьма (Sb). Нетрудно заметить, что металлы занимают бОльшую часть Периодической таблицы. Основные свойства металлов: твердые (кроме ртути); блестят; хорошие электро- и теплопроводники; пластичные; ковкие; легко отдают электроны.
Неметаллы
Элементы, расположенные справа от ступенчатой диагонали B-Po, называются неметаллами. Свойства неметаллов прямо противоположны свойствам металлов: плохие проводники тепла и электричества; хрупкие; нековкие; непластичные; обычно принимают электроны.
Металлоиды
Между металлами и неметаллами находятся полуметаллы (металлоиды). Для них характерны свойства как металлов, так и неметаллов. Основное применение в промышленности полуметаллы нашли в производстве полупроводников, без которых немыслима ни одна современная микросхема или микропроцессор.
Периоды и группы
Как уже говорилось выше, периодическая таблица состоит из семи периодов. В каждом периоде атомные номера элементов увеличиваются слева направо.
В группах же, наоборот, все элементы обладают одинаковыми свойствами. Например, в группе IA(1) все элементы, начиная с лития (Li) и заканчивая францием (Fr), отдают один электрон. А все элементы группы VIIA(17), принимают один элемент.
Некоторые группы настолько важны, что получили особые названия. Эти группы рассмотрены ниже.
Щелочные металлы
Группа IA(1). Атомы элементов этой группы имеют во внешнем электронном слое всего по одному электрону, поэтому легко отдают один электрон.
Щелочноземельные металлы
Галогены
Группа VIIA(17). Атомы элементов этой группы обычно получают по одному электрону, т.к. на внешнем электронном слое находится по пять элементов и до «полного комплекта» как раз не хватает одного электрона.
Инертные (благородные) газы
Валентные элементы в группах
Нетрудно заметить, что внутри каждой группы элементы похожи друг на друга своими валентными электронами (электроны s и p-орбиталей, расположенных на внешнем энергетическом уровне).
Обратим теперь свое внимание на элементы, расположенные в группах с символов В. Они расположены в центре периодической таблицы и называются переходными металлами.
Отличительной особенностью этих элементов является присутствие в атомах электронов, заполняющих d-орбитали:
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Крупная, многогранная и неоднозначная группировка химических элементов порождает немало вопросов на тему того, как пользоваться таблицей Менделеева. Между тем, это самый полный и завершенный вариант сортировки атомов всех веществ этой планеты.
Область применения данной классификации – не только химия или иные точные и естественные науки. Полезна она будет и простому обывателю для тренировки памяти или приспособлению к большим и сложным формулировкам и документам. С должным усердием и прилежанием в изучении таблицы, она станет легко понимаемым справочным материалом.
Периодическая таблица Менделеева
До Дмитрия Ивановича собрать элементы в один список пытались многие умы Европы. С начала XIX века они предприняли множество попыток сопоставления веществ.
В 1869 г. свой первый план представляет и Менделеев, через 2 года – завершает доработку и издает последний вариант таблицы.
Основная идея группировки – периодичность. Расположив элементы в порядке увеличения атомной массы, он заметил, что время от времени их свойства повторяются.
Ко 2-й половине XIX века миру было известно намного меньше веществ, чем сегодня, так что химик оставил пустые места в своей таблице, предполагая открытие новых элементов, и даже сумел заранее определить свойства открытых впоследствии галлия Ga 31 и германия Ge 32.
С каждым последующим номером элемента возрастает его атомная масса, заряд ядра, уровень электронов (количество элементов и их связей), показатели активности повторяются в зависимости от периода.
Формулировка периодического закона химических элементов
Русский ученый составлял наброски таблицы около 20 лет, пытаясь подобрать верную закономерность в их размещении. Отметив концепцию цикличности, он превратил её в периодический закон, изложив свое понимание правила:
«Свойства элементов, как и формируемых ими простых и сложных веществ, предполагают периодическую зависимость от их атомного веса».
Как читать таблицу Дмитрия Ивановича Менделеева
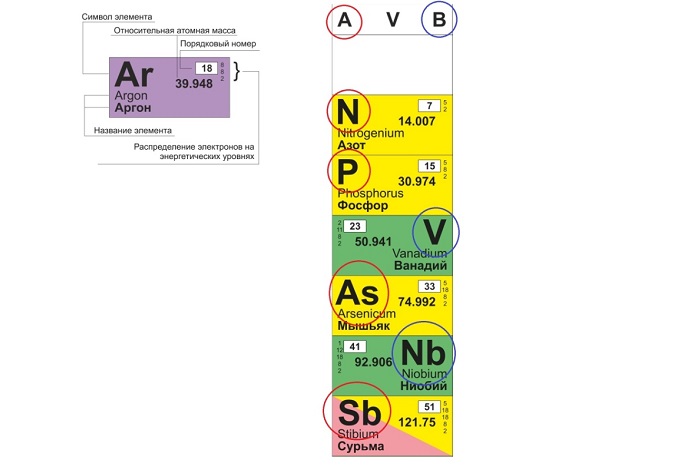
Ячейки химической базы данных разбиты в группы последовательностей по горизонтали и вертикали. Элементы имеют краткое обозначение из 1-3 букв (для формул и вычислений).
Группы
Представлены в виде столбцов таблицы. В системе старого образца их 8.
В настоящий же момент выделено 18.
Распределяют элементы в группы по однотипности: по строению атома они подобны друг другу. Также у представителей одного столбца схожая формула высшего оксида.
Традиционные типы столбцов делятся на подкатегории: А (с яркими признаками группы) и В (переходные металлы). Принадлежность зависит от положения символа (слева для A или справа для B):
Периоды
Горизонтальные цепочки в таблице, в которых элементы расположены по росту порядкового номера. В линии слева направо увеличиваются заряды ядра атомов.
1-й период содержит лишь гелий He 2 и водород H 1 ;
2 и 3 содержат по 8 компонентов;
4-й и 5-й содержат 18 единиц каждый;
6-й период вмещает 32 элемента;
7-й хранит 31 единицу и продолжает дополняться.
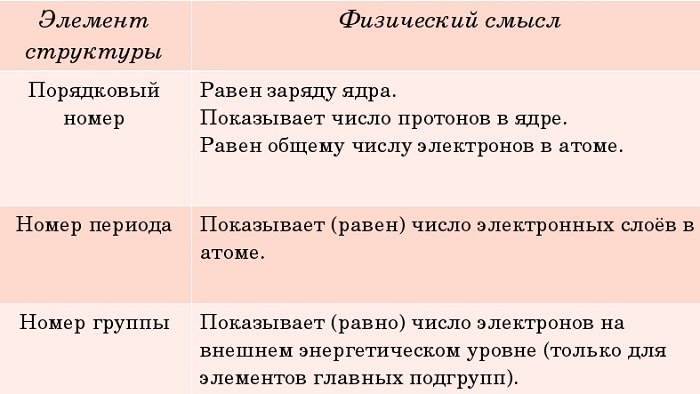
Физический смысл порядкового номера
Порядковый номер химического элемента также показывает, сколько в составе ядра атома протонов и сколько электронов вращается вокруг него.
Свойства таблицы Менделеева
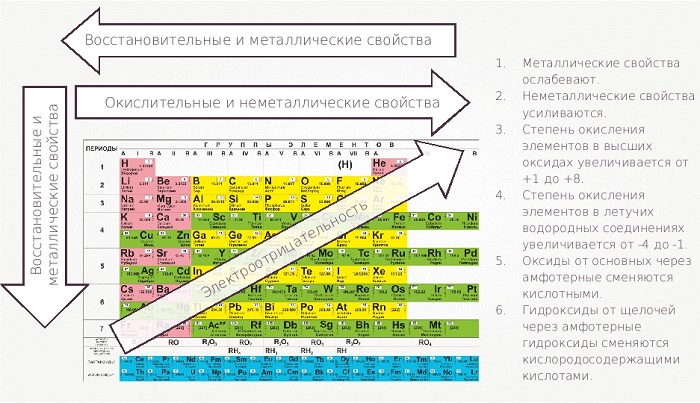
Химические элементы оцениваются по множеству параметров. Один из основных – окислительно-восстановительные свойства.
С убыванием в периоде и возрастанием в группе (стремление к левому нижнему углу) проявляются металлические характеристики, обратное направление в правый верхний угол увеличивает окислительные неметаллические качества.
Элементы таблицы Менделеева
Также есть класс «металлоподобных» полупроводников с неопределенным статусом. Отдельно располагаются благородные газы, не подверженные реакциям.
Часть элементов с номером более 100 открыта сравнительно недавно, их принадлежность к каким-либо группам только предположительна.
Щелочные и щелочноземельные элементы
Щелочные металлы имеют серебристый отблеск, хорошо разламываются и режутся. Из всех размещенных в таблице металлов активнее других вступают в реакцию с молекулами других веществ, отдавая единственный свободный электрон. При контакте с водой создают гидроксиды – щелочи:
Щелочноземельные металлы более твердые и тугоплавкие, с бледно-серым оттенком. В их список входят:
Большая часть из них способна создавать щелочь, но не так легко расстается с двумя незанятыми электронами. Другие металлы они замещают, но перед щелочными бессильны и вытесняются ими из молекул.
Лантаноиды и актиноиды
Прежде получили название редкоземельных металлов из-за малого количества месторождений и трудностей в выводе чистого металла из соединений. Им соответствует 3 (III B) группа, хотя это иногда оспаривается.
В рамках семейства лантаноиды («скрытые») имеют схожую форму атома и внешние признаки, но различаются свойствами. Поодиночке почти не встречаются.
Актиноиды, помимо общих черт, радиоактивны. В природе, кроме, урана U 92, почти не встречаются, создаются искусственно.
Для удобства обе группы элементов выведены в 2 строки под общей таблицей.
Галогены и благородные газы
17 (VII A) группа состоит из галогенов:
В противоположность щелочам, эти неметаллы – самые сильные окислители, активно принимающие 8-й электрон к имеющимся семи для заполнения внешней оболочки.
Самый реактивный – фтор F 9 (способен разрушать молекулы воды):
С ростом периода свойства элементов слабеют.
Все галогены токсичны, опасны для жизни, поражают дыхательные пути.
В последней, VIII A или 18 группе, находятся инертные газы:
Их внешний уровень электронов равен 8 (полностью заполнен), отчего они не способны вступать в реакцию с другими атомами. Крайне редко создают непрочные молекулы, распадающиеся при нагревании.
Переходные металлы
Представлены всеми подгруппами в традиционной системе или занимают с 3 по 12 столбцы в современных таблицах. Большинство обладает металлическим блеском, по цвету и состоянию различаются (большинство – твердые, но есть исключения, например, жидкая ртуть).
Могут отдавать разное количество электронов с нескольких оболочек для создания вещества (например, титан Ti 22 и железо Fe 26 способны отдавать от 2 до 4, медь Cu 29 – от 1 до 2, цинк Zn 30 – только 2, золото Au 79 и серебро Ag 47 практически не вступают в реакцию).
Металлоиды
Располагаются на стыке посреди легких металлов и неметаллов, в диагонали с 13 по 17 группах. В своем большинстве – полупроводники (хуже металлов проводят электрический ток).
Часть из них – металлы внешне, неметаллы по активности, часть – наоборот. Бор B 5, к примеру, является неметаллом с полупроводниковыми качествами.
Постпереходные металлы
Они же «легкие». От переходных аналогов отличаются меньшей твердостью и весом. Имеют иные температуры плавления и кипения. Для соединений отдают электроны только с внешней оболочки. Превосходят полуметаллы по восстановительности. Легкий металл выглядит как вещество с матовым оттенком вместо блеска.
Размещаются после переходных металлов под полупроводниками (в 13-17 столбцах или IIIA – VIIA). Алюминий Al 13 носит неопределенный статус (иногда причисляется к металлоидам).
Неметаллы
Располагаются в правом верхнем углу между полуметаллами и инертными газами (начала 13-17 групп). Имеют больше электронов на внешней оболочке, стремятся присоединить к себе еще больше (в противоположность металлам), чтобы набрать полный уровень электронов.
в виде газа (кислород O 8, азот N 7);
жидкости (бром Br 35);
в твердом (углерод C 6, кремний Si 14) состоянии.
Интересное положение занимает водород H 1. Его причисляют то к 1, то к 17 группе: он, будучи неметаллом, может проявлять и окислительные, и восстановительные свойства.
Заключение
При детальном рассмотрении таблица Менделеева уже не кажется столь огромной. Главные моменты в пользовании – отследить группу и период элемента, после чего будет несложно определить его свойства и показатели.
Различные картинки в 8 или 18 столбцов не будут поводом для замешательства: семейства и категории выделяются разными цветами (полуметаллы – двухцветные). Ученики найдут решение задач, а любители головоломок получат новый способ тренировки мышления. Ячейка с нужными обозначениями найдется без особых препятствий.
ПЕРИОДИЧЕСКАЯ ТАБЛИЦА МЕНДЕЛЕЕВА
Еще в школе, сидя на уроках химии, все мы помним таблицу на стене класса или химической лаборатории. Эта таблица содержала классификацию всех известных человечеству химических элементов, тех фундаментальных компонентов, из которых состоит Земля и вся Вселенная. Тогда мы и подумать не могли, что таблица Менделеева бесспорно является одним из величайших научных открытий, который является фундаментом нашего современного знания о химии.

На первый взгляд, ее идея выглядит обманчиво просто: организовать химические элементы в порядке возрастания веса их атомов. Причем в большинстве случаев оказывается, что химические и физические свойства каждого элемента сходны с предыдущим ему в таблице элементом. Эта закономерность проявляется для всех элементов, кроме нескольких самых первых, просто потому что они не имеют перед собой элементов, сходных с ними по атомному весу. Именно благодаря открытию такого свойства мы можем поместить линейную последовательность элементов в таблицу, очень напоминающую настенный календарь, и таким образом объединить огромное количество видов химических элементов в четкой и связной форме. Разумеется, сегодня мы пользуемся понятием атомного числа (количества протонов) для того, чтобы упорядочить систему элементов. Это помогло решить так называемую техническую проблему «пары перестановок», однако не привело к кардинальному изменению вида периодической таблицы.
В периодической таблице Менделеева все элементы упорядочены с учетом их атомного числа, электронной конфигурации и повторяющихся химических свойств. Ряды в таблице называются периодами, а столбцы группами. В первой таблице, датируемой 1869 годом, содержалось всего 60 элементов, теперь же таблицу пришлось увеличить, чтобы поместить 118 элементов, известных нам сегодня.
Периодическая система Менделеева систематизирует не только элементы, но и самые разнообразные их свойства. Химику часто бывает достаточно иметь перед глазами Периодическую таблицу для того, чтобы правильно ответить на множество вопросов (не только экзаменационных, но и научных).
The YouTube ID of 1M7iKKVnPJE is invalid.
Периодический закон
Существуют две формулировки периодического закона химических элементов: классическая и современная.
Классическая, в изложении его первооткрывателя Д.И. Менделеева: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов.
Современная: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).
Графическим изображением периодического закона является периодическая система элементов, которая представляет собой естественную классификацию химических элементов, основанную на закономерных изменениях свойств элементов от зарядов их атомов. Наиболее распространёнными изображениями периодической системы элементов Д.И. Менделеева являются короткая и длинная формы.
Группы и периоды Периодической системы
Группами называют вертикальные ряды в периодической системе. В группах элементы объединены по признаку высшей степени окисления в оксидах. Каждая группа состоит из главной и побочной подгрупп. Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов. Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.
Периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров. В периодической системе имеются семь периодов: первый, второй и третий периоды называют малыми, в них содержится соответственно 2, 8 и 8 элементов; остальные периоды называют большими: в четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент. Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
Физический смысл порядкового номера химического элемента: число протонов в атомном ядре и число электронов, вращающихся вокруг атомного ядра, равны порядковому номеру элемента.
Свойства таблицы Менделеева
Напомним, что группами называют вертикальные ряды в периодической системе и химические свойства элементов главных и побочных подгрупп значительно различаются.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения, существует всего восемь форм кислородных соединений. В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где символом R обозначают элемент данной группы. Формулы высших оксидов относятся ко всем элементам группы, кроме исключительных случаев, когда элементы не проявляют степени окисления, равной номеру группы (например, фтор).
Оксиды состава R2O проявляют сильные основные свойства, причём их основность возрастает с увеличением порядкового номера, оксиды состава RO (за исключением BeO) проявляют основные свойства. Оксиды состава RO2, R2O5, RO3, R2O7 проявляют кислотные свойства, причём их кислотность возрастает с увеличением порядкового номера.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют четыре формы таких соединений. Их располагают под элементами главных подгрупп и изображают общими формулами в последовательности RH4, RH3, RH2, RH.
Соединения RH4 имеют нейтральный характер; RH3 — слабоосновный; RH2 — слабокислый; RH — сильнокислый характер.
Напомним, что периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.
В пределах периода с увеличением порядкового номера элемента:
Элементы таблицы Менделеева
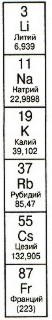
Щелочные и щелочноземельные элементы
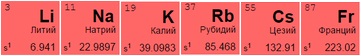
К ним относятся элементы из первой и второй группы периодической таблицы. Щелочные металлы из первой группы — мягкие металлы, серебристого цвета, хорошо режутся ножом. Все они обладают одним-единственным электроном на внешней оболочке и прекрасно вступают в реакцию. Щелочноземельные металлы из второй группы также имеют серебристый оттенок. На внешнем уровне помещено по два электрона, и, соответственно, эти металлы менее охотно взаимодействуют с другими элементами. По сравнению со щелочными металлами, щелочноземельные металлы плавятся и кипят при более высоких температурах.
| Щелочные металлы | Щелочноземельные металлы |
| Литий Li 3 | Бериллий Be 4 |
| Натрий Na 11 | Магний Mg 12 |
| Калий K 19 | Кальций Ca 20 |
| Рубидий Rb 37 | Стронций Sr 38 |
| Цезий Cs 55 | Барий Ba 56 |
| Франций Fr 87 | Радий Ra 88 |
Лантаниды (редкоземельные элементы) и актиниды
Лантаниды — это группа элементов, изначально обнаруженных в редко встречающихся минералах; отсюда их название «редкоземельные» элементы. Впоследствии выяснилось, что данные элементы не столь редки, как думали вначале, и поэтому редкоземельным элементам было присвоено название лантаниды. Лантаниды и актиниды занимают два блока, которые расположены под основной таблицей элементов. Обе группы включают в себя металлы; все лантаниды (за исключением прометия) нерадиоактивны; актиниды, напротив, радиоактивны.
| Лантаниды | Актиниды |
| Лантан La 57 | Актиний Ac 89 |
| Церий Ce 58 | Торий Th 90 |
| Празеодимий Pr 59 | Протактиний Pa 91 |
| Неодимий Nd 60 | Уран U 92 |
| Прометий Pm 61 | Нептуний Np 93 |
| Самарий Sm 62 | Плутоний Pu 94 |
| Европий Eu 63 | Америций Am 95 |
| Гадолиний Gd 64 | Кюрий Cm 96 |
| Тербий Tb 65 | Берклий Bk 97 |
| Диспрозий Dy 66 | Калифорний Cf 98 |
| Гольмий Ho 67 | Эйнштейний Es 99 |
| Эрбий Er 68 | Фермий Fm 100 |
| Тулий Tm 69 | Менделевий Md 101 |
| Иттербий Yb 70 | Нобелий No 102 |
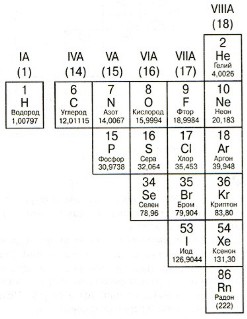
Галогены и благородные газы
Галогены и благородные газы объединены в группы 17 и 18 периодической таблицы. Галогены представляют собой неметаллические элементы, все они имеют семь электронов во внешней оболочке. В благородных газахвсе электроны находятся во внешней оболочке, таким образом с трудом участвуют в образовании соединений. Эти газы называют «благородными, потому что они редко вступают в реакцию с прочими элементами; т. е. ссылаются на представителей благородной касты, которые традиционно сторонились других людей в обществе.
| Галогены | Благородные газы |
| Фтор F 9 | Гелий He 2 |
| Хлор Cl 17 | Неон Ne 10 |
| Бром Br 35 | Аргон Ar 18 |
| Йод I 53 | Криптон Kr 36 |
| Астат At 85 | Ксенон Xe 54 |
| — | Радон Rn 86 |
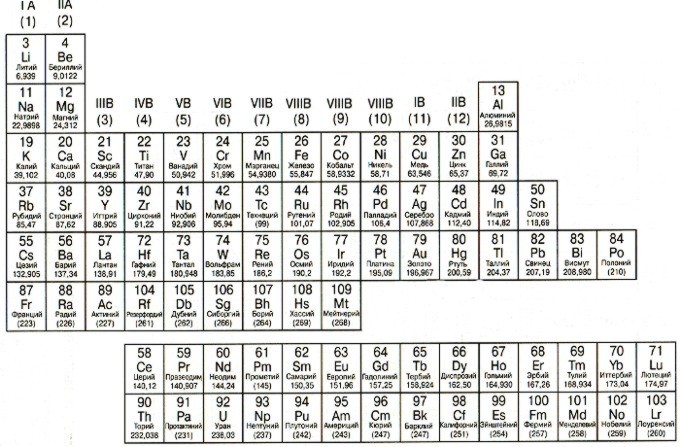
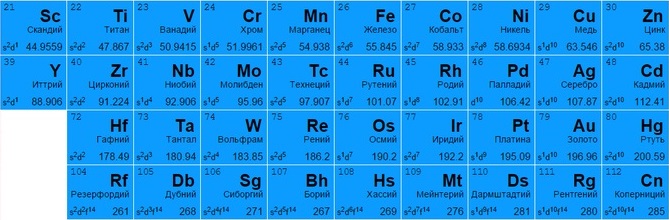
Переходные металлы
Переходные металлы занимают группы 3—12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
| Переходные металлы |
| Скандий Sc 21 |
| Титан Ti 22 |
| Ванадий V 23 |
| Хром Cr 24 |
| Марганец Mn 25 |
| Железо Fe 26 |
| Кобальт Co 27 |
| Никель Ni 28 |
| Медь Cu 29 |
| Цинк Zn 30 |
| Иттрий Y 39 |
| Цирконий Zr 40 |
| Ниобий Nb 41 |
| Молибден Mo 42 |
| Технеций Tc 43 |
| Рутений Ru 44 |
| Родий Rh 45 |
| Палладий Pd 46 |
| Серебро Ag 47 |
| Кадмий Cd 48 |
| Лютеций Lu 71 |
| Гафний Hf 72 |
| Тантал Ta 73 |
| Вольфрам W 74 |
| Рений Re 75 |
| Осмий Os 76 |
| Иридий Ir 77 |
| Платина Pt 78 |
| Золото Au 79 |
| Ртуть Hg 80 |
| Лоуренсий Lr 103 |
| Резерфордий Rf 104 |
| Дубний Db 105 |
| Сиборгий Sg 106 |
| Борий Bh 107 |
| Хассий Hs 108 |
| Мейтнерий Mt 109 |
| Дармштадтий Ds 110 |
| Рентгений Rg 111 |
| Коперниций Cn 112 |
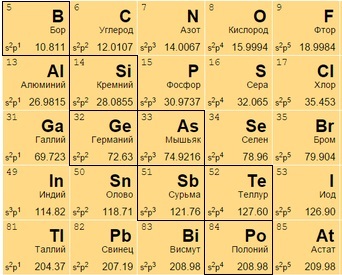
Металлоиды
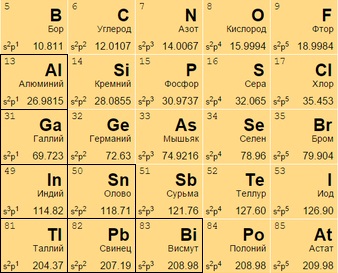
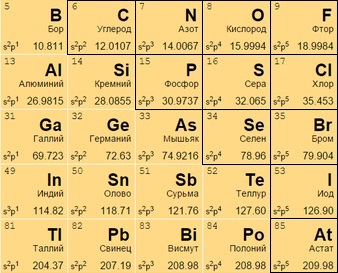
Металлоиды занимают группы 13—16 периодической таблицы. Такие металлоиды, как бор, германий и кремний, являются полупроводниками и используются для изготовления компьютерных чипов и плат.
| Металлоиды |
| Бор B 5 |
| Кремний Si 14 |
| Германий Ge 32 |
| Мышьяк As 33 |
| Сурьма Sb 51 |
| Теллур Te 52 |
| Полоний Po 84 |
Постпереходными металлами
Элементы, называемые постпереходными металлами, относятся к группам 13—15 периодической таблицы. В отличие от металлов, они не имеют блеска, а имеют матовую окраску. В сравнении с переходными металлами постпереходные металлы более мягкие, имеют более низкую температуру плавления и кипения, более высокую электроотрицательность. Их валентные электроны, с помощью которых они присоединяют другие элементы, располагаются только на внешней электронной оболочке. Элементы группы постпереходных металлов имеют гораздо более высокую температуру кипения, чем металлоиды.
| Постпереходные металлы |
| Алюминий Al 13 |
| Галлий Ga 31 |
| Индий In 49 |
| Олово Sn 50 |
| Таллий Tl 81 |
| Свинец Pb 82 |
| Висмут Bi 83 |
Неметаллы
Из всех элементов, классифицируемых как неметаллы, водород относится к 1-й группе периодической таблицы, а остальные — к группам 13—18. Неметаллы не являются хорошими проводниками тепла и электричества. Обычно при комнатной температуре они пребывают в газообразном (водород или кислород) или твердом состоянии (углерод).
| Неметаллы |
| Водород H 1 |
| Углерод C 6 |
| Азот N 7 |
| Кислород O 8 |
| Фосфор P 15 |
| Сера S 16 |
| Селен Se 34 |
| Флеровий Fl 114 |
| Унунсептий Uus 117 |
А теперь закрепите полученные знания, посмотрев видео про таблицу Менделеева и не только.
Отлично, первый шаг на пути к знаниям сделан. Теперь вы более-менее ориентируетесь в таблице Менделеева и это вам очень даже пригодится, ведь Периодическая система Менделеева является фундаментом, на котором стоит эта удивительная наука.
Хотите ещё проще? Мы создали новый курс, где максимум за 7 дней вы овладете химией с нуля. Подробннее по ссылке