Терапия моноклональными антителами что это
Моноклональные тела
Разбираем 10 самых важных вопросов о новых препаратах для лечения мигрени – моноклональных антителах.
1. Что за препараты и как они работают?
При мигрени болевые импульсы проводятся за счет особого вещества – кальцитонин ген родственного пептида (CGRP). Новые препараты либо связывают этот CGRP, либо блокируют работу рецепторов к нему. Мигренозная боль не развивается.
2. Можно снять приступ?
Эренумаб и фреманезумаб разработаны для профилактики приступа – делается один укол в месяц, чтобы приступы были существенно реже. Но проходят исследования препараты с похожим механизмом действия (джепанты) именно для снятия уже возникшего приступа.
3. Что же они столько стоят? Аж по 500 евро в Европе (у нас, правда, стоимость пока неизвестна)
Эренумаб и фреманезумаб отличаются от привычных нам лекарств, например, аспирина или пенициллина. Их не синтезируют в лаборатории, а получают за счет сложных и трудоемких биотехнологий. Себестоимость производства очень высока. А вот джепанты синтезируются, как и другие обычные лекарства, их стоимость должна быть ниже.
4. Какого эффекта ожидать от новых препаратов? Мне поможет?
Как с любым лекарством – есть пациенты кому помогает, есть – кому нет. Мы ожидаем в среднем, что у половины пациентов количество дней с мигренью в месяц сократится наполовину. Но будут пациенты, у кого приступы исчезнут полностью, и будут те, кому препарат не поможет совсем.
5. А что потом, после 6-месячного курса?
Как правило, эффект сохраняется еще несколько месяцев. Если приступы потом учащаются, приходится повторять курс профилактики. Но синдрома отмены на новых препаратах моноклональных антител нет.
6. Эти препараты вообще неопасны? Это же прививка?
Все препараты, разрешенные к продаже, прошли исследования и получили одобрение в соответствии с европейскими, американскими и российскими требованиями к безопасности. Надо отметить, что в исследования включались молодые пациенты с минимальными сопутствующими заболеваниями. Если есть сопутствующие сердечно-сосудистые и другие хронические заболевания, то нужно обязательно следить за анализами и показателями. Препараты моноклональных антител – это не прививка или вакцина, они не влияют на иммунные механизмы.
7. Я уже пробовал антидепрессанты, и ботулотоксин, и топирамат. Ничего не помогает. Мне вряд ли эти препараты помогут?
Вовсе нет. Есть несколько исследований, которые показали, что моноклональные антитела к CGRP значительно помогают тем пациентам, для которых предыдущая терапия оказалась неэффективной.
8. Существует 4 препарата моноклональных антител. Какой лучше?
Прямого сравнения эффективности пока не проводилось, но согласно исследованиям, все примерно одинаковые. Эренумаб блокирует рецептор к CGRP, остальные препараты – сам CGRP. Фреманезумаб может использоваться как один раз в месяц, так и раз в 3 месяца. Эптинезумаб и галканезумаб пока не зарегистрированы в России. Эптинезумаб вводится внутривенно. Галканезумаб помимо мигрени помогает и при кластерной головной боли.
9. Я пью топирамат, моя хроническая мигрень стала протекать легче. Можно вместе с топираматом начать препараты моноклональных тел к CGRP, чтобы сделать приступы еще реже? А триптаны можно?
Препараты моноклональных тел к CGRP не взаимодействуют с другими лекарствами. Их можно сочетать со стандартной терапией мигрени. Можно использовать триптаны для снятия уже возникшего приступа мигрени.
10. Кто может назначить эти препараты?
Необходимо проконсультироваться у невролога и убедиться в диагнозе мигрени и отсутствии противопоказаний к лечению. Первые инъекции лучше сделать в клинике, под наблюдением врача. Препараты моноклональных тел к CGRP имеют строгий температурный режим хранения, что сложно обеспечить в домашних условиях. При нарушении температурного режима препарат может потерять лечебные свойства.
Подписывайтесь на наш Инстаграм, чтобы читать свежие материалы о диагностике и лечении головной боли!
Терапия моноклональными антителами что это
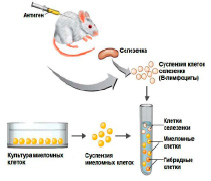
В 1970-х годах молодой немецкий иммунолог Георг Келер изучал генетическую изменчивость антител. Для исследования надо было изолировать клон антителообразующих клеток (АОК) – плазматических клеток (производных от В-лимфоцитов). Необходимо отметить, что В-лимфоциты могут жить только в организме хозяина, и в искусственной питательной среде они быстро гибнут. Их длительное культивирование вне организма невозможно. Наоборот, клетки опухоли из плазматических клеток, называющиеся плазмоцитомами или миеломами, хорошо культивируются и размножаются in vitro и их называют «бессмертными».
Георг Келер Цезарь Мильштейн
Для реализации проекта Келер поехал в Англию, в лабораторию Цезаря Мильштейна, изучавшего клоны плазмоцитом, и они вместе разработали оригинальный подход к этой проблеме: решили получить гибрид нормальной антителообразующей клеткой (АОК) и опухолевой клетки. В случае успеха такой гибрид унаследовал бы от нормальной клетки способность к синтезу антител, а от опухолевой – бессмертие и способность к неограниченному и бесконтрольному росту. Это им удалось осуществить, создав гибридомную технологию.
Метод гибридизации соматических клеток in vitro осуществляется путем слияния разнородных клеток. Разнородные клетки, у которых слились оболочки, образовывали гибриды, которые сохраняли способность к клеточным делениям. Таким образом, возникал истинный гибрид, потомок двух соматических клеток, или гибридома. Келер и Мильштейн получили гибридому между нормальной АОК и опухолевой, миеломной клеткой.
Моноклональные антитела (МАТ) – это антитела лабораторного производства, связывающиеся с конкретными антигенами, например, с рецепторами раковых клеток, и при этом отсутствующие у нормальных клеток. Для создания МАТ мышам вводят раковые клетки человека, затем клетки селезенки, продуцирующие антитела, сливают с клетками мышиной миеломы, получая гибридную клетку – гибридому, которая путем деления производит идентичные дочерние клетки или клоны – отсюда термин «моноклональные». Антитела, секретируемые различными клонами, проверяются на способность узнавать свой антиген. С помощью этих бессмертных клеток гибридом могут быть получены большие количества антител. Поскольку антитела мыши могут сами вызывать иммунный ответ у людей, в мышиных антителах часто заменяют большую часть мышиного антитела на человеческие [1,3,4].
Таким образом, клоны-продуценты моноклональных антител (гибридомы) получают слиянием антителообразующих клеток лимфоидной ткани иммунизированного животного и клеток плазмацитомы. Полученные в результате клетки наследуют от лимфоцитов способность к секреции антител и от клеток миеломы способность к неограниченному росту in vitro [5].
В терапии опухолей используют два типа МАТ: простые (не связанные ни с какими цитотоксическими веществами) и конъюгированные – МАТ, лечебный эффект которых обусловлен присоединенными к антителу веществами (радиоактивными частицами, цитостатиками или токсинами). Механизм терапевтического действия антител можно рассмотреть на примере алемтузумаба – МАТ против антигена лимфоцитов CD52, обладающих противоопухолевым и иммуносупрессивным действием, направленного на лечение хронического лимфолейкоза и кожной Т-клеточной лимфомы. Вариабельный регион алемтузумаба соединяется с антигеном CD52 на поверхности лимфоцитов, а константный регион – с Fc-рецепторами на поверхности цитотоксических клеток, которые уничтожают мишень. Кроме того, препарат активирует систему комплемента, что приводит к образованию комплекса, разрушающего мембрану злокачественной клетки. Именно эти два механизма, а также индукция апоптоза считаются основными в действии МАТ. Характер иммунотерапии зависит от разновидности опухоли. Так, при раке легкого используется авастин – гуманизированное рекомбинантное гиперхимерное моноклональное антитело, которое селективно связывается с биологически активным фактором роста эндотелия сосудов, нейтрализуя его [2].
Действие mAb на клетку опухоли:
1 – антитело mAb связывается с антигеном опухолевой клетки и вызывает или ее комплемент-зависимую гибель, или гибель в результате антителозависимой атаки макрофагами.
2 – с mAb связан радиоактивный изотоп, токсин или цитокин, вызывающие гибель клетки. Также с антителами может быть связан фермент, участвующий в превращении препарата в активную форму.
3 – биспецифические mAb. Один сайт связывается с опухолевой клеткой, другой – с киллерной эффекторной клеткой.
4 – антитела mAb связаны с липосомами, которые содержат химотерапевтические препараты или токсины.[6]
Разработка новых моноклональных антител и совершенствование схем терапии злокачественных опухолей с их помощью является одним из наиболее перспективных направлений в онкологии, дающих больше шансов на продление активных лет жизни онкологическим больным.
НОВЫЕ ПЕРСПЕКТИВЫ В ИММУНОТЕРАПИИ ОНКОЗАБОЛЕВАНИЙ: ИНГИБИТОРЫ PD-1/PD-L1
Иммунотерапия анти-PD-1 и анти-PD-L1 препаратами – одно из самых современных и перспективных направлений в лечении определённых видов рака. Рассказываем о механизме их действия и преимуществах.
Иммунная система и рак
Иммунная система защищает организм от инфекций и заболеваний. В-лимфоциты синтезируют антитела в ответ на бактерии, вирусы, а также атипичные клетки. Т-лимфоциты могут распознавать и уничтожать опухолевые клетки.
По мере прогрессирования заболевания в раковых клетках появляются мутации: из-за них иммунитет перестает замечать и уничтожать эти клетки. В результате они не только продолжают бесконтрольно делиться, но и продуцируют белки, которые нарушают способность организма к нормальному иммунному ответу.
Как работает иммунотерапия?
В отличие от химиотерапии, иммунотерапия не убивает сами раковые клетки, а стимулирует иммунную систему организма, чтобы она могла обнаруживать и атаковать их.
На сегодняшний день существуют различные методы иммунотерапии: терапевтические вакцины, клеточная терапия, моноклональные и биспецифические антитела, такие как, например, анти-PD-1 и анти-PD-L1. Эти методы назначаются преимущественно на поздней стадии болезни и для терапии рецидивирующего или метастатического рака.
Ингибиторы PD-1 и PD-L1: какую роль они играют?
В начале 1990-х иммунологи Джеймс Эллисон из Техасского университета и Тасуку Хондзё из Киотского университета смогли определить, почему иммунная система не воспринимает раковые клетки как угрозу. В норме она производит «иммунные контрольные точки» —определенные белки, которые участвуют в регуляции иммунного ответа, а конкретно – в его торможении.
Одним из таких белков является PD-1 рецептор, который служит негативным регулятором активности Т-клеток. Связывание PD-1 с лигандом PD-L1, который способен экспрессироваться клетками опухолей, подавляет Т-клетки в иммунном ответе.
Цель иммунотерапии – отключить «тормоза» иммунной системы, которые не дают организму в полную силу бороться с раковыми клетками. Моноклональные антитела прикрепляются к мишеням на раковых клетках либо на лимфоцитах, блокируют взаимодействие между PD-1 и PD-L1 и убирают иммунный «тормоз»: таким образом постепенно усиливается T-клеточный ответ и повышается противоопухолевая активность.
Ингибиторы PD-1 применяют для лечения меланомы, рака легкого, рака почки и лимфомы Ходжкина (злокачественного заболевания лимфоидной ткани). Моноклональные антитела к PD-L1 являются предпочтительной терапией для некоторых видов рака мочевого пузыря (уротелиальная карцинома), рака легкого, трижды негативного рака молочной железы (особенно агрессивная форма рака молочной железы) и карциномы из клеток Меркеля (редкий и агрессивный рак кожи). Первые регистрационные удостоверения были выданы в 2011 году в США и в 2013 году в Европе, при этом в последние годы количество назначений резко возросло. Во Франции первый ингибитор PD-L1 получил одобрение для использования при немелкоклеточном раке легкого в 2015 году.
ЭФФЕКТИВНОСТЬ И БЕЗОПАСНОСТЬ ТЕРАПИИ
Сегодня терапия анти-PD-1/PD-L1-моноклональными антителами — одно из наиболее перспективных направлений развития противоопухолевой терапии, так как она потенциально может помочь пациенту добиться длительной ремиссии и получить пожизненный иммунитет против опухоли. Иммунотерапия не только переносится многими пациентами лучше, чем химиотерапия, и вызывает меньше побочных явлений (таких как выпадение волос, слабость, тошнота и т.д.), но и более проста в применении: осуществляется посредством внутривенных инъекций раз в две-три недели.
Тем не менее, потенциально иммунотерапия может вызывать серьезные нежелательные явления, в первую очередь, – иммунологические реакции, сходные с аутоиммунными заболеваниями. Более того, данный метод лечения является дорогостоящим (стоимость одного курса может составлять от 4 000 до 12 000 евро в зависимости от применяемых антител), и все еще требует тщательных исследований.
Подбор пациентов, у которых лечение будет эффективным, является основной задачей для продолжения исследований и ускорения темпов внедрения данной таргетной терапии. Уже полученные результаты сильно варьируются: в то время, когда для одних пациентов лечение оказывается очень эффективным, у других в редких случаях ускоряется развитие опухоли. Важно определить популяцию пациентов, организм которых с наибольшей долей вероятности продемонстрирует ответ на эту терапию, в частности путем изучения биомаркеров. На данный момент надежные биомаркеры еще не найдены, но ученые, тем не менее, заметили, что опухоли с высокой частотой мутаций лучше реагируют на иммунотерапию.
РОЛЬ КОМПАНИИ «СЕРВЬЕ»
Для удовлетворения растущей потребности в терапевтических решениях, «Сервье» выделила онкологию как одно из приоритетных направлений: в 2020-2021 году в эту область было инвестировано 50% бюджета на научные исследования и разработки.
Как компания, приверженная потребностям пациентов, Группа «Сервье» стремится занять ключевые позиции в области онкологии, разрабатывать инновационные методы терапии рака в областях с наибольшими потребностями.
Ингибиторы иммунных контрольных точек существенно изменили возможности терапии онкологических заболеваний во всем мире. Тем не менее, только у 10-60% пациентов по всем показаниям будет наблюдаться ответ на терапию, и у большинства из них произойдет рецидив, что указывает на сильную потребность в медицинской помощи помимо ингибиторов PD-1 и PD-L1.
За последние годы были достигнуты значительные успехи в исследованиях иммунных контрольных точек, выявлено несколько ингибиторных и стимулирующих рецепторов, которые используются «Сервье» для разработки следующего поколения ингибиторов контрольных точек иммунитета. Сейчас проекты находятся как на стадии научно-исследовательской работы, так и на стадии клинических испытаний.
Новые противоопухолевые препараты на основе моноклональных антител
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Российский онкологический научный центр им. Н.Н. Блохина РАМН
П рогресс в молекулярной биологии и биотехнологии открыл огромные возможности для развития новых подходов к лечению больных онкологическими заболеваниями. Достижения в области генной инженерии моноклональных антител (МКА) позволили создать новые перспективные гуманизированные антитела, которые активно изучаются в онкологической практике. Эти достижения имеют большое значение для лечения больных злокачественными новообразованиями, и их значение в создании новых специфических препаратов будет только возрастать.
Сенсацией в клинической онкологии явилось высокоэффективное использование моноклональных антител – Герцептина и Мабтеры. Именно эти лекарства отрыли новый раздел в современном лечении злокачественных опухолей – направленную биотерапию. Использование МКА позволяет целенаправленно уничтожать опухолевые клетки.
В табл. 1 представлены новые эффективные препараты, созданные на основе МКА, которые используются или изучаются в онкологии. На сегодняшний день одобрено для клинического применения 4 МКА. В клинических исследованиях находятся около 10 различных антител для лечения гематологических и солидных опухолей. В предклинических исследованиях находятся еще несколько антител. Кроме того, идет создание различных иммунотоксинов (с использованием А цепи рицина или дифтерийного токсина) и радиоактивных токсинов на основе уже существующих моноклональных препаратов.
Высокая эффективность моноклональной терапии связана с механизмами действия антител. Оказалось, что МКА к определенным антигенам способны не только вызывать иммуно–опосредованную (антитело– и комплемент–зависимую) цитотоксичность, но и непосредственно вызывать апоптоз в клетках–мишенях. В данном обзоре представлены данные о противоопухолевых препаратах на основе МКА.
Трастузумаб (Герцептин) – рекомбинантное МКА, которое связывается с рецептором HER2/neu на поверхности опухолевых клеток многих солидных опухолей. Герцептин высокооэффективен при самостоятельном применении в I линии лечения запущенного рака молочной железы [1]. Среди 114 больных с гиперэкспрессией HER2 (HER2 +++ или HER2 ++ FISH– или FISH + ) значительная регрессия опухоли достигнута при HER2 +++ – у 35% больных, при HER2 ++ FISH + – у 34% больных. В то же время у HER2 +++ FISH– больных лечебный эффект не был достигнут ни в одном случае. При продолжении лечения Герцептином не имели прогрессирования через 12 мес после начала терапии 57% (17 из 30) больных с полной или частичной ремиссией и 51% (22 из 43) больных с длительной стабилизацией (более 6 мес).
При лечении 336 больных полная или частичная ремиссия получена в I и II линии терапии рака молочной железы у 26% и 22% больных, соответственно. Частота лечебного эффекта также зависела от степени гиперэкспрессии HER2. При гиперэкспрессии HER2 +++ или FISH + частота эффекта составила 41%, хотя в общей группе (HER2 +++ или HER2 ++ ) только 26%.
Разработаны два режима применения Герцептина [2]:
1. Еженедельное внутривенное введение в дозе 2 мг/кг, 30–минутная инфузия (первая доза 4 мг/кг, 90–минутная инфузия).
2. Введение 1 раз в 3 недели внутривенно в дозе 6 мг/кг, 90–минутная инфузия (первая доза 8 мг/кг, 90–минутная инфузия).
Важно: Герцептин вводится только в физиологическом растворе хлорида натрия!
Герцептин обычно хорошо переносится больными. Озноб, повышение температуры тела, астения наблюдаются обычно после первого введения, в дальнейшем их частота снижается и не превышает 5%. После первого введения могут возникнуть также острые инфузионные реакции (одышка, анафилаксия) с частотой 3:1000, крайне редко они могут представлять опасность для жизни. Лечебные мероприятия дают быстрый эффект. В дальнейшем терапия Герцептином может быть продолжена с премедикацией, что обеспечивает безопасность лечения.
Особое внимание при лечении Герцептином обращается на опасность возникновения кардиотоксичности. Недавно опубликован анализ частоты развития кардиотоксичности при лечении 1219 больных [3]. Наибольший риск кардиотоксичности установлен при комбинации Герцептина с адриамицином и циклофосфаном (27%), реже – при комбинации Герцептина с Таксолом (13%) или при монотерапии (3–7%). Во всех случаях больные прежде получали антрациклины. Кардиотоксичность характеризуется развитием симптомов сердечно–сосудистой недостаточности. В большинстве случаев (79%) стандартное лечение сердечно–сосудистой недостаточности приносит эффект. Конечно, введение Герцептина в таких случаях должно быть прекращено. Для раннего выявления кардиотоксичности рекомендуется проведение эхокардиографии каждые 3 месяца.
Причины возникновения кардиотоксичности до конца не ясны, хотя проведены большие исследования с многократными биопсиями миокарда у таких больных. Неизвестно, усиливает ли Герцептин уже существовавшее повреждение клеток миокарда, вызванное антрациклинами, или он действует независимо. Исследования показывают, что HER2 экспрессируется на клетках миокарда, и, возможно, играет определенную роль в поддержании жизнедеятельности миоцитов, поэтому его блокирование может привести к нарушению функционирования сердечной мышцы.
Интенсивно изучается совместное применение Герцептина и химиотерапии при метастазах рака молочной железы [4–8].
Проведено сравнение частоты эффекта и времени до прогрессирования при использовании режима адриамицин + циклофосфан с Герцептином (режим I, 143 больных) и без Герцептина (режим II, 138 больных). Частота полной и частичной ремиссии при этих режимах составила 60% и 42% соответственно. Среднее время до прогрессирования – 8,1 и 6 мес. Именно это исследование показало значительный риск повышения кардиотоксичности при одновременном применении Герцептина и антрациклинов.
Учитывая отсутствие существенного улучшения лечебного эффекта и повышенный риск кардиотоксичности, комбинация Герцептин + антрациклины не рекомендуется.
Проведено сравнение эффективности Таксола в комбинации с Герцептином (группа I, 92 больных) и самостоятельно (группа II, 96 больных). Все больные до этого в адъювантном режиме получали антрациклины. Полная ремиссия установлена в 49% и 17% случаях, среднее время до прогрессирования составило 7 и 3 мес, а средняя продолжительность жизни 25 и 18 мес соответственно. Совершенно очевидно, что Герцептин значительно повышал противоопухолевую активность Таксола.
Это получило подтверждение в другом исследовании. Таксол вводили в дозе 90 мг/м 2 еженедельно в комбинации с Герцептином или самостоятельно больным метастазами рака молочной железы в I линии химиотерапии. Комбинация Таксола с Герцептином привела к полной или частичной ремиссии у 83% HER2–положительных больных.
Высокая активность комбинации Таксола с Герцептином при метастазах рака молочной железы стала основанием для его изучения при неоадъювантном лечении. Таксол (175 мг/м 2 каждые 3 нед) в комбинации с еженедельным введением Герцептина применялся при неоадъювантной химиотерапии больных раком молочной железы II–III стадии. Число проведенных курсов составило 4. Среди 40 оперированных больных достигнуто полное исчезновение опухоли по данным морфологического исследования в 25% случаев (полная + частичная клиническая ремиссия – 64% случаев).
Значительный лечебный результат получен и при метастатическом раке молочной железы при использовании комбинации Герцептина и Таксотера. 35 больных с высокой экспрессией HER2 (HER2 +++ ) были эффективно лечены в I и II линии химиотерапии (55% и 73% соответственно) [4].
В другом исследовании у 30 HER2–положительных больных применили Герцептин (4–2 мг/кг) и Таксотер (35 мг/м 2 еженедельно). Частота лечебного эффекта – 67%. Интересно, что при высоком уровне HER2 в сыворотке крови частота ответа составила 76%. Среднее время до прогрессирования – 9 мес [5].
Высокоэффективным оказался режим комбинации Герцептина с Навельбином (25 мг/м 2 1 раз в неделю). Частота эффекта в I линии химиотерапии составила 64–84%, во II–III линиях – 75% [6].
В настоящее время при раке молочной железы Герцептин изучается в комбинации с различными цитостатическими препаратами, а также с тамоксифеном и ингибиторами ароматазы. Идут несколько программ по адъювантному применению Герцептина в течение 1–2 лет после завершения адъювантной химиотерапии.
Интерес к применению Герцептина при других типах опухолей значительно возрастает. Гиперэкспрессия HER2 обнаружена в различных злокачественных опухолях. Сегодня кандидатами для назначения Герцептина являются различные злокачественные опухоли, имеющие гиперэкспрессию HER2 ( +++ при иммуногистохимическом анализе или ++ при FISH + ). Высокая экспрессия HER2 установлена при раке поджелудочной железы, мочевого пузыря, легкого, остеогенной саркоме и других опухолях. Некоторые опухоли чрезвычайно часто гиперэкспрессируют HER2. Так, гиперэкспрессия Her2 (2+ или 3+) обнаружена у 14 из 15 больных раком слюнной железы [9].
Установлено, что Герцептин не только обладает самостоятельной активностью, но и преодолевает резистентность опухоли, усиливая эффект химиотерапии. Первые клинические публикации обнадеживают: при метастазах колоректального рака (HER2 +++ ) комбинация иринотекана 125 мг/м 2 и Герцептина 4–2 мг/кг еженедельно показала объективный эффект у 5 из 7 больных.
Новые перспективы связаны с комбинированной терапией, направленной против других членов семейства HER. В ткани рака молочной железы экспрессируется не только HER2, но и другие рецепторы (HER1, 3 и 4). Наибольший интерес привлекает HER1 – рецептор эпидермального фактора роста. В предклинических исследованиях показано, что при комбинации Герцептина с Ирессой (блокатор HER1) эффект ингибирования HER2 возрастает примерно в 200 раз [10–11]. Значительное усиление эффекта Герцептина установлено в линии HCA–7 колоректального рака, экспрессирующего HER2, при комбинации с ингибитором циклооксигеназы–2 Целекоксибом [12].
Следует подчеркнуть, что решение о назначении Герцептина всегда принимается после иммуногистохимического анализа экспрессии HER2 в ткани опухоли. Гиперэкспрессия считается доказанной только при высокой интенсивности окрашивания (3+). В случае 2+ следует определить наличие амплификации гена (с помощью FISH–метода). При раке молочной железы определение HER2 признано необходимым исследованием для каждой больной.
Ритуксимаб (Ритуксан, Мабтера) представляет собой гуманизированное МКА против CD20 + лимфомы [13]. Механизм действия Ритуксана связан с развитием опосредованной антитело–зависимой клеточной и комплемент–зависимой цитотоксичности, что вызывает апоптоз в клетках лимфомы и нормальных лимфоцитах, положительных по CD20. Происходит снижение уровня циркулирующих CD20 + В–лимфоцитов как лимфомных, так и нормальных. Период низкого уровня нормальных В–лимфоцитов продолжается 3–6 мес. При этом не замечено повышения риска инфекционных осложнений (возможно, это связано с тем, что уровень иммуноглобинов в сыворотке не меняется).
Мабтера используется в режиме 375 мг/м 2 внутривенно еженедельно (4 дозы). Мабтера имеет высокую самостоятельную (без химиотерапии) активность в I линии лечения CD20–положительной В–клеточной неходжкинской лимфомы [14, 15]. При варианте фолликулярной лимфомы частота ответа составляет 70–75%, при лимфоме мантийной зоны – 35–40%. Между тем частота полного эффекта составляет 10–40%.
С учетом реальной нетоксичности лечения Мабтера самостоятельно часто применяется у больных при плохом общем состоянии. В остальных случаях наиболее рационально применять сочетание Мабтеры и химиотерапии. Рациональные режимы такого сочетания иммуно– и химиотерапии продолжают изучаться [16–18].
148 больных различными вариантами В–клеточной неходжкинской лимфомой получали Мабтеру и СНОР (циклофосфан + доксорубицин + винкристин + преднизолон). Мабтеру в этом исследовании вводили в дозе 375 мг/м 2 2 дня до 1, 3 и 5 курсов и 2 дня после 6 курса. Лечебный эффект отмечен в 100% случаев (полная ремиссия – в 58% случаев). Через 5 лет более 60% больных сохранили полную ремиссию. Важно отметить, что большинство больных имели относительно благоприятные морфологические варианты болезни.
Однако при агрессивных формах В–клеточных лимфом отмечают недостаточный эффект Мабтеры даже при комбинации с химиотерапией (СНОР). В этом исследовании в I линии Мабтеру вводили только во 2-й день каждого курса химиотерапии на протяжении 6 курсов. Среди 33 больных достигнуто 20 (61%) полных ремиссий и 11 (33%) частичных ремиссий. Однако не удалось увеличить время до прогрессирования.
Высокий результат получен в специально проведенном исследовании при лимфоме мантийной зоны [18, 19]. Ритуксан вводили два дня до каждого из 6 курсов СНОР. Объективный эффект – 96% (полная ремиссия – 48% случаев). При поражении костного мозга полная ремиссия была достигнута у 21 из 31 больных (68%). В костном мозге и периферической крови «молекулярно–доказанная ремиссия» у 48% больных. Важно заметить, что «молекулярная ремиссия» прежде не регистрировалась при стандартной и высокодозной химиотерапии, даже при полной клеточно–морфологической ремиссии.
Показаниями для назначения Мабтеры является CD20+ неходжкинская лимфома высокой или низкой степени дифференцировки, рефрактерная и рецидивирующая. Мабтера может применяться вместо химиотерапии (у тяжелых больных) или для поддержания ремиссии после успешной химиотерапии.
Предыдущий опыт показывает, что комбинация химиотерапии и Мабтеры увеличивает эффективность и длительность ремиссии без влияния на токсичность химиотерапии. Новые надежды возлагаются на изучаемые режимы комбинации Мабтеры с флударабином; митоксантроном и дексаметазоном; цитозинарабинозидом, цисплатином и дексаметазоном.
Радиоиммунотоксины на основе анти–CD20 антител
Несмотря на значительный самостоятельный успех Мабтеры, существует проблема ограниченной эффективности терапии у больных агрессивными формами лимфомы. Как уже говорилось выше, половина больных с рецидивирующими лимфомами и 2/3 больных с рецидивирующими агрессивными лимфомами не достигают значительной ремиссии при использовании Мабтеры. Новые возможности открывает использование радиоиммунотоксинов на основе анти–CD20 антител. Два препарата на основе МКА к CD20 антигену, меченные радиоактивными изотопами, разрешены к клиническому применению при неходжкинской лимфоме.
Ибритумомаб (Зевалин) является конъюгатом Мабтеры с радиоактивным изотопом иттрия–90 (Y90) [20].
При лечении 54 больных с рецидивирующими неходжкинскими лимфомами (из которых 95% составила фолликулярная лимфома), резистентных к химиотерапии и Мабтере, получен эффект в 74% случаев (полная ремиссия в 15%). Среднее время до прогрессирования составило 6,8 мес.
При сравнении эффективности Зевалина (73 больных) и Мабтеры (70 больных) оказалось, что полная и частичная ремиссия имела место у 80% (полная ремиссия – 34%) и 56% (полная ремиссия 20%) больных, соответственно. Время до прогрессирования составило 11,2 и 10,1 мес, соответственно [21].
Побочные эффекты Зевалина были оценены в 5 различных исследованиях (общее число больных 349). При этом у 57% больных наблюдалось падение числа лейкоцитов менее 1000/мм3 и у 61% – падение тромбоцитов менее 50 000/мм3. Инфекционные осложнения III–IV степени в исследованиях составили около 5%. Кроме того, наблюдались тошнота, рвота, боль в животе, диарея, одышка, боль в суставах. При анализе 211 больных, получавших лечение Зевалином, у 4 больных развился миелодиспластический синдром или острый миелолейкоз (все больные прежде получали различную химиотерапию). IV степень нейтропении наблюдалась в 33% случаев, тромбоцитопении – в 9% случаев.
Показаниями к использованию Зевалина является рецидивирующая и рефрактерная неходжкинская лимфома низкой степени злокачественности, в том числе и при прогрессировании после Мабтеры.
Бексар (J131Tositumomab, Bexxar) – конъюгат мышиного МКА против CD20 антигена с радиоактивным изотопом йода J131 [22–24].
При рефрактерной неходжкинской В–клеточной CD20+ лимфоме низкой степени злокачественности (47 случаев) частота эффекта составила 57% (полная ремиссия – в 32% случаев). Лечебный эффект наступал быстро, уже через 3 мес после лечения. Ремиссии были длительными, необходимость повторения лечения возникала в среднем через 20 мес. Повторное использование Бексара у этих больных дало хорошие результаты. Частота эффекта составила 67% (полная ремиссия 37%), среднее время до прогрессирования после повторного лечения – 10,6 мес.
Высокий эффект препарата подтвержден и в других исследованиях. При лечении 59 больных частота эффекта составила 71%, полная ремиссия установлена в 34% случаев. Среднее время до прогрессирования составило 12 мес, при полной ремиссии – 20,3 мес. Лечебный эффект был выше у больных лимфомой низкой степени злокачественности (83%), чем при промежуточной степени злокачественности (41%).
Бексар вызывал ремиссию у 58% больных (полная ремиссия у 28% больных) в другом крупном исследовании (273 больных). При этом показана его эффективность во всех подгруппах больных (пожилой возраст, прогрессирование в короткий срок после Мабтеры, значительные проявления болезни, прогрессирование после лучевой терапии, вовлечение костного мозга, рефрактерность к предшествующей химиотерапии).
Показана высокая эффективность Бексара в I линии лечения при неходжкинской CD20 + лимфоме. Ремиссия достигнута в 97% случаев (полная ремиссия – в 63%).
К настоящему времени, несмотря на значительный эффект, считается неэтичным применение радиоизотопных препаратов в I линии. Аргументом является отсутствие достаточного преимущества в длительности ремиссии по сравнению с неизотопными лекарствами, риск инфекционных и геморрагических осложнений при нейтропениях и тромбоцитопениях IV степени, а также повышенный риск развития других злокачественных опухолей.
Бексар и Зевалин активно изучаются и при других заболеваниях (множественной миеломе, макроглобулинемии Вальденстрема, волосатоклеточном лейкозе, идиопатической пурпуре, ревматоидном артрите, криоглобулинемии и др.).
Другим высокоэффективным препаратом для лечения лимфом являются антитела против CD52 антигена.
Алемптузумаб (Кампат, Campath) – гуманизированное МКА, связывающееся с CD52 [25, 26]. Этот антиген широко экспрессирован на нормальных (В– и Т–лимфоцитах, NK–клетках, моноцитах и макрофагах) и злокачественных клетках.
У 93 больных с резистентным хроническим лимфолейкозом полная и частичная ремиссия была достигнута в 33% случаев (время до прогрессирования составило более 9 мес). Активно идут исследования различных комбинаций с химиотерапией.
Однако препарат показал высокую токсичность [26]. Так, при лечении 93 больных частота нейтропении составила 85% (III–IV степень – у 64%), тромбоцитопении – 72% (III–IV степень обнаружена у 50% больных). Часто возникают длительные иммуносупрессивные состояния (потеря CD4, CD8, CD19, CD52 положительных лимфоцитов, длительность до 18 мес). Частота инфекционных осложнений составила 56% (в трети случаев тяжелые), при этом летальность от инфекционных осложнений – 20%. Кроме того, имели место инфузионные реакции (80% случаев), повышение температуры, озноб, анафилактический шок, сыпь (40%), гипотония (32%, III–IV степени – в 20% случаев) и др.
Показаниями к применению лекарства являются резистентные В– и Т–клеточные лимфомы, хронический лимфолейкоз. Проводятся исследования по изучению эффективности Кампата при рассеянном склерозе, ревматоидном артрите.
Новые возможности лечения больных неходжкинскими лимфомами связаны с изучением Епратузумаба.
Епратузумаб – гуманизированное МКА против CD22 антигена, экспрессирующегося на нормальных и злокачественных В–клетках [27, 28].
Основное внимание при изучении Епратузумаба обращено на его использование при агрессивных вариантах неходжкинской лимфомы самостоятельно или в комбинации с химиотерапией.
Другим препаратом, изучаемым при В–клеточных лимфомах, является Аполизумаб (Apolizumab, Remitogen, Hu1D10) – гуманизированное МКА к HLA–DR [29]. У здоровых людей экспрессия антигена гистосовместимости II класса встречается на В–лимфоцитах, моноцитах периферической крови и дендритных клетках. 1D10 антиген HLA–DR экспрессирован на 33–70% В–клеточных лимфом и примерно на 60–80% клеток хронического лимфолейкоза. Отличительной особенностью Hu1D10 антител является уникальный механизм действия – образование аутологичных антилимфоцитарных антител.
Лечебный эффект препарата проявляется через 3–9 мес после начала лечения. Начата I фаза исследований препарата у больных различными солидными опухолями, экспрессирующими 1D10 антиген [30].
Одновременно ведется изучение антител Hu1D10, меченых радиоактивным изотопом йода (J131) [29]. При рецидивах запущенной В–клеточной лимфомы, рефрактерной к химиотерапии, лечебный эффект получен в 50% случаев. К настоящему времени в I фазе клинических испытаний эффективность препарата показана при фолликулярной лимфоме. Проблемой использования конъюгата является отсроченная нейтропения и тромбоцитопения, возникающая через 4–6 нед после начала лечения.
Разработаны МКА и для лечения острого миелолейкоза и хронического лимфолейкоза.
Линтузумаб (Lintuzumab, Zamyl, HuM195) – МКА против CD33 антигена [31, 32]. CD33 является идеальной мишенью для терапии острого миелолейкоза, т.к. он экспрессируется примерно на 90% клеток лейкоза и зрелых гемопоэтических стволовых клетках.
На сегодняшний день более 300 больных получили лечение этим препаратом в рамках клинических испытаний. В III фазе клинических испытаний показано, что у больных рецидивирующим/рефрактерным острым миелолейкозом, получавших после индукционной терапии (цитарабин + митоксантрон + этопозид) 2 курса Линтузумаба, эффективность лечения составила 43% по сравнению с 26% при только химиотерапии. Частота полной ремиссии в течение 7–12 мес составила соответственно 70% и 35%.
Наиболее часто встречаемыми побочными действиями были озноб и повышение температуры. Гастроинтестинальная, печеночная, почечная или кардиологическая токсичность была минимальной.
Начаты испытания Линтузумаба, меченого радиоактивным изотопом йода J131.
Цетуксимаб (С225) представляет собой химерное МКА к рецептору эпидермального фактора роста (РЭФР) человека [33]. РЭФР (EGFR, HER1) – трансмембранный гликопротеин, относящийся к рецепторным тирозин–киназам. Экспрессия РЭФР наблюдается с высокой частотой во многих злокачественных опухолях, что делает Цетуксимаб перспективным препаратом для широкого применения в онкологии для лечения солидных опухолей.
Однако следует помнить о существующей методологической проблеме определения экспрессии РЭФР. Оказалось, что при колоректальном раке только в половине случаев гиперэкспрессия РЭФР, установленная иммуногистохимическим методом, совпадает с данными определения уровня мРНК в клетках (RT–PCR метод).
Предклинические исследования показывают, что Цетуксимаб блокирует деление опухолевых клеток и ангиогенез в опухоли, усиливает процессы апоптоза при сочетании с цитостатическими препаратами, способствует преодолению резистентности к лучевой и химиотерапии.
На сегодняшний день проводятся II–III фазы клинических испытаний Цетуксимаба при различных типах опухолей. Рекомендуется введение Цетуксимаба внутривенно еженедельно по 250 мг/м 2 (первая доза – 300–400 мг/м 2 ).
При метастазах рака почки получена длительная стабилизация (более 6 мес) у 25% больных [34]. При плоскоклеточном раке в области головы и шеи комбинация Цетуксимаба и лучевой терапии вызывала полную или частичную ремиссию в 100% случаев (15 больных), средняя продолжительность ответа – 13,9 мес [35].
Установлено, что Цетуксимаб может способствовать преодолению лекарственной резистентности. Так, у больных плоскоклеточным раком головы и шеи, имевших прогрессирование при использовании цисплатина, был достигнут эффект при использовании комбинации цисплатин + Цетуксимаб. У 38 больных получено 8 (21%) полных и частичных ремиссий и в 22 (58%) случаях – длительная стабилизация.
В другом исследовании у 121 больного метастазами рака толстой кишки с экспрессией РЭФР при прогрессировании после лечения Иринотеканом и 5–фторурацилом продолжили лечение тем же режимом с добавлением Цетуксимаба. Частичная ремиссия получена у 17% больных, длительная стабилизация – у 31% больных. Сейчас проводится изучение комбинации Иринотекан + 5–фторурацил + лейковорин + Цетуксимаб в I линии лечения.
Среди побочных эффектов при введении первой дозы препарата отмечены лихорадка и озноб (в 15–16% случаев), а также аллергические реакции, иногда резкие (IV степень – в 2% случаев). Общая частота аллергических реакций (в том числа и анафилактических) составила 4%. Повторные введения Цетуксимаба после аллергических реакций возможны при использовании премедикации. Кожная сыпь может появиться на любом этапе лечения препаратом (до 40% случаев). При незначительных акнеподобных проявлениях лечение может быть продолжено на фоне симптоматических средств.
Важно заметить, что сыпь возникает не только при использовании МКА к РЭФР, но и при лечении другими блокаторами РЭФР–синтетической структуры (так называемые «малые молекулы» – Иресса, Тарцева). Возможно, механизмы появления сыпи связаны с нарушением определенных процессов физиологического действия РЭФР в организме.
Среди многочисленных препаратов, проходящих клинические испытания, значительное место занимают антиангиогенные препараты с различными механизмами действия. Изучаются и МКА, блокирующие либо белки на эндотелиальных клетках, либо ангиогенные факторы.
Витаксин (Vitaxin) представляет собой МКА к anb3– интегрину, экспрессирующемуся на поверхности активированных эндотелиальных клеток. Проводится I–II фаза клинического изучения Витаксина при разных типах опухолей, однако результаты исследований пока не опубликованы. Отдельные успешные примеры применения препарата имеются при лейомиосаркоме.
Бевацизумаб (Авастин, Bevacizumab) – гуманизированное МКА против фактора роста эндотелия сосудов (VEGF). Распознает все изоформы VEGF, но не связывается с другими ангиогенными факторами, такими как факторы роста фибробластов, тромбоцитарный фактор роста и др. Ведутся клинические испытания во II–III фазах.
Самостоятельная активность Бевацизумаба при резистентном раке молочной железы составляет 11–20%. При II фазе испытаний у 110 больных метастатическим раком почки показано, что использование препарата в высоких дозах (10 мг/кг каждые 2 недели) в 2,5 раза удлиняет время до прогрессирования болезни по сравнению с плацебо.
Перспективным представляется использование комбинации Бевацизумаба и химиотерапии. При колоректальном раке такой подход уже показал свою эффективность, приводя к повышению эффективности и выживаемости. Изучаются различные комбинации препарата с химиотерапией при раке легкого, молочной железы, хроническом миелолейкозе и других опухолях. Гиперэкспрессия VEGF часто обнаруживается в различных опухолях, что увеличивает значимость изучения этого препарата.
Антитела к интерлейкину–6
Значительный клинический интерес представляет изучение анти–интерлейкин–6 антител при лимфомах, множественной миеломе и трансплацентарных В–лимфопролиферативных нарушениях. Гиперпродукция интерлейкина–6 (ИЛ–6) опухолевыми и стромальными клетками часто наблюдается при этих болезнях [36].
Предстоит изучить активность этих антител при других болезнях с высокой продукцией ИЛ–6 (множественная миелома, В–клеточная лимфома, рак почки и др.). Возможно, анти–ИЛ–6 антитела могут потенцировать эффективность другой терапии на основе цитокинов: интерферонов, интерлейкина–2, фактора некроза опухоли и т.д.
Успешные испытания препаратов направленного действия на основе МКА и низкая токсичность большинства из них позволяют надеяться на скорое появление в клинической практике высокоэффективных препаратов, способных не только увеличить эффективность лечения и продолжительность жизни, но и улучшить качество жизни больных злокачественными новообразованиями.
1. Vogel CL., Cobleigh M.A., Tripathy D. et al. Efficacy and safety of Trastuzumab as a single agent in first–line treatment of HER–2 overexpressing metastatic breast cancer (HER2 + /MBC). J Clin Oncol 2002; 3, 719–726.
2. Carbonell Castellon X., et al. Efficacy and safety of 3–weekly Herceptin monotherapy in women with HER–positive metastatic breast cancer. [abstract] Proc ASCO 2002; 19.
3. Seidman A., Hudis C., Pierri MK., et al. Cardiac dysfunction in the Trastuzumab clinical trials experience. J Clin Oncol 2002; 20 (5): 1215–1221.
4. Pergam M. Docetaxel and Herceptin: foundation for future strategies. Oncologist 2001; 6 (suppl 3), 22–25.
5. Esteva F., et al. Phase II study of weekly Docetaxel and Trastuzumab for patients with HER2–overexpressing metastatic breast cancer. J Clin Oncol 2002; 20 (7), 1800–1808.
6. Burstein H., et al. Multicenter phase II study of trastuzumab (Herceptin) and vinorelbine (navelbine) as first line therapy for HER–2 overexpressing metastatic breast cancer. [abstract] Proc ASCO 2002; p53a.
7. Eiermann W. Trastuzumab combined with chemotherapy for the treatment of HER2–positive metastatic breast cancer. Ann Oncol 2001; 12 (1), 57–62.
8. Shak S. Overview of the trastuzumab (Herceptin) anti–Her2 monoclonal antibody clinical program in HER–2–overexpressing metastatic breast cancer. Semin Oncol 1999; 26 (4 suppl 12), 71–77.
9. Skalova A., et al. Salivary duct carcinoma – a highly aggressive salivary gland tumor with HER2/neu oncoprotein overexpression. J Pathol, Research and Practice. 2001, 197 (9): 621–626.
10. Baselga J. Targeting the epidermal growth factor receptor: a clinical reality. J Clin Oncol 2001; 19(18 suppl) 41–44.
11. Normanno N et al. Cooperative inhibitory effect of ZD 1839 (Iressa) in combination with trastuzumab (Herceptin) on human breast cell growth. Annals of Oncology. 2002; 13, 65–72.
12. Mann M., et al. Targeting cyclooxygenase 2 and HER2/neu pathways inhibits colorectal carcinoma growth. Gastroenterology 2001; 120 (7), 1713–1719.
13. Jonson P., Glennie M. Rituximab: mechanisms and applications. Br J Cancer 2001: 85(11), 1619–1623.
14. Maloney DG., Grillo–Lopez AJ., White CA., et al. IDEC–C2B8: (Rituximab) anti–CD20 monoclonal antibody therapy in patients with relapsed low–grade lymphoma. Blood. 1997; 90: 2188–2195.
15. Davis T., et al. Rituximab (anti–CD20 monoclonal antibody) therapy for relapsed or refractory low–grade of follicular non–Hodgkin’s lymphoma. Annals of Oncology 1999; 10, 655–661.
16. Vose J., et al. Phase II study of Rituximab in combination with CHOP chemotherapy in patients with previously untreated, aggressive non–Hodgkin’s lymphoma. J Clin Oncol 2001; 19, 387–397.
17. Czuczman MS., Grillo–Lopez AJ., White CA., et al. Treatment of patients with low–grade B–cell lymphoma with the combination of chimeric antiCD20 monoclonal antibody and CHOP chemotherapy. J Clin Oncol 1999; 17, 268–276.
18. Howard O, Gribben J, Neuberg D, et al. Rituxan/CHOP induction therapy in newly diagnosed patients with mantle cell lymphoma [abstract]. Blood. 1999; 94: 631a.
19. Romaguera JE, Dang NH, Hagemeister FB, et al. Preliminary report of rituximab with intensive chemotherapy for untreated aggressive mantle cell lymphoma (MCL) [abstract]. Blood. 2000; 96: 733a.
20. Wiseman G., et al Phase I–II 90Y Zevalin (90Yttrium ibritumomab tiuxetan) radioimmunotherapy dosimetry results in relapsed or refractory non–Hodgkin’s lymphoma. Eur J Nucl Med 2000; 27(7), 766–777.
21. Witzig TE, White CA, Gordon LI, et al. Final results of a randomized controlled study of the Zevalin radioimmunotherapy regimen versus a standard course of rituximab immunotherapy for B–cell NHL. Blood. 2000;96:831a. (abstract).
22. Kaminski M., et al. Radioimmunotherapy with iodine 131J tositumab for relapsed of refractory B–cell non–hodgkin’s lymphomas. Blood 2000; 96, 1259–1266.
23. Kaminski MS, Estes J, Zasadny KR, et al. Radioimmunotherapy with iodine (131)I tositumomab for relapsed or refractory B–cell non–Hodgkin lymphoma: updated results and long–term follow–up of the University of Michigan experience. Blood. 2000;96:1259–66.
24. Vose JM, Wahl RL, Saleh M, et al. Multicenter phase II study of iodine–131 tositumomab for chemotherapy–relapsed/refractory low–grade and transformed low–grade B–cell non–Hodgkin’s lymphomas. J Clin Oncol. 2000;18:1316–23.
25. Flynn JM and Byrd JC. Campath–1H monoclonal antibody therapy. Curr Opin Oncol. 2000;12:574–581.
26. Keating MJ, Byrd J, Rai K, et al. Multicenter study of CAMPATH–1H in patients with chronic lymphocytic leukemia (B–CLL) refractory to fludarabine. Blood. 1999; 94:705a.
27. Leonard JP, Coleman M, Schuster, MW, et al. Immunotherapy of NHL with Epratuzumab (anti–CD22 monoclonal antibody): excellent tolerability with objective responses. Proc Am Soc Clin Oncol. 2000;19:17a.
28. Leonard, JP, Coleman, M, Chadburn A, et al. Epratuzumab (HLL2, anti–CD22 humanized monoclonal antibody) is an active and well–tolerated therapy for refractory/relapsed diffuse large B–cell non–Hodgkin’s lymphoma (NHL). Blood. 2000;96:578a.
29. Link BK, Wang H, Byrd JC, et al. Phase I Study of Hu1D10 monoclonal antibody in patients with B cell lymphoma. Proc Am Soc Clin Oncol. 2001;20:284a. (abstr.).
30. Wang H, Zhang L, Hall WC, et al. Analysis of 1D10 antigen expression in human malignant tissues: Implications for clinical use of Hu1D10. Proc Am Soc Clin Oncol. 2001;20:296a.
31. Caron PC., Juric JG., Scott AM., et al. A phase Ib of humanized anti–CD33 monoclonal antibody M195 (anti–CD33) in myeloid leukemia: specific targeting without immunogenicity. Blood 1994; 83, 1760–1768.
32. Feldman E., Kalaycio M., Schulman P., et al. Humanized monoclonal anti–CD33 antibody HuM195 in the treatmment of relapsed/refractory acute myelogenous leukemia (AML): prelimenary report of a Phase II study. [abstract]. Proc Am Soc Clin Oncol 1999; 18: 4a.
33. Baselga J., Pfizer D., Cooper MR., et al. Phase I studies of anti–epidermal growth factor receptor chimeric antibody C225 alone and combination with cisplatin. J Clin Oncol 2000; 18:904–914.
34. Gunnett K., Motzer R., Amato R., et al. Phase II study of anti–epidermal growth factor receptor (EGFr) antibody (C225) alone in patients with metastatic renal cell carcinoma. [abstract] Proc Am Soc Clin Oncol 1999; 18, 340a.
35. Mendelsohn J., Shin DM., Donato N., et al. A phase I study of chimerized anti–epidermal growth factor receptor (EGFr) vonoclonal antibody, C225, in combination with cisplatin (CDDP) in patients with recurrent head and neck cquamous cell carcinoma.
36. Haddad E., et al. Treatment of B–lymphoproliferative disorder with a monoclonal anti–interleukin–6 antibody in 12 patients. Blood 2001; 97: 1590–1597.