Тимус у новорожденных что
Тимус, как маркер внутриутробного воспаления
Yael Sciaky-Tamir, Reli Hershkovitz, Moshe Mazor, Ilan Shelef, Offer Erez
ВВЕДЕНИЕ
Частота преждевременных родов увеличилась в течение последних десятилетий и составляет примерно 10% от всех родов в мире. Около 70% преждевременных родов возникает спонтанно, без повреждения околоплодных оболочек или вследствие преждевременного разрыва плодных оболочек (ПРПО).
Преждевременные роды приводят к 75% перинатальной смертности, а также к большинству кратко- и долгосрочных неонатальных заболеваний, вследствие инфекции и воспаления, которые являются основной причиной спонтанных преждевременных родов, и могут впоследствии привести к детскому церебральному параличу (ДЦП). Существует мнение, что неонатальная заболеваемость является продолжением внутриутробного воспалительного процесса, который получил название синдром воспалительного ответа плода (СВОП). Плоды, которые пострадали от этого синдрома, имеют клинические и лабораторные показатели системного воспаления.
В настоящее время проведение диагностического амниоцентеза для пренатальной диагностики интраамниальной инфекции / воспаления и синдрома воспалительного ответа плода, проводится крайне редко, поэтому ультразвуковая диагностика может помочь в неинвазивной оценке плодов с риском преждевременных родов. Фетальный тимус является одним из самых интригующих органов в этом контексте. Недавно он был предложен в качестве маркера для диагностики внутриутробного воспаления плода. В данном обзоре будут описаны случаи преждевременных родов и развитие неинвазивной визуализации тимуса, как одного из методов оценки случаев с высоким уровнем спонтанных преждевременных родов.
ПРЕЖДЕВРЕМЕННЫЕ РОДЫ
Инфекция является причиной 25-40% преждевременных родов. Микробное инфицирование амниотической жидкости обнаруживается у 12,8% женщин с преждевременными родами с неповрежденными околоплодными оболочками, и у 32,4% женщин с ПРПО. Микробная инвазия амниотической жидкости (MИAЖ) диагностируется полимеразной цепной реакцией. Первыми по частоте выявления являются микоплазмы и Ureoplasma urealyticum. Также оказываются Streptococcus agalactiae, кишечная палочка, Fusibacterium species и Gardnerella vaginalis.
СИНДРОМ ВОСПАЛИТЕЛЬНОГО ОТВЕТЫ ПЛОДА (СВОП)
Синдром воспалительного ответа плода (СВОП) развивается по типу системной воспалительной реакции, что приводит к поражению органов, которое связано с повышением заболеваемости и смертности новорожденных. Около 39% случаев преждевременных родов осложнены СВОП.
Определение высокой концентрации в крови плода различных цитокинов (то есть IL-1, IL-6 и TNF-α) является признаком СВОП. Концентрация IL-6 выше 11 нг/мл в крови плода, было доказано, является предиктором тяжелой неонатальной заболеваемости и была установлена в качестве критерия для определения плодов с или без СВОП.
СВОП вызывает изменения во всех органах и системах плода, а также в амниотической жидкости, хориоамниотической мембране, шейке матки и миометрии. Процесс направлен на начало родовой деятельности, что объясняется изгнанием инфицированной ткани из организма матери.
ИМУННАЯ СИСТЕМА ПЛОДА
Инфекция/воспаление индуцирует ответ провоспалительных T-хелперов, что приводит к повышенному образованию TNFα и IL-1, оба увеличивают уровни матриксных металлопротеиназ (ММР), в результате чего продуцируются материнские простагландины. Они, как известно, связаны с патологической активацией процесса родоразрешения, что ведет к преждевременным родам, однако, они также могут влиять на развитие плода. Эти процессы могут привести к повреждению многих органов, включая альвеолы в легких (что приводит к бронхолегочной дисплазии (БЛД)), нейроны головного мозга (что может привести к неблагоприятным неврологическим результатам, таким как ДЦП), сердце (уменьшение диастолы приводит к снижению сердечного выброса, который может повторно способствовать гипоксическому/ ишемическому поражению головного мозга) и другие органы плода, такие как кожа, почки и надпочечники. Данные процессы свидетельствуют о том, что существует прямая связь между развитием СВОП и последующими осложнениями у новорожденных.
ТИМУС
Размер тимуса
Уменьшенный размер тимуса может быть связан с увеличением смертности новорожденных. Хорошо известно, что дети с синдромом DiGeorge или с вело-кардио-фациальным-синдромом (VCFS), которые связаны с микроделецией 22q11 хромосомы, имеют гипоплазию или аплазию тимуса. Были проведены исследования, которые показали, что внутриутробная сонографическая диагностика уменьшенного тимуса у плодов с пороками сердца (особенно с дефектами конотрункуса) увеличивает вероятность того, что эти плоды имеют также патологию 22q11 хромосомы. Также описаны случаи уменьшенного тимуса у плодов с ЗВУР, и беременности, осложненные преэклампсией и в плодах с трисомией 21.
Изменения в тимусе во время воспаления / инфекции
De Felice и др. сообщают, что размер тимуса, который определяется путем измерения кардиотимического размера на рентгенограмме грудной клетки при рождении и оценивается как соотношение кардиотимического размера к грудной клетке (CT / T), значительно меньше у новорожденных с очень низкой массой тела, преждевременно рожденных от матерей с признаками субклинического хориоамнионита. Гистологические исследования подтвердили уменьшенный размер тимуса у плодов, которые умерли в результате преждевременных родов с признаками хориоамнионита.
Пренатальная диагностика тимуса
Пренатальная диагностика вилочковой железы описывалась в протоколах УЗ-диагностики с частотой 74% в конце 1980 годов. В начале 2000-х сонографистам удалось обнаружить фетальный тимус у> 99% плодов, во время первого и второго пренатального скрининга (рис.1).
Рис.1 Сонограмма плода на 28 неделе гестации, четко визуализируется ткань сниженной эхогенности тимуса (стрелки), на уровне кардиального среза трех сосудов.
ЗАКЛЮЧЕНИЕ
Размер фетального тимуса был связан с тяжестью внутриутробной инфекции. Доказательства в поддержку этой точки зрения включают в себя следующее: (I) размер тимуса ниже 5-го процентиля был обнаружен во всех случаях внутриутробной инфекции. (II) Кроме того, уменьшенный размер вилочковой железы был обнаружен в 71% случаев преждевременных родов, которые имели гистологически подтвержденный хориоамнионит и только в 12% случаев преждевременных родов без признаков хорионамнионита.
Исследование показывает, что женщины, которые поступают в клинику с преждевременными родами с неповрежденными околоплодными оболочками и с ПРПО должны пройти детальное ультразвуковое исследование фетального тимуса, как маркера участия плода в процессе внутриутробного воспаления.
Тимус у новорожденных что
Московский областной НИИ акушерства и гинекологии
Московский областной НИИ акушерства и гинекологии
Московский областной НИИ акушерства и гинекологии
Московский областной НИИ акушерства и гинекологии
Московский областной НИИ акушерства и гинекологии
Московский областной НИИ акушерства и гинекологии
Московский областной НИИ акушерства и гинекологии
Московский областной НИИ акушерства и гинекологии
Состояние вилочковой железы и иммунного статуса у новорожденных с внутриутробной инфекцией
Журнал: Российский вестник акушера-гинеколога. 2013;13(4): 27-30
Аксенов А. Н., Бочарова И. И., Башакин Н. Ф., Троицкая М. В., Лебедева Е. А., Обидина А. А., Новикова С. В., Шугинин И. О. Состояние вилочковой железы и иммунного статуса у новорожденных с внутриутробной инфекцией. Российский вестник акушера-гинеколога. 2013;13(4):27-30.
Aksenov A N, Bocharova I I, Bashakin N F, Troitskaia M V, Lebedeva E A, Obidina A A, Novikova S V, Shuginin I O. The thymus and immune status in neonatal infants with intrauterine infection. Russian Bulletin of Obstetrician-Gynecologist. 2013;13(4):27-30.
Московский областной НИИ акушерства и гинекологии
Проведено обследование 158 доношенных новорожденных из группы высокого инфекционного риска, включающее ультразвуковую тимометрию и состояние иммунного статуса. Показано, что метод ультразвуковой тимометрии является высокоинформативным, доступным, безопасным и может быть применен у новорожденных в раннем неонатальном периоде. Нормативными значениями объема вилочковой железы у доношенных новорожденных в раннем неонатальном периоде следует считать от 1 до 2,5 мл/кг. Предложенные ультразвуковые критерии патологии тимуса в виде увеличения объема более 2,5 мл/кг или его уменьшения менее 1 мл/кг могут быть использованы в качестве ранних диагностических критериев внутриутробной инфекции и нарушений иммунного статуса у новорожденных.
Московский областной НИИ акушерства и гинекологии
Московский областной НИИ акушерства и гинекологии
Московский областной НИИ акушерства и гинекологии
Московский областной НИИ акушерства и гинекологии
Московский областной НИИ акушерства и гинекологии
Московский областной НИИ акушерства и гинекологии
Московский областной НИИ акушерства и гинекологии
Московский областной НИИ акушерства и гинекологии
Проблема ранней диагностики внутриутробной инфекции (ВУИ), прогнозирования ее манифестации и осложнений нарушенного иммунного статуса остается актуальной, несмотря на значительное количество существующих бактериологических и иммунологических диагностических тестов. Большинство применяемых для диагностики ВУИ иммунологических методик являются дорогостоящими и трудоемкими, что делает их недоступными для скринингового обследования новорожденных.
Центральным органом иммуногенеза у новорожденных является вилочковая железа (ВЖ). У детей с патологией ВЖ отмечается высокая летальность, особенно в неонатальном периоде, так как на фоне патологии иммунной системы усугубляется течение практически любого заболевания. По данным разных авторов [4, 6], частота иммунодефицитных состояний (ИДС), обусловленных врожденной патологией ВЖ, колеблется от 2-3 до 98 случаев на 1000 вскрытий детей, умерших в периоде новорожденности. Такой разброс, по-видимому, обусловлен тем, что более чем у 90% детей ИДС своевременно не диагностируются.
До недавнего времени ведущим методом исследования состояния ВЖ была рентгенография органов грудной клетки. Сравнение рентгеновских данных с результатами патологоанатомического исследования указывает на их неточность, что может быть обусловлено индивидуальными особенностями строения железы, дистопией органа, глубоким выдохом во время рентгенографии, техническими ошибками. Кроме того, значительная лучевая нагрузка не позволяет широко использовать этот метод у новорожденных (Ж.Н. Бабаева, О.А. Споров, 1987).
В настоящее время для диагностики патологии ВЖ у детей раннего возраста, в том числе новорожденных, используется эхография. Ультразвуковое исследование (УЗИ) по сравнению с рентгенологическим является более чувствительным и специфичным методом для выявления патологии ВЖ в неонатальном периоде [1, 7]. Наиболее важной количественной оценкой размеров ВЖ является отношение ее массы к массе тела ребенка, и в норме оно колеблется от 0,18 до 0,38%. Врожденная стойкая гиперплазия ВЖ диагностируется у новорожденных при увеличении массы, объема, отношения массы железы к массе тела ребенка в 2 раза. Дети с тимомегалией склонны к возникновению и затяжному течению инфекционно-воспалительных заболеваний, различных проявлений аллергии [3]. Врожденная гипоплазия ВЖ характеризуется уменьшением размеров органа в 2 раза ниже по сравнению с нормой, при этом соотношение массы ВЖ к массе тела ребенка не превышает 0,1%. Доказана связь между патологией ВЖ и осложненным течением неонатального периода, поэтому рекомендуется проведение УЗИ ВЖ всем новорожденным с различной патологией. Выявление врожденной тимомегалии и гипоплазии ВЖ требует индивидуального подхода к проведению лечебных и профилактических мероприятий, в том числе иммунокоррекции.
Поскольку основным органом иммунной системы у плода и новорожденного является тимус, то исследования по сопоставлению морфологических особенностей ВЖ и иммунного статуса новорожденных группы высокого инфекционного риска для выявления информативных и доступных критериев ранней диагностики ВУИ являются целесообразными. Работы по изучению состояния ВЖ у новорожденных детей немногочисленны [2, 5, 8] и посвящены, в основном, ее эхографической характеристике у здоровых новорожденных. Анализ результатов УЗИ тимуса в сочетании с комплексной клинической оценкой состояния ребенка и показателями иммунного статуса позволит уточнить место ультразвуковой тимометрии в ранней диагностике ВУИ у новорожденных.
Материал и методы
Проведено обследование 158 доношенных новорожденных, родившихся у матерей с инфекционно-воспалительными заболеваниями урогенитального тракта. Для выявления клинико-лабораторных корреляций новорожденные были разделены на шесть групп в зависимости от основного клинического диагноза:
1-ю группу составили 29 новорожденных с генерализованными и тяжелыми локализованными формами ВУИ, которые включали сепсис, менингоэнцефалит, пневмонию, гастроэнтероколит; 2-я группа состояла из 19 новорожденных с локализованными инфекционными процессами средней степени тяжести, а именно: везикулопустулез, конъюнктивит, ринит, омфалит, вульвовагинит, локальные формы кандидоза; 3-я группа объединила 16 новорожденных с выявленными при УЗИ морфологическими изменениями в центральной нервной системе (ЦНС) и внутренних органах, что позволило предположить перенесенную ВУИ; 4-ю группу составили 19 новорожденных с гипоксическими повреждениями ЦНС разной степени тяжести; 5-я группа включала 18 новорожденных с задержкой внутриутробного развития (ЗВУР); 6-я группа состояла из 57 клинически здоровых новорожденных.
Всем новорожденным наряду с клиническими микробиологическими, иммунологическими методами исследования, было проведено УЗИ ВЖ с расчетом ее объема на 1 кг массы тела ребенка.
Методика ультразвуковой тимометрии
ВЖ расположена ретростернально в переднем средостении. Ее верхняя часть на 1-1,5 см выступает над ключицами, нижняя достигает третьего-четвертого межреберья, а задняя поверхность прилежит к крупным сосудам (аорта, легочная артерия, нижняя полая вена) и перикарду. Железа состоит из двух соприкасающихся долей, граница между которыми не дифференцируется при УЗИ, но в 3% случаев они могут располагаться отдельно.
В большинстве современных УЗ-сканеров имеются встроенные программы расчета объемов измеряемых объектов, что значительно ускоряет работу.
Масса ВЖ в граммах соответствует суммарному объему в миллилитрах, так как удельная плотность ВЖ равна 1,0.
Результаты и обсуждение
На основании оценки клинических данных и показателей иммунитета с использованием перцентильной шкалы основных иммунологических показателей у обследованных новорожденных были выделены следующие варианты иммунного реагирования в раннем неонатальном периоде.
У новорожденных с тяжелыми формами ВУИ были выявлены два варианта иммунного ответа.
При первом варианте (15 новорожденных) отмечалась активация клеток врожденного и адаптивного иммунитета в сочетании с незрелостью и глубоким нарушением их эффекторных функций в виде значительного повышения числа незрелых клеток врожденного и адаптивного иммунитета, дефицита зрелых иммунокомпетентных клеток, увеличения продукции ИЛ-8 более 50 пг/мл, низкой способности к продукции лимфокинов, что являлось характерным для наиболее тяжелых, генерализованных форм ВУИ с ранней манифестацией, предположительно на фоне позднего антенатального инфицирования, с высоким риском летального исхода. Размеры ВЖ в 60% случаев (у 9 детей) составляли более 2,5 мл/кг, у 3 детей (20%) тимус был менее 1 мл/кг, в 3 случаях размеры ВЖ находились в пределах от 1 до 2,5 мл/кг (см. таблицу).
По нашему мнению, изменения ЦНС и внутренних органов, выявленные при рождении, в сочетании с показателями иммунитета позволяют предположить наличие раннего внутриутробного инфицирования, преимущественно вирусной этиологии с благоприятным исходом для жизнеспособности плода на фоне этиотропной терапии в антенатальном периоде, но с формированием стойких структурных изменений, преимущественно в ЦНС, к моменту рождения. По-видимому, этот клинико-иммунологический вариант патологии новорожденных следует рассматривать как перенесенную внутриутробную вирусную инфекцию.
Показатели иммунитета у 34 клинически здоровых новорожденных (6-я группа) без микробной контаминации статистически значимо не отличались от нормативных значений. При лабораторно установленной микробной контаминации у 23 здоровых новорожденных было выявлено увеличение числа зрелых Т- и В- лимфоцитов, основных субпопуляций Т-лимфоцитов, уровня IgG в сыворотке крови, снижение количества нейтрофилов и моноцитов без нарушения продукции лимфокинов. Объем тимуса находился в пределах от 1 до 2,5 мл/кг.
Выводы
1. Проведенные исследования показали четкую взаимосвязь между объемом ВЖ, наличием и степенью тяжести клинических проявлений ВУИ и дефектами иммунитета у новорожденных в раннем неонатальном периоде.
2. Нормативными значениями объема ВЖ у доношенных новорожденных в раннем неонатальном периоде следует считать от 1 до 2,5 мл/кг.
3. Выявленная эхоскопически тимомегалия с объемом ВЖ более 2,5 мл/кг была статистически значима для тяжелых форм ВУИ с нарушениями иммунного ответа в виде: незрелости и активации клеток как врожденного, так и адаптивного иммунитета с глубоким нарушением их эффекторных функций.
4. Уменьшение объема ВЖ менее 1 мл/кг коррелировало с дисфункцией иммунитета в виде дефицита зрелых иммунокомпетентных клеток с диссоциацией их эффекторных функций и недостаточностью провоспалительного ответа, что клинически характеризовалось затяжным течением ВУИ и высокой частотой постнатальных инфекционно-воспалительных заболеваний у новорожденных.
5. Увеличение объема тимуса более 2,5 мл/кг или его уменьшение менее 1 мл/кг у новорожденных в раннем неонатальном периоде следует рассматривать в качестве одного из показаний к проведению им заместительной иммунокоррекции.
6. Метод ультразвуковой тимометрии является высокоинформативным, доступным, безопасным и может быть включен в алгоритм обследования новорожденных группы высокого инфекционного риска.
ТИМОМЕГАЛИЯ И СИНДРОМ ПЛАТТЕРА
История относительно интенсивного изучения вилочковой железы ( glandula thymus, thymus ) насчитывает около 400 лет. Начало его относится к 1614 г., когда профессор Базельского университета Феликс Платтер описал происшедшую у него
В середине XIX в. профессор Венского университета Карл Рокитанский высказал предположение об инкреторной функции вилочковой железы. Данная концепция была положена в основу представлений о тимико-лимфатическом статусе [1, 2] как врожденной особенности конституции, предрасполагающей к внезапной смерти от незначительных причин. В симптомокомплекс тимико-лимфатического статуса включались первичная гиперфункция вилочковой железы, гипоплазия надпочечников, сердца и аорты [1–5]. С этого времени причиной тимической смерти стали считать острую надпочечниковую недостаточность [3, 4]. Однако отсутствие характерных для тимико-лимфатического состояния признаков во многих случаях при такой смерти, в том числе и симптомов надпочечниковой недостаточности, позволило поставить под сомнение и данную концепцию.
В начале 1960-х гг. было доказано, что тимус является центральным органом иммунной системы. С этого времени вилочковая железа рассматривается в качестве железы внутренней секреции, действие гормонов которой направлено на дифференцировку тимических лимфоцитов. Открытие основной функции вилочковой железы — продукции Т-лимфоцитов и регуляции иммунитета, а также принадлежность ее к системе эндокринных желез позволяют рассматривать данный орган как коммутатор иммунной и эндокринной систем. В серии работ отечественных исследователей последних 20 лет доказывается, что дети с большой вилочковой железой относятся к числу иммунодефицитных лиц.
В 1970 г. проф. Т. Е. Ивановской [6] для обозначения увеличенной вилочковой железы вместо вышеуказанных терминов был предложен термин «тимомегалия». Под тимомегалией российские морфологи понимают увеличение объема и массы тимуса выше предельных возрастных значений с сохранением нормальной гистоархитектоники органа. Начиная с 1970 г., этот термин стал широко использоваться как морфологами, так и клиницистами.
Однако проведенные исследования показали, что тимомегалия является лишь одним из симптомов того состояния, которое существует у детей, имеющих увеличенную вилочковую железу [7]. В связи с отсутствием другого термина, отражающего сущность состояния, которое имеет место у детей с увеличенной вилочковой железой (соответствующей тимомегалии в понимании патологоанатомов), предлагаем называть его синдромом Платтера.
Термином «синдром Платтера» следует обозначать состояние, при котором клинические и параклинические методы обследования позволяют выявить у детей и подростков ряд специфических изменений организма, сочетающихся с первичной длительно сохраняющейся тимомегалией. Клиническое понимание тимомегалии при синдроме Платтера отражает морфологическое состояние вилочковой железы, при котором масса и объем тимуса превышают предельные возрастные значения при сохранении нормальной гистоархитектоники органа.
Диагностика тимомегалии в клинической практике
Ориентировочная диагностика тимомегалии может быть проведена с помощью объективного исследования: осмотра, пальпации, перкуссии. Однако оценка результатов во многом субъективна и зависит от опыта исследователя [7].
Из инструментальных методов, позволяющих объективно выявить тимомегалию, используются рентгенодиагностика и ультразвуковое исследование (УЗИ).
Рентгенодиагностика. Методологической основой рентгенодиагностики увеличенного тимуса является следующее положение: в норме у детей любого возраста на стандартных рентгенограммах грудной клетки в прямой проекции тень тимуса не должна выходить за пределы тени сосудистого пучка и сердца.
В целях диагностики тимомегалии на рентгенограммах грудной клетки в прямой проекции мы применяли кардио-тимико-торакальный индекс (КТТИ) по J. Gewolb [8] и вазокардиальный индекс (ВКИ) [7]. Оба индекса определяются на стандартных рентгенограммах грудной клетки в прямой проекции. КТТИ представляет собой частное от деления ширины сосудистого пучка на уровне бифуркации трахеи (точка carina) на ширину грудной клетки на уровне купола диафрагмы. ВКИ представляет собой частное от деления ширины сосудистого пучка на уровне бифуркации трахеи (точка carina) на максимальную ширину тени сердца. Максимальная ширина тени сердца определяется как сумма двух перпендикулярных отрезков, опущенных на вертикальную линию (проведенную через середину позвоночного столба) из максимально удаленных от нее точек сердца слева и справа (рис. 1).
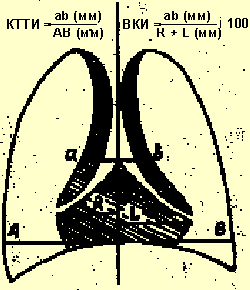 |
| Рисунок 1. Схема вычисления индексов КТТИ и ВКИ |
Выявление в средостении характерной овальной, треугольной или лентовидной тени с прямым, волнообразным или неровным контуром, расположенной с одной или обеих сторон сосудистого пучка, искажающей линию «сердечной талии» слева и/или вазокардиальный угол справа, позволяет сделать заключение о существовании у пациента тимомегалии. Наличие увеличенных значений КТТИ и ВКИ подтверждает данный диагноз. Рентгенологический метод, однако, информативен только для детей грудного и раннего возраста, поскольку у детей в возрасте старше 3 лет, как правило, тимус располагается за тенью сосудистого пучка и сердца. В таблице 1 приведены значения КТТИ и ВКИ у детей первых 3 лет жизни при разных степенях увеличения тимуса.
УЗИ. УЗИ тимуса в нашей стране впервые было проведено у новорожденных детей С. М. Воеводиным [9]. Путем клинико-морфологических сопоставлений нами были разработаны коэффициенты пересчета линейных параметров тимуса в более привычные для клиницистов формы (объема и массы органа). Округленные величины указанных коэффициентов, по нашим данным, равны 0,7 (для массы) и 0,5 (для объема). Таким образом, величины массы и объема тимуса при ультразвуковом сканировании вычисляются следующим образом:
М = 0,7 в a в b в c;
V = 0,5 в a в b в c,
где a, b, c — линейные параметры тимуса (ширина, длина, передне-задний размер, выраженные в см); 0,7 и 0,5 коэффициенты пересчета линейных параметров на массу и объем органа соответственно [10]. Для практических целей массу и объем вилочковой железы достаточно определять так, как это указано выше: без вычисления объема и массы отдельных долей.
Методом центильного распределения нами были определены нормальные значения массы и объема тимуса для детей в возрасте 1–24 мес (табл. 2). При превышении массы и объема тимуса выше верхних предельных значений нормы состояние ребенка следует расценивать как тимомегалию.
На основании анализа более 5000 рентгенограмм, выполненных у детей грудного возраста при подозрении на пневмонию, диагноз которой рентгенологически не был подтвержден, тимомегалия нами была выявлена у 35% пациентов 1 — 3 мес, у 15% детей в возрасте 3–6 мес, у 8% — в возрасте 7–15 мес, у 2% — в возрасте 16 — 36 мес, а в популяции детей старше 3 лет частота выявления тимомегалии не превышала 0,5% [8].
Наблюдение за одними и теми же детьми на протяжении длительного отрезка времени позволило нам сделать вывод, что тимомегалия в детском возрасте может быть как транзиторной, так и стойкой.
В 1993 г. нами совместно с О. В. Зайратьянцем была предложена классификация тимомегалии в детском возрасте на основе клинико-морфологических данных. Несколько измененный вариант указанной классификации приведен в табл. 3 (см. рубрику «Под стекло»). Наиболее частым вариантом тимомегалии в детском возрасте является синдром Платтера.
Анализ родословных позволил выявить у родственников первой и второй линии родства детей с синдромом Платтера высокую частоту встречаемости злокачественных новообразований, аутоиммунных заболеваний и заболеваний системы эндокринных органов. Так, злокачественные новообразования встречаются в каждой третьей семье, где есть дети с синдромом Платтера, с такой же частотой в этих семьях регистрируются эндокринные заболевания (преимущественно сахарный диабет и заболевания щитовидной железы). В семьях детей с синдромом Платтера статистически чаще, чем в семьях детей из выборки общей популяции, распространены аутоиммунные заболевания (диффузные болезни соединительной ткани) и туберкулез. Помимо этого, многие родители детей с указанным синдромом в дошкольном и младшем школьном возрасте относились к группе часто болеющих, т. е. к группе детей имевших повышенную склонность к острым респираторным вирусным инфекциям (ОРВИ).
Характер перечисленных заболеваний (склонность к вирусным, аутоиммунным, онкологическим заболеваниям, туберкулезу) может указывать на существование у близких родственников детей с синдромом Платтера недостаточной активности клеточного звена иммунной системы, поскольку, согласно современным воззрениям, все перечисленные заболевания находятся под контролем Т-клеточного иммунитета, формируемого вилочковой железой. При этом не совсем ясно, чем объясняется высокая отягощенность родственников детей с синдромом Платтера болезнями системы эндокринных органов. Однако не следует забывать о том, что эндокринные заболевания (в том числе сахарный диабет, диффузный токсический зоб, гипотиреоз) могут иметь аутоиммунный генез.
В таком случае у близких родственников детей с синдромом Платтера отчетливо просматривается тенденция к заболеваниям, связанным с иммунными механизмами клеточного типа, контролирующимися вилочковой железой. Это позволяет предполагать возможность передачи детям, у которых развился синдром Платтера, какого-то дефекта Т-звена иммунной системы.
Антенатальный период у большинства детей с синдромом Платтера осложняется хронической гипоксией, обусловленной острыми инфекционными заболеваниями или обострением хронических экстрагенитальных заболеваний матерей, наличием у них сосудистой дистонии, анемии, гестозов.
Осложненное течение интранатального периода отмечается не менее чем у 2/3 детей с синдромом Платтера. Наиболее частыми осложнениями этого периода явились стремительные или затяжные роды, приведшие к наложению щипцов или экстренному кесареву сечению.
Группа детей с указанным синдромом по фенотипу гетерогенна. 90% детей имеют мягкие округлые формы тела, некоторую пастозность тканей, относительно крупные черты уплощенного лица, прямой тип лба, широкоовальные глаза, относительно короткий нос с низким переносьем, средней величины или толстые губы, слабый изгиб профиля, короткую шею. Дети этой группы имеют как бы увеличенные поперечные размеры тела: широкое лицо, широкая грудная клетка, широкие плечи, широкие ладони и стопы, относительно короткие и широкие пальцы. Около 3/4 детей-европеоидов этой подгруппы имеют нежную, но несколько утолщенную, слабопигментированную белую кожу, для которой характерно быстрое развитие ожога после инсоляции, светлую окраску волос и глаз, слабое развитие мускулатуры, сниженную физическую активность. Дети данной подгруппы отличаются хорошим (и даже избыточным) аппетитом и высокими темпами роста.
В дошкольном и младшем школьном возрасте у них отмечаются хорошее развитие подкожного жирового слоя, слабое развитие мускулатуры, снижение общего тонуса и тургора тканей, а также физической активности, замедленная реакция на внешние раздражители, замедленное образование новых условных рефлексов, ослабление процессов внутреннего торможения с преобладанием реакций внешнего торможения.
Клиническая характеристика детей с синдромом Платтера включает характеристику системы лимфоидных органов, которая, согласно мнению большинства исследователей, отличается генерализованной гиперплазией системы лимфоидных органов: лимфатических узлов, лимфатических фолликулов корня языка, задней поверхности глотки, поверхности надгортанника, гипертрофией небных и глоточной миндалин. Наши наблюдения, однако, показали, что состояние периферических лимфоидных органов зависит от воздействия антигенного стимула — при отсутствии такого воздействия генерализованная гиперплазия периферического лимфоидного аппарата не развивается [7].
К числу особенностей физического развития детей грудного и раннего возраста относятся: высокие темпы увеличения длины тела, слабое развитие скелетной мускулатуры, несвоевременность и неправильный порядок прорезывания молочных зубов, относительно позднее начало самостоятельной ходьбы.
В эмоциональной сфере в первые 2–3 мес жизни обращает внимание менее выраженный комплекс оживления (за счет снижения двигательной активности).
Начало становления речи у детей с синдромом Платтера не отличалось от такового у детей соответствующего возраста в популяции в целом: гуление, слоги и первые слова у них появлялись своевременно.
К возрасту 10–11 мес они начинали произносить первые одно- и двусложные слова, к 1 году количество активно произносимых слов достигало 10–12. В дальнейшем 8% детей данной группы до 2-летнего возраста продолжали пользоваться только этими 10–12 словами. В возрасте 4,5–6 лет 25% детей этой группы страдали дислалией, требующей проведения корригирующих логопедических занятий в условиях детской поликлиники или в условиях специализированного детского сада. У отдельных пациентов нарушение, связанное с произношением звуков, сохранялось и в подростковом возрасте.
Состояние здоровья детей с синдромом Платтера. Здесь рассматриваются только те заболевания и патологические состояния, которые достоверно чаще встречались у детей с указанным синдромом, по сравнению с детьми из общей популяции. При анализе структуры выявленных заболеваний наибольшую по численности группу составили аномалии развития (выявлены у 80% наблюдавшихся пациентов) — пороки развития, множественные стигмы дизэмбриогенеза, биохимические дефекты. Пороки развития чаще проявлялись гипоплазией органов и тканей: широкие отверстия паховых каналов и пупочного кольца, септальные дефекты в сердце, гипоплазия аорты, сердца, легких, почек, щитовидной железы и др.
Вторая группа заболеваний была представлена патологическими состояниями нервной системы. Наряду с заболеваниями нервной системы, обусловленными биохимическими дефектами (синдром Менкеса; ганглиозидоз Gm1; фенилкетонурия; галактоземия), обращали на себя внимание такие синдромы, как гипертензионно-гидроцефальный (у 49%), фебрильных судорог (у 20%), мышечной гипотонии (у 18%) и вегетативно-висцеральной дисфункции (у 12,5%). Включение в комплекс обследования электрофизиологических методов, компьютерной и ядерно-магнитно-резонансной томографии привело к существенному увеличению частоты выявления гипертензионно-гидроцефального синдрома (выявлен у 90%). Указанный синдром у 2/3 детей сочетался с синдромами фебрильных судорог и вегетативно-висцеральных дисфункций, однако последние два синдрома у части детей встречались и изолированно.
Изолированный синдром вегетативно-висцеральных дисфункций характеризовался крайне выраженным полиморфизмом проявлений: нарушение терморегуляции, дыхания, сердечной деятельности, функции желудочно-кишечного тракта, пароксизмальное повышение артериального давления и другие расстройства. Мы склонны считать, что синдром вегето-висцеральных дисфункций у детей с синдромом Платтера встречается значительно чаще, чем у указанных 12,5% пациентов. На существование гиподиагностики синдрома вегето-висцеральных дисфункций могут указывать выявленные нами фенотипические особенности детей, в том числе очень хороший (скорее избыточный) аппетит, склонность к задержке жидкости, как бы немотивированный субфебрилитет. Наши наблюдения показали, что у большинства детей с якобы немотивированным субфебрилитетом последний хорошо контролировался мочегонными средствами, что явно указывает на связь этого симптома с ликворной гипертензией, в том числе с повышением давления в области третьего желудочка мозга — месте локализации центра терморегуляции.
У детей с синдромом Платтера обращал на себя внимание и синдром мышечной гипотонии, который у ряда пациентов был настолько сильно выражен, что специалисты высказывали предположение о наличии у них болезни Верднига–Гоффманна или миелодисплазии.
Таким образом, частое выявление у детей с синдромом Платтера внутренней гидроцефалии, изолированного синдрома вегето-висцеральных дисфункций, наличие вегетативных нарушений указывает на возможность нарушения функции диэнцефальной области. Изменения со стороны скелетной мускулатуры трактовать сложнее. Однако если учесть, что средний мозг, примыкающий к области сильвиева водопровода, контролирует регуляцию мышечного тонуса и сигналы к мышцам поступают через ретикулярную формацию по двум ретикулоспинальным путям [11], то это нарушение может быть рассмотрено с позиции существования у данного контингента детей внутренней гидроцефалии и расстройства ликвородинамики, поскольку гипоталамус, таламус и ретикулярная формация являются звеньями единой суперфункциональной системы, корригирующей гомеостатические программы наиболее сложных вегетативных, эндокринных, трофических и психических функций [12].
У 9% пациентов школьного возраста с синдромом Платтера зарегистрированы заболевания нейроэндокринной и эндокринной системы (диэнцефальный синдром, несахарный диабет, транзиторный несахарный диабет, транзиторный гипопаратиреоз, инсулинозависимый сахарный диабет, поликистоз яичников, эутиреоидная струма, диффузный токсический зоб, субкомпенсированный гипокортицизм). У детей с синдромом Платтера, отмечается тенденция к высоким показателям роста и слабой пигментации кожи, что может также указывать на дисфункцию гипоталамо-гипофизарной системы. Кроме того, у этих детей существует ряд симптомов, которые мы назвали торакальными и к числу которых относится синдром сдавления средостения. Этот синдром мы наблюдали только у детей первых 2–2,5 мес жизни при значительном увеличении тимуса.
Все исследователи, занимавшиеся изучением особенностей лиц со стойкой тимомегалией (а основную группу в них, вне всякого сомнения, составляют дети с синдромом Платтера), обращали внимание на их пониженную физическую активность.
При специальном опросе 72 пациентов в возрасте 10–24 лет с синдромом Платтера у 46% из них было отмечено негативное отношение к физическим нагрузкам, особенно к бегу на длинные дистанции и езде на велосипеде. Подростки и лица молодого возраста, способные передать ощущения, появлявшиеся при физической нагрузке, отмечали на ее фоне чувство слабости, ощущение нехватки воздуха.
Когда у 30 подростков с синдромом Платтера, не имевших органических заболеваний сердца, было проведено эхокардиографическое исследование сердца на аппарате 128 х Р — ACUSON (США) с определением массы миокарда левого желудочка сердца, у 27 из них индексированная (относительно массы тела) масса миокарда левого желудочка сердца оказалась достоверно меньше (р
Л. Г. Кузьменко, доктор медицинских наук, профессор
РУДН, Москва

