при температуре выше 35ос какое будет наблюдаться осмотическое давление
Что такое осмотическое давление воды
Явление осмотического давления в воде было обнаружено и описано еще в 1748 году французским физиком-экспериментатором Жаном-Антуаном Нолле.
Проводя свой эксперимент, Нолле наполнил сосуд этанолом и, закрыв его плотной мембраной, опустил в емкость с чистой водой. Под действием физических сил вода поступала внутрь сосуда с концентрированной жидкостью и создавала там давление, под действием которого сосуд раздувался. В процессе его эксперимента хватало пяти часов, чтобы объем в сосуде увеличился, а мембрана раздулась. Тогда он решил провести обратный опыт и наполнил колбу водой, поместив ее в сосуд со спиртом. Объем в колбе стал уменьшаться, а мембрана начала прогибаться вниз.
Нолле объяснил это явление, как избирательный перенос молекул через мембрану: когда жидкость с меньшей плотностью легко проходила через стенки мембраны, вторая, концентрированная, не могла осуществить диффузию.
Позже было доказано, что если к концентрированному раствору будет приложено давление, то перенос молекул растворителя можно замедлить или остановить в зависимости от величины давления. Наименьшее давление, за исключением давления самого растворителя, которое нужно приложить к раствору, чтобы предотвратить перемещение молекул чистого вещества через мембрану, было названо»«соматическое», а сам процесс произвольного перехода молекул растворителя стали называть «осмос».
От чего зависит осмотическое давление воды
Важным условием осмоса является наличие полупроницаемой мембраны, то есть такого материала, поры которого будут достаточного размера, чтобы свободно пропускать молекулы растворителя и удерживать в растворе частицы растворенного вещества.
Осмотическое давление воды зависит от двух основных факторов:
Это объясняется уравнением Вант-Гоффа. Осмотическое давление воды равно: π = RCT,
Ученый выявил, что осмотическое давление жидкостных растворов, подчиняется тем же законам, что и давление газовых систем. С помощью данного уравнения определяется величина давления.
Оно не зависит от состава растворенного вещества, поэтому осмотическое давление считается коллигативным свойством раствора, то есть обусловленным самопроизвольным движением молекул, их количеством, а не составом.
Для возникновения осмотического давления воды в системе необходимо два критерия:
Как определить осмотическое давление воды
Динамический метод определение осмотического давления воды позволяет быстро и точно получить результат. Он основывается на определении объемной скорости пропускания и выдавливания молекул растворителя через мембраны с различным давлением в ячейке с последующим вычислением промежуточных значений среди полученных результатов.
Многие приборы позволяют проводить вычисления обоими методами. Единственным важным условиям проведения измерения является правильный подбор полупроницаемой мембраны. На практике чаще всего применяются:
Роль осмотического давления воды для живых организмов
Не менее важную роль осмос играет в экологии водоемов. При изменении концентрации солей в воде, обитатели могут погибнуть, так, например, если поместить пресноводное животное в морскую воду, то оно вскоре потеряет пятую часть своего веса, а если морского обитателя перенести в пресную воду, то из-за диффузии молекул повысится уровень внутриклеточной жидкости, клетки его органов разбухнут и лопнут.
Осмотическое давление морской воды
Осмотическое давление морской воды составляет примерно 25 бар, что существенно выше осмотического давления пресной воды. Поэтому процесс опреснения морской воды методом обратного осмоса проходит при существенно больших давлениях (40-60 бар). Естественно, для разных морей и океанов величина осмотического давления будут разниться за счет разной концентрации солей.
Где применяют осмотическое давление воды
Знание и правильное применение законов осмотического давления воды необходимо в медицине, биологии, энергетике и промышленности. На них основываются многие физико-биологические процессы, процессы получения веществ, а также способы очистки воды.
Физиология и нарушения водно-солевого обмена (методические материалы к практическим и семинарским занятиям)
Информация
Справочное пособие содержит информацию о физиологии водно-солевого обмена (ВСО). Также представлена информация о методах клинической и лабораторной диагностики нарушений ВСО. Перечислены варианты дисгидрий и методы лечения. Предназначается для врачей всех специальностей, курсантов ФПК и студентов медвузов.
Вода организма
Электролитный состав организма
Факторы, влияющие на перемещение внеклеточной воды в организме
Как уже упоминалось выше, вода является транспортной средой, переносящей питательные вещества и кислород к клеткам и уносящей продукты метаболизма от клеток через интерстициальное пространство в кровоток. Возникает вопрос – каким образом вода «знает» куда и что переносить?
Физиология рассматривает три фактора, определяющих целенаправленное движение воды при транскапиллярном обмене:
2. Часть осмотического давления, создаваемую в биологических жидкостях белками, называют коллоидно-осмотическим (онкотическим) давлением (КОД).
Оно составляет примерно 0,7% осмотического давления (или осмотической концентрации), т. е. около 25 мм рт. ст. (2 мосмоль/кг), но имеет исключительно большое функциональное значение в связи с высокой гидрофильностью белков и неспособностью их свободно проходить через полупроницаемые биологические мембраны.
Механизмы поддержания внутриклеточного объема жидкости и внутриклеточного ионного состава
«Натриевый насос». Мембранная проницаемость Na+ в общем в 10-20 раз меньше, чем К+. Однако наличие градиента концентраций Na+ во вне- и внутриклеточном пространствах и отрицательный внутриклеточный заряд могли бы обеспечить силу, способную двигать Na+ в сторону клетки.
В действительности этого не происходит, поскольку такая сила оказывается сбалансированной другой, действующей в обратном направлении и называемой натриевым насосом. Энергия натриевого насоса, являющегося специфическим свойством клеточной мембраны, обеспечивается гидролизом аденозинтрифосфата (АТФ) и направлена на выталкивание Na+ из клетки [Whittman R., Wheeler К. Р., 1970].
Эта же энергия способствует движению К+ внутрь клетки. Установлено, что противоположно направленные движения К+ и Na+ осуществляются в пропорции 2:3. По мнению М. W. В. Bradbury (1973), с физиологической точки зрения для К+ этот механизм не столь существен, так как последний в норме обладает высокой способностью проникать через клеточную мембрану. Описанный механизм является основным для обеспечения постоянства концентрации клеточных и внеклеточных компонентов. Принципиально важен тот момент, что осмолярность внутриклеточной воды величина достаточно постоянная и не зависящая от осмолярности внеклеточного пространства. Это постоянство обеспечивается энергозависимым механизмом.
При температуре выше 35ос какое будет наблюдаться осмотическое давление
Осмотическое давление раствора прямо пропорционально концентрации растворенных в нем частиц. Это справедливо для растворенных веществ как с большим, так и малым размером молекул. Например, одна молекула альбумина с молекулярной массой 70000 создает такой же осмотический эффект, как одна молекула глюкозы, молекулярная масса которой равна 180. Одна молекула NaCl, однако, обладает двумя осмотически активными частицами: ионами Na+ и Cl-, осмотический эффект которых (по сравнению с альбумином или глюкозой) в 2 раза выше, поэтому осмотическое давление раствора пропорционально его осмолярности — мере концентрации растворенных частиц.
В соответствии с правилом Вант-Гоффа осмотическое давление (π) можно рассчитать по формуле: π = CRT, где С — концентрация растворенного вещества в осмолях на литр, R — универсальная газовая постоянная и Т — температура в градусах по Кельвину (273° + температура по Цельсию). Если π выражается в общепринятых для биологических жидкостей единицах — миллиметрах ртутного столба, Т соответствует нормальной температуре тела (273° + 37° = 310° по Кельвину), рассчитанное значение π для раствора 1 осм/л составит 19300 мм рт. ст. Это значит, что для концентрации 1 мосм/л π равно 19,3 мм рт. ст. Таким образом, каждый миллиосмоль трансмембранного градиента концентрации создает осмотическое давление 19,3 мм рт. ст.
а) Расчет осмолярности и осмотического давления раствора. Предполагая, что мембрана непроницаема для растворенного вещества, можно рассчитать возможное осмотическое давление раствора, используя правило Вант-Гоффа. Например, осмотическое давление 0,9% раствора NaCl рассчитывают следующим образом: 0,9% означает, что 100 мл раствора содержит 0,9 г NaCl, или 9 г/л. Поскольку молекулярная масса NaCl составляет 58,5 г/моль, молярность раствора составит: 9 г/л разделить на 58,5 г/моль, или 0,154 моль/л. Поскольку каждая молекула NaCl эквивалентна 2 осмолям, осмолярность раствора составит: 0,154×2, или 308 мосм/л. Следовательно, осмолярность раствора равна 308 мосм/л. Возможное осмотическое давление раствора составит: 308 мосм/л х 19,3 мм рт. ст., или 5944 мм рт. ст.
Данный расчет является приблизительным, поскольку в растворе вследствие сил межионного взаимодействия между ионами Na+ и Сl- нет полной независимости. Теоретически рассчитанное с помощью правила Вант-Гоффа значение следует скорректировать с учетом поправки, носящей название осмотического коэффициента. Для NaCl он равен 0,93. Следовательно, реальное значение осмолярности 0,9% раствора NaCI составит 308×0,93, или 286 мосм/л. На практике при определении осмолярности и осмотического давления растворов, используемых для инфузий, поправкой на осмотический коэффициент иногда пренебрегают.
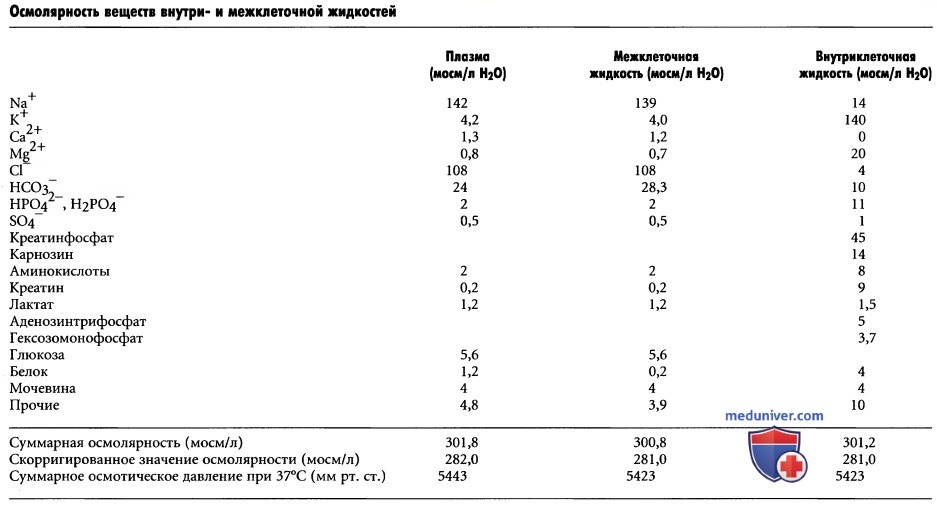
б) Осмолярность жидких сред организма. В таблице выше, обратим внимание на приблизительные значения осмолярности различных веществ, растворенных в плазме, межклеточной и внутриклеточной жидкостях. Отметим, что около 80% всей осмолярности межклеточной жидкости обусловлены ионами Na+ и Cl-, тогда как во внутриклеточной жидкости почти половина осмолярности создается ионами К+, а оставшаяся часть распределена между ионами других веществ.
Как видно из таблицы выше, суммарная осмолярность каждой из трех основных жидкостей организма составляет около 300 мосм/л. По сравнению с межклеточной и внутриклеточной жидкостями осмолярность плазмы на 1 мосм/л выше. Это небольшое различие обусловлено белками, которые поддерживают в просвете капилляров более высокое давление (выше на 20 мм рт. ст.), чем в окружающей межклеточной жидкости.
в) Скорригированное значение осмолярности жидких сред организма. В нижней строке таблицы выше приведено скорригированное значение осмолярности плазмы, межклеточной и внутриклеточной жидкостей. Причиной введения поправок являются силы притяжения и отталкивания между ионами или молекулами в растворе, которые вызывают, соответственно, небольшое увеличение или небольшое снижение осмотической «активности» растворенного вещества.
г) Суммарное осмотическое давление жидких сред организма. В таблице выше также приведены суммарные значения осмотического давления различных жидкостей, измеренные по разные стороны мембраны, при этом одна ее сторона погружалась в дистиллированную воду. Отметим, что суммарное давление в плазме равно произведению скорригированной осмолярности плазмы (282 мосм/л) на коэффициент 19,3. В итоге получим 5443 мм рт. ст.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
При температуре выше 35ос какое будет наблюдаться осмотическое давление
Поддержание адекватного объема одной или обеих (внутри- и внеклеточной) жидких сред организма является частой проблемой при лечении тяжелобольных. Распределение внеклеточной жидкости между плазмой и межклеточным пространством в основном зависит от уравновешивания сил гидростатического и коллоидно-осмотического давления, которые действуют на мембрану капилляров.
Распределение жидкости между внутри- и внеклеточной средами в основном определяется осмотическими силами мелких молекул растворенных веществ, преимущественно натрия, хлора и других электролитов, действующих по разные стороны мембраны. Причина этого распределения обусловлена свойствами мембран, проницаемость которых для воды высока, а для ионов даже очень небольшого диаметра, таких как натрий и хлор, практически равна нулю. Следовательно, вода быстро проникает через мембрану, а внутриклеточная жидкость, тем не менее, остается изотоничной по отношению к внеклеточной.
В следующем разделе рассмотрим взаимосвязь между внутри- и внеклеточной жидкостями и причины осмотического характера, способные влиять на перенос жидкости между этими средами.
В статье мы рассмотрим только наиболее важные теоретические положения, касающиеся регуляции объемов жидкости.
Теоретические основы осмоса и осмотического давления
Основы осмоса и осмотического давления изложены в отдельной статье на сайте (просим вас пользоваться формой поиска выше). В этой статье мы рассмотрим только наиболее важные теоретические положения, касающиеся регуляции объемов жидкости.
Осмос — процесс диффузии воды через полупроницаемую мембрану. Он происходит из области с высокой концентрацией воды в область с ее низкой концентрацией. Растворение вещества в воде приводит к снижению концентрации воды в данном растворе. Следовательно, чем больше концентрация вещества в растворе, тем ниже в нем содержание воды. Кроме того, вода диффундирует из области с низкой концентрацией вещества (высоким содержанием воды) в область с высокой концентрацией вещества (низким содержанием воды).
Поскольку проницаемость мембраны клеток избирательна (она относительно низка для большинства растворенных веществ, но высока для воды), то при повышении концентрации вещества с одной стороны мембраны вода проникает в эту область путем диффузии. Если растворенное вещество, такое как NaCl, добавить во внеклеточную жидкость, вода будет быстро выходить из клетки до тех пор, пока концентрации молекул воды по обе стороны мембраны не уравняются. Если, напротив, концентрация NaCl во внеклеточной жидкости снизится, вода из внеклеточной жидкости устремится в клетки. Интенсивность, с которой вода диффундирует в клетку, называют осмотической силой.
а) Соотношение молей и осмолей. Поскольку концентрация воды в растворе зависит от количества в нем частиц вещества, под термином «концентрация вещества» (независимо от его химического состава) понимают общее число частиц вещества в растворе. Это число измеряют в осмолях. Один осмоль (осм) соответствует одному молю (1 моль, 6,02×10 23 ) частиц растворенного вещества. Следовательно, каждый литр раствора, содержащий 1 моль глюкозы, соответствует концентрации 1 осм/л. Если молекула диссоциирует на 2 иона, т.е. возникают две частицы (например, NaCl распадается на ионы Na+ и Сl-), то одномолярный раствор (1 моль/л) будет иметь осмолярность 2 осм/л. Аналогично раствор, содержащий 1 моль вещества, которое диссоциирует на 3 иона, например сульфат натрия Na2SО4, будет содержать 3 осм/л. Поэтому термин «осмоль» определяют, ориентируясь не на молярную концентрацию вещества, а на число растворенных частиц.
В целом осмоль — слишком большая величина, чтобы использовать ее в качестве единицы измерения осмотической активности жидких сред организма. Обычно используют 1/1000 осмоли — миллиосмолъ (моем).
б) Осмоляльность и осмолярность. Осмолялъностью называют осмоляльную концентрацию вещества в растворе, которая выражается в количестве осмолей на килограмм растворителя. Когда же речь идет о количестве осмолей в литре раствора, эту концентрацию называют осмолярностью. Для сильно разведенных растворов, которыми являются жидкие среды организма, справедливо использовать оба термина, т.к. разница значений невелика. Во многих случаях сведения о жидких средах организма легче выражать в литрах, чем в килограммах, поэтому в большинстве расчетов, используемых в клинике, а также в следующих главах, за основу принята не осмоляльность, а осмолярность.
в) Осмотическое давление. Осмос молекул воды через избирательно проницаемую мембрану может быть уравновешен силой, приложенной в направлении, обратном осмосу. Величину давления, необходимую для прекращения осмоса, называют осмотическим давлением. Таким образом, осмотическое давление является непрямой характеристикой содержания воды и концентрации веществ в растворе. Чем оно выше, тем меньше в растворе содержание воды и выше концентрация растворенного вещества.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Расчеты, связанные с осмотическим давлением
Осмотическое давление в растворах, содержащих несколько растворимых веществ
Задача 118.
В колбе налито 105 мл раствора, в котором содержится 0,37 г сахарозы и 0,27 г NaCl. В раствор добавили 0,23 г CaCl2. Температура в лаборатории 24 градуса по Цельсию. На сколько процентов изменилось осмотическое давление раствора по отношению к начальному?
Решение:
M(С12Н22О11) = 342,2965 г/моль;
М(NaCl) = 58,44 г/моль;
М(CaCl2) = 110,98 г/моль.
1. Рассчитаем осмотическое давление сахарозы
Осмотическое давление C12H22O11, как неэлектролита, рассчитывается по формуле:
0,37 : 105 = х : (1000;
х = 0,37 . 1000)/105 = 3,524 г.
2. Рассчитаем осмотическое давление электролитов NaCl и CaCl2
Массу NaCl, содержащегося в 1000 мл раствора, найдём из пропорции:
0,27 : 105 = х : (1000; х = 0,27 . 1000)/105 = 2,57 г.
Массу CaCl2, содержащегося в 1000 мл раствора, найдём из пропорции:
0,23 : 105 = х : (1000; х = 0,23 . 1000)/105 = 2,19 г.
Осмотическое давление электролита, рассчитывается по формуле:
Рассчитаем изотонический коэффициент электролитов из формулы:
Р(NaCl) = [i(NaCl) . m(NaCl)RT]/М(NaCl) = (2 . 2,57 . 8,314 . 297)/58,44 = 217,18 кПа;
Р(CaCl2) = [i(CaCl2) . m(CaCl2)RT]/М(CaCl2) = (3 . 2,1`9 . 8,314 . 297)/110,98 = 146,18 кПа.
3. Рассчитаем сумарное осмотическое давление начального раствора сазарозы и NaCl, получим:
4. Рассчитаем сумарное осмотическое давление конечного раствора сазарозы, NaCl и CaCl2, получим:
5. Рассчитаем на сколько процентов изменилось осмотическое давление раствора по отношению к начальному, получим:
388,78 : 100 = 146,18 : у;
у = (146,18 . 100)/388,78 = 37,6%.
Ответ: осмотическое давление увеличилось на 37,6%.
Осмотическое давление в живой природе
Задача 119.
Осмотическое давление в корневых волокнах равно 7,3 атм. Концентрация почвенного раствора имеет 0,18 моль. Будет ли вода поступать в корни?
Решение:
1 мм рт ст = 133,322 Па или 0,133322 кПа;
Р(корневых волокон) = 7,3 атм;
1 атм = 101,325 кПа.
1. Рассчитаем осмотическое давление почвенного раствора, получим:
Р(почвенного раствора) = 0,18 . 8,314 . (273 + 20) = 438,48 кПа или 4, 3 атм.
Так как Р(корневых волокон) > Р(почвенного раствора); 7,3 атм > 4, 3 атм, то вода будет стремиться в сторону большего давления, вода будет поступать в корни. Осмотическое давление почвенного раствора гипотонично по отношению к осмотическому давлению в корневых волокнах, поэтому происходит поступление воды из почвы в корневые волоски.
Задача 120.
В 1 мл воды растворили 80 мг белка. Осмотическое давление составило при 25 град. по Цельсию 12 мм рт ст. Каков молекулярный вес белка?
Решение:
1. Рассчитаем молекулярную массу белка
Молярность раствора рассчитаем из формулы: Р = СМRT.
2. Найдём, сколько милиграммов высокомолекулярного соединения содержится в 1 л раствора его из пропорции:
1 : 80 = 1000 : х;
х = 80000 мг = 80 г.
3.Теперь вычислим молекулярную массу соединения по формуле:
М(В) = Mr(белок) = 80/0,0000457 = 1750547 г/моль.
Ответ: Мr(белок) = 1750547 г/моль.