Температура кипения раствора выше чем чистого растворителя
Коллигативные свойства растворов
Любому раствору характерны те или иные физические свойства, к которым относятся и коллигативные свойства растворов. Это такие свойства, на которые не оказывает влияние природа растворенного вещества, а зависят они исключительно от количества частиц этого растворенного вещества.
К коллигативным свойствам растворов относятся:
Рассмотрим подробнее каждое из перечисленных свойств.
Понижение давления паров
Давление насыщенного пара (т.е. пара, который пребывает в состоянии равновесия с жидкостью) над чистым растворителем называется давлением или упругостью насыщенного пара чистого растворителя.
Если в некотором растворителе растворить нелетучее вещество, то равновесное давление паров растворителя при этом понижается, т.к. присутствие какого – либо вещества, растворенного в этом растворителе, затрудняет переход частиц растворителя в паровую фазу.
Экспериментально доказано, что такое понижение давления паров напрямую зависит от количества растворенного вещества. В 1887 г. Ф.М. Рауль описал количественные закономерности коллигативных свойств растворов.
Первый закон Рауля
Первый закон Рауля заключается в следующем:
Давление пара раствора, содержащего нелетучее растворенное вещество, прямо пропорционально мольной доле растворителя в данном растворе:
p — давление пара над раствором, Па;
p0 — давление пара над чистым растворителем, Па;
χр-ль — мольная доля растворителя.
nв-ва и nр-ля – соответственно количество растворенного вещества и растворителя, моль.
Иногда Первому закону Рауля дают другую формулировку:
относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества:
При этом принимаем, что χв-ва + χр-ль= 1
Изотонический коэффициент Вант-Гоффа
Для растворов электролитов данное уравнение приобретает несколько иной вид, в его состав входит изотонический коэффициент i:
Δp — изменение давления паров раствора по сравнению с чистым растворителем;
i – изотонический коэффициент.
Изотонический коэффициент (или фактор Вант-Гоффа) — это параметр, не имеющий размерности, который характеризует поведение какого – либо вещества в растворе.
То есть, изотонический коэффициент показывает, разницу содержания частиц в растворе электролита по сравнению с раствором неэлектролита такой же концентрации. Он тесно связан связан с процессом диссоциации, точнее, со степенью диссоциации и выражается следующим выражением:
n – количество ионов, на которые диссоциирует вещество.
α – степень диссоциации.
Повышение температуры кипения или понижение температуры затвердевания (кристаллизации). Второй закон Рауля
Равновесное давление паров жидкости имеет тенденцию к увеличению с ростом температуры, жидкость начинает кипеть, при уравнивании давления ее паров и внешнего давления.
При наличии нелетучего вещества, давление паров раствора снижается, и раствор будет закипать при более высокой температуре, по сравнению с температурой кипения чистого растворителя.
Температура замерзания жидкости также определяется той температурой, при которой давления паров жидкой и твердой фаз уравниваются.
Ф.М. Рауль доказал, что повышение температуры кипения, так же как и понижение температуры замерзания разбавленных растворов нелетучих веществ, прямо пропорционально моляльной концентрации раствора и не зависит от природы растворённого вещества. Это правило известно как Второй закон Рауля:
K — криоскопическая константа,
mв-ва — моляльность вещества в растворе.
Растворы электролитов не подчиняются Законам Рауля. Но для учёта всех несоответствий Вант-Гофф предложил ввести в приведённые уравнения поправку в виде изотонического коэффициента i, учитывающего процесс распада на ионы молекул растворённого вещества:
Осмотическое давление раствора
Некоторые материалы имеют способность к полупроницаемости, т.е. им свойственно пропускать частицы определенного вида и не пропускать частицы другого вида.
Перемещение молекул растворителя (но не растворенного, в нем вещества), через полупроницаемую мембрану в раствор с большей концентрацией из более разбавленного представляет собой такое явление как осмос.
Представим два таких раствора, которые разделены полупроницаемой мембраной, как показано на рисунке выше. Растворы стремятся к выравниванию концентраций, поэтому вода будет проникать в раствор, тем самым уменьшая его концентрацию.
Для того, чтобы осмос приостановить, необходимо приложить внешнее давление к раствору. Такое давление, которое требуется приложить, называется осмотическим давлением.
Осмотическое давление и концентрацию раствора неэлектролита позволяет связать уравнение Вант — Гоффа, которое напоминает уравнение идеального газа Клапейрона – Менделеева:
R — универсальная газовая постоянная (8,314 Дж/моль·К);
T — абсолютная температура раствора.
Преобразуем уравнение следующим образом:
C = n/V = m/(M·V)
π = т·R·T / M·V или
Для растворов электролитов осмотическое давление определяется уравнением, в которое входит изотонический коэффициент:
где i — изотонический коэффициент раствора.
Для растворов электролитов i > 1, а для растворов неэлектролитов i = 1.
Если полупроницаемой перегородкой разделены два раствора, имеющие одинаковое осмотическое давление, то перемещение растворителя через перегородку отсутствует. Такие растворы называются изотоническими.
Раствор, с меньшим осмотическим давлением, по сравнению с более концентрированным раствором, называют гипотоническим, а раствор с большей концентрацией – гипертоническим.
Закон Рауля
Зако́ны Ра́уля — общее название открытых французским химиком Ф. М. Раулем в 1887 г. количественных закономерностей, описывающих некоторые коллигативные (зависящие от концентрации, но не от природы растворённого вещества) свойства растворов.
Содержание
Первый закон Рауля
Первый закон Рауля связывает давление насыщенного пара над раствором с его составом; он формулируется следующим образом:
Для бинарного раствора, состоящего из компонентов А и В (компонент А считаем растворителем) удобнее использовать другую формулировку:
Растворы, для которых выполняется закон Рауля, называются идеальными. Идеальными при любых концентрациях являются растворы, компоненты которых очень близки по физическим и химическим свойствам (оптические изомеры, гомологи и т. п.), и образование которых не сопровождается изменением объёма и выделением либо поглощением теплоты. В этом случае силы межмолекулярного взаимодействия между однородными и разнородными частицами примерно одинаковы, и образование раствора обусловлено лишь энтропийным фактором.
Отклонения от закона Рауля
Растворы, компоненты которых существенно различаются по физическим и химическим свойствам, подчиняются закону Рауля лишь в области очень малых концентраций; при больших концентрациях наблюдаются отклонения от закона Рауля. Случай, когда истинные парциальные давления паров над смесью больше, чем вычисленные по закону Рауля, называют положительными отклонениями. Противоположный случай, когда парциальные давления паров компонентов оказываются меньше вычисленных — отрицательные отклонения.
Причиной отклонений от закона Рауля является то обстоятельство, что однородные частицы взаимодействуют друг с другом иначе, чем разнородные (сильнее в случае положительных и слабее в случае отрицательных отклонений).
Реальные растворы с положительными отклонениями от закона Рауля образуются из чистых компонентов с поглощением теплоты (объём раствора оказывается больше, чем сумма исходных объёмов компонентов (ΔV > 0). Растворы с отрицательными отклонениями от закона Рауля образуются с выделением теплоты (ΔНраств Второй закон Рауля
Тот факт, что давление паров над раствором отличается от давления паров над чистым растворителем, существенно влияет на процессы кристаллизации и кипения. Из первого закона Рауля выводятся два следствия, касающиеся понижения температуры замерзания и повышения температуры кипения растворов, которые в объединённом виде известны как второй закон Рауля.
Понижение температуры кристаллизации растворов
Условием кристаллизации является равенство давления насыщенного пара растворителя над раствором давлению пара над твёрдым растворителем. Поскольку давление пара растворителя над раствором всегда ниже, чем над чистым растворителем, это равенство всегда будет достигаться при температуре более низкой, чем температура замерзания растворителя. Так, океанская вода начинает замерзать при температуре около минус 2 °C.
Разность между температурой кристаллизации растворителя T°fr и температурой начала кристаллизации раствора Tfr есть понижение температуры кристаллизации.
Поскольку по мере кристаллизации растворителя из раствора концентрация последнего возрастает, растворы не имеют определённой температуры замерзания и кристаллизуются в некотором интервале температур.
Повышение температуры кипения растворов
Жидкость кипит при той температуре, при которой общее давление насыщенного пара становится равным внешнему давлению. Если растворённое вещество нелетуче (то есть давлением его насыщенных паров над раствором можно пренебречь), то общее давление насыщенного пара над раствором равно парциальному давлению паров растворителя. В этом случае давление насыщенных паров над раствором при любой температуре будет меньше, чем над чистым растворителем, и равенство его внешнему давлению будет достигаться при более высокой температуре. Таким образом, температура кипения раствора нелетучего вещества Tb всегда выше, чем температура кипения чистого растворителя при том же давлении T°b.
Криоскопическая и эбулиоскопическая константы
Коэффициенты пропорциональности К и Е в приведённых выше уравнениях — соответственно криоскопическая и эбулиоскопическая постоянные растворителя, имеющие физический смысл понижения температуры кристаллизации и повышения температуры кипения раствора с концентрацией 1 моль/кг. Для воды они равны 1.86 и 0.52 K·моль −1 ·кг соответственно. Поскольку одномоляльный раствор не является бесконечно разбавленным, второй закон Рауля для него в общем случае не выполняется, и величины этих констант получают экстраполяцией зависимости из области малых концентраций до m = 1 моль/кг.
Для водных растворов в уравнениях второго закона Рауля моляльную концентрацию иногда заменяют молярной. В общем случае такая замена неправомерна, и для растворов, плотность которых отличается от 1 г/см³, может привести к существенным ошибкам.
Второй закон Рауля даёт возможность экспериментально определять молекулярные массы соединений, неспособных к диссоциации в данном растворителе; его можно использовать также для определения степени диссоциации электролитов.
Растворы электролитов
Законы Рауля не выполняются для растворов (даже бесконечно разбавленных), которые проводят электрический ток — растворов электролитов. Для учёта этих отклонений Вант-Гофф внёс в приведённые выше уравнения поправку — изотонический коэффициент i, неявно учитывающий диссоциацию молекул растворённого вещества:

Неподчинение растворов электролитов законам Рауля и принципу Вант-Гоффа послужили отправной точкой для создания С. А. Аррениусом теории электролитической диссоциации.
Повышение температуры кипения растворов неэлектролитов
Этот вопрос тесно связан с давлением насыщенного пара над жидкостью. Любая жидкость (чистый растворитель или раствор) закипает при такой температуре, при которой давление насыщенного пара над ней становится равным внешнему (атмосферному) давлению. Чистые растворители (вода, бензол, этанол и т.д.) имеют при данных условиях постоянную температуру кипения. Например, при внешнем (атмосферном) давлении 101,3 кПа температура кипения воды равна 100°С, так как при этой температуре давление насыщенного водяного пара как раз равно 101,3 кПа.
Растворы кипят при более высокой температуре, чем чистый растворитель. Если, например, растворить в воде какой-нибудь нелетучий электролит (сахар), то давление насыщенного водяного пара понизится, так как давление насыщенного пара растворителя над раствором всегда меньше, чем над чистым растворителем (Р о С, только тогда он закипит. Таким образом, температура кипения раствора всегда выше температуры кипения чистого растворителя.
Разность температур кипения раствора (Тк) и растворителя (Тк о ) называется повышением температуры кипения раствора (∆Ткип), то есть
По закону Рауля (уравнение 5.2.) понижение давления насыщенного пара растворителя над раствором пропорционально концентрации растворенного вещества. Поэтому повышение температуры кипения раствора должно возрастать с увеличением концентрации раствора, то есть чем выше концентрация раствора, тем больше ∆Тк.
Изучая кипение растворов, Ф.Рауль установил:
повышение температуры кипения ∆Тк разбавленных растворов неэлектролитов прямо пропорционально моляльной концентрации раствора:
∆Тк =E • cm(Х) или ∆Тк = E • 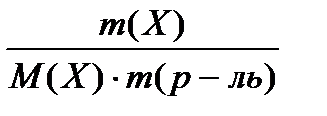
где ∆Тк – повышение температуры кипения раствора;
cm(Х) – моляльная концентрация неэлектролита Х в растворе, моль/кг;
m(X) – масса неэлектролита (растворенного вещества), г (кг);
М(Х) – молярная масса растворенного вещества Х, г/моль (кг/моль);
m(р-ль) – масса растворителя, кг;
Необходимо отметить, что для разбавленных растворов неэлектролитов повышение температуры кипения ∆Тк не зависит от природы неэлектролита, а зависит только от концентрации неэлектролита в растворе. При кипении раствора неэлектролита из раствора выкипает только растворитель, вследствие чего концентрация раствора в ходе его кипения возрастает. Это приводит к ещё большему повышению температуры кипения. Таким образом, раствор неэлектролита кипит не при определенной температуре, а в некотором температурном интервале. Температуру начала кипения данного раствора называют его температурой кипения.
Понижение температуры замерзания растворов неэлектролитов
Чистые растворители при постоянной температуре не только кипят, но и замерзают (кристаллизуются). Например, вода при 101,3 кПа превращается в лёд при 0 о С. Любая жидкость (чистый растворитель или раствор) замерзает при той температуре, при которой давление насыщенного пара над жидкостью сравняется с давлением насыщенного пара над твердой фазой (кристаллами), то есть установится равновесие процессов замерзания и плавления (равновесие между жидкой и твердой фазами). Это равенство давлений насыщенного пара над жидкой и твердой фазами выражает достигнутое системой состояние равновесия, при котором твердая фаза, жидкость и пар могут сосуществовать длительное время. Чистая вода замерзает при 0 о С, так как при этой температуре давление водяного пара над жидкой водой и твердым льдом одинаково.
Растворы неэлектролитов замерзают при более низкой температуре, чем растворитель. Температура замерзания раствора тем меньше, чем больше концентрация раствора неэлектролита.
Разность температур замерзания растворителя (Тз о ) и раствора (Тз) называется понижением температуры замерзания раствора (∆Тз), то есть
Изучая замерзание растворов неэлектролитов, Ф.Рауль установил:
понижение температуры замерзания ∆Тз разбавленных растворов неэлектролитов прямо пропорционально моляльной концентрации раствора:
где в(Х) – моляльная концентрация неэлектролита Х в растворе, моль/кг;
Криоскопическая постоянная зависит от природы растворителя и не зависит от природы растворенного вещества. Значения Кз различных растворителей приводятся в справочных таблицах.
Для разбавленных растворов неэлектролитов понижение температуры замерзания (как и повышение температуры кипения ∆Ткип) не зависит от природы неэлектролита, а зависит только от концентрации неэлектролита в растворе, то есть определяется числом частиц в растворе, являясь коллигативным свойством раствора. Так как из раствора при замерзании кристаллизуется только растворитель, то концентрация раствора в ходе его замерзания увеличивается, что приводит к еще большему понижению температуры замерзания. Таким образом, раствор неэлектролита замерзает в некотором интервале температур. Температуру начала замерзания данного раствора называют его температурой замерзания.
Раздел химии, изучающий кипение раствора, называется эбулиоскопией (эбулиометрией), а изучающий замерзание растворов, называется криоскопией (криометрией). На измерениях температур кипения и температур замерзания растворов основаны эбулиоскопический и криоскопический методы определения молярных масс растворенных веществ. Для такого определения готовят разбавленный раствор определяемого вещества в подходящем растворителе с известной криоскопической или эбулиоскопической постоянной и точно измеряют ∆Тз или ∆Тк данного раствора. Чаще используют криоскопический метод, так как легче измерить точную величину ∆Тз.
Криоскопический метод используют в фармации для определения молярной массы новых лекарственных веществ, а также для определения концентрации лекарственного вещества.
5. Осмос и осмотическое давление в растворах. Закон Вант-Гоффа. Гипо-, гипер-, и изотонические растворы. Осмометрия.
Осмос является частным случаем диффузии. Как известно, диффузия – это направленное самопроизвольное тепловое движение вещества в сторону его меньшей концентрации, то есть это самопроизвольное проникновение одного вещества в среду другого. Частицы растворенного вещества и растворителя при их смешивании в результате беспорядочного теплового движения равномерно распределяются по всему объему и образуется гомогенная система – раствор. Диффузия прекращается, когда концентрация раствора во всем его объеме выравнивается, энтропия системы достигает максимального значения, а изменение энтропии станет равной нулю. Диффузия происходит на границе растворов различной концентрации, при этом вещество (и растворенное вещество, и растворитель) переносится туда, где его концентрация меньше, то есть частицы растворенного вещества перемещаются преимущественно из концентрированного раствора в разбавленный раствор, а молекулы растворителя – из разбавленного раствора в концентрированный. Таким образом, частицы растворителя и растворенного вещества в результате диффузии перемещаются в противоположных направлениях. Такая диффузия называется двусторонней (встречной) диффузией. Процесс диффузии на границе двух растворов происходит до полного выравнивания концентрации во всем объеме системы.
Если между двумя растворами различной концентрации поместить полупроницаемую перегородку, которая пропускает молекулы растворителя и не пропускает частицы растворенного вещества, то будет наблюдаться односторонняя диффузия молекул растворителя или осмос, то есть растворитель будет переходить из раствора с меньшей концентрацией растворенного вещества в раствор с большей концентрацией.
Полупроницаемые перегородки или мембраны существуют в животных и растительных организмах, а также применяются в экспериментальных исследованиях. Мембраны могут быть животного происхождения (например, мочевой пузырь), растительного (оболочка клетки) и искусственного происхождения (пленки из целлофана, коллодия). Некоторые биологические мембраны проницаемы не только для молекул растворителя, но и для ионов и молекул растворенных веществ. Многие же полупроницаемые перегородки проницаемы только для молекул растворителя. При наличии таких мембран на границе растворов различной концентрации или на границе чистого растворителя и раствора наблюдается явление осмоса.
Осмос – это преимущественно односторонняя диффузия молекул растворителя через полупроницаемую перегородку из раствора с меньшей концентрацией растворенного вещества в раствор с большей концентрацией этого вещества или из чистого растворителя в раствор растворенного вещества.
Осмотическое давление раствора равно такому давлению газа, которое показывало бы вещество, если бы оно находилось в газообразном состоянии при той же температуре и занимало объем, равный объему раствора.
Растворы, имеющие одинаковое осмотическое давление, называются изотоническими растворами. В этих растворах одинаковая концентрация осмотически активных частиц. Например, осмотическое давление крови человека при 37 о С составляет 780 кПа. Такое же давление создает и 0,9%-ный водный раствор NaCl, который, следовательно, изотоничен с кровью и называется физиологическим раствором. Если клетку поместить в изотонический раствор, то клетка сохраняет свой размер и нормально функционирует. При больших потерях крови, например, после тяжелой операции, больным вводят большой объём изотонического раствора для возмещения потери жидкости с кровью. Допустимые колебания осмотического давления крови весьма незначительны и даже при тяжелой патологии не превышают нескольких десятков кПа.
Из двух растворов гипертоническим будет тот, у которого больше концентрация всех осмотически активных растворенных частиц, а значит больше осмотическое давление. Например, 10%-ный водный раствор NaCl будет гипертоническим по отношению к крови. Клетка в гипертоническом растворе испытывает плазмолиз, то есть потерю воды
В хирургии применяют гипертонические повязки (марля, смоченная в гипертоническом 10%-ном водном растворе NaCl), которые накладываются на гнойные раны. Тогда осмос направлен из раны, то есть соль вытягивает из раны жидкость, в результате рана постоянно очищается от гноя, микроорганизмов и продуктов распада. Гипертонические растворы в небольших количествах вводятся внутривенно при глаукоме, чтобы уменьшить избыточное количество влаги в передней камере глаза. Гипертонические растворы соли и сахара используют при консервировании продуктов, так как в этой среде происходит плазмолиз микроорганизмов.
Из двух растворов гипотоническим будет тот, у которого меньше концентрация всех растворенных частиц, а значит меньше осмотическое давление. Например, 0,5%-ный водный раствор NaCl будет гипотоническим по отношению к крови. Клетка в гипотоническом растворе испытывает лизис.
Человеческий глаз имеет определенную концентрацию и давление глазной жидкости. Эта концентрация больше, чем в пресной воде, поэтому после купания (в озере или реке) наблюдается припухлость глаз, так как вследствие осмоса часть воды проникает в глаз. И, наоборот, после купания в морской воде наблюдается резь в глазах, так как концентрация растворенных веществ в морской воде больше, чем в глазной жидкости, и вода вследствие осмоса выделяется частично из глаза.
6. Коллигативные свойства разбавленных растворов электролитов. Изотонический коэффициент. Роль осмоса и осмотического давления в биологических системах. Плазмолиз и гемолиз.
Растворы имеют ряд свойств, которые при данной температуре не зависят от природы растворенного вещества, а определяются числом частиц в растворе. Эти свойства называют коллигативными (коллективными),то есть связанными друг с другом, так как они обусловлены близкими причинами и пропорциональны числу (концентрации) растворенных частиц: чем больше растворенных частиц в растворе, тем сильнее выражены коллигативные свойства. К коллигативным свойствам относятся: понижение давления насыщенного пара растворителя над раствором, повышение температуры кипения раствора, понижение температуры замерзания раствора и осмотическое давление.
Изучение разбавленных растворов неэлектролитов показало, что коллигативные свойства этих растворов изменяются пропорционально концентрации растворенного в этом растворе неэлектролита. Справедливость законов Рауля и Вант-Гоффа для растворов неэлектролитов подтверждается результатами многих опытов. Если же рассматривать коллигативные свойства растворов электролитов (кислот, оснований, солей и др.), то для них осмотическое давление П, понижение давления пара ∆Р, понижение температуры замерзания ∆Тз и повышение температуры кипения ∆Тк будут превышать значения, рассчитанные по законам Рауля и Вант-Гоффа для растворов неэлектролитов той же концентрации. Так, например, осмотическое давление 0,05 М раствора NaCl будет примерно в 2 раза больше, чем вычисленное по закону Вант-Гоффа для 0,05 М раствора неэлектролита (например, глюкозы). Во столько же раз и ∆Тк, и ∆Тз этого раствора NaCl больше теоретического значения, рассчитанного по закону Вант-Гоффа.
Вант-Гофф такое несоответствие результатов растворов электролитов по сравнению с растворами неэлектролитов объяснил диссоциацией электролитов в растворе, в результате чего увеличивается общее число осмотически активных частиц (молекул и ионов совместно) в растворе по сравнению с раствором неэлектролита, то есть увеличивается суммарная концентрация всех частиц в растворе электролита. Например, молярная концентрация ионов Na + и ионов Cl – в 0,05 М растворе NaCl будет примерно в 2 раза больше, чем молярная концентрация частиц (молекул) в 0,05 М растворе глюкозы (неэлектролита), поэтому и осмотическое давление, ∆Тк и ∆Тз тоже будут приблизительно в 2 раза больше.
Изотонический коэффициент i для каждого раствора электролита определяется экспериментально. Согласно Вант-Гоффа, изотонический коэффициент равен:
i=1+α*(n-1)
где α – cтепень диссоциации; n – число ионов;
Следовательно, для разбавленных растворов электролитов коллигативные свойства могут быть рассчитаны по следующим уравнениям:
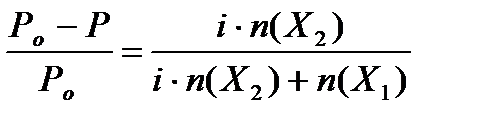
Для растворов неэлектролитов значение изотонического коэффициента i = 1, для растворов электролитов i > 1.
Так как изотонический коэффициент i есть следствие диссоциации электролита в растворе, поэтому он связан со степенью диссоциации (степенью ионизации) α:
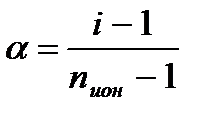
где nион – число молей ионов, образующихся при диссоциации
(ионизации) 1 моля электролита.
Если α = 0 (то есть неэлектролит), то i = 1. Если α = 1, то i = nион. Таким образом, изотонический коэффициент для растворов электролитов изменяется от 1 до nион. Например, для водного раствора K2SO4 значение i может изменяться от 1 до 3, для водного раствора NaCl – от 1 до 2. С уменьшением концентрации электролита в растворе путем его разбавления водой значение изотонического коэффициента i увеличивается, приближаясь к целочисленному значению nион для предельно разбавленного раствора электролита.
Явление осмоса играет важную роль во многих биологических системах. Важнейшие физиологические процессы в основном имеют явление осмоса. Осмос исключительно важен для животных и растительных организмов. Осмос и осмотическое давление ответственны за процессы движения веществ по организму. За счет осмоса осуществляется питание клеток (стенки клеток избирательно пропускают питательные вещества) и выделение продуктов распада, то есть осуществляется обмен веществ. Вследствие осмотического давления обеспечивается упругость клеток (тургор), обеспечивающая эластичность тканей и сохранение определенной формы органов. В процессе осмоса происходит подъем воды по стеблю растений, подъем жидкости в ткани и клетки. За счет осмоса стебли и листья деревьев обладают упругостью, так как вода за счет осмоса создает в них избыточное давление, которое слегка растягивает оболочки клеток и поддерживает их в напряженном состоянии. Если уменьшается осмотическое давление, то деревья вянут, то есть происходит потеря жидкости. Животные клетки имеют оболочки, обладающие свойствами полупроницаемых мембран. При помещении таких клеток в растворы различной концентрации может наблюдаться осмос. Для человеческого организма характерно определенное соотношение концентрации вещества внутри клетки (С1) и концентрации вещества в околоклеточной жидкости (С2). Если это соотношение концентраций (С1 и С2) соответствует нормальному физиологическому состоянию организма, то это состояние называется тургор, то есть в этом состоянии происходит нормальный обмен (без нарушений) веществ между клеткой и окружающей её средой. Если нормальное состояние организма нарушено в силу каких-то причин и околоклеточная жидкость (окружающая среда) получает дополнительное количество какого-то вещества, то в этом случае нормальное соотношение между С1 и С2 нарушается и будет С1 C2. Тогда осмос будет направлен внутрь клетки, то есть растворитель преимущественно будет из менее концентрированного раствора переходить внутрь клетки, в результате клетка будет разбухать, то есть увеличиваться и может произойти разрыв оболочки и клетка разрушится и произойдет вытекание содержимого клетки. Такое разрушение клетки называется лизисом. В случае эритроцитов этот процесс называют гемолизом.
Таким образом, осмос всегда направлен в более концентрированный раствор. Процессы плазмолиза и лизиса зависят от проницаемости оболочек клеток. Например, если концентрированные растворы солей и глюкозы вызывают стойкий плазмолиз, то растворы этанола и хлороформа его не вызывают. Это связано с тем, что этанол и хлороформ, как и вода, легко проникают через клеточные мембраны.
7. Осмотическое давление растворов биополимеров. Уравнение Галлера. Полиэлектролиты. Изоэлектрическая точка и её определение. Онкотическое давление плазмы и сыворотки крови.
Для НМС осмотическое давление (Pосм) подчиняется уравнению Вант-Гофа:
Осмотическое давление растворов ВМС с повышением концентрации не подчиняется закону Вант-Гоффа. Это объясняется гибкостью макромолекул ВМС. Они проявляют себя в растворе, как несколько молекул меньшего размера.
Для расчёта Посм растворов ВМС используется уравнение Галлера:
Посм 
где М – молярная маса ВМС, г/моль,
С – концентрация раствора ВМС, г/л,
К – константа, зависящая от прироы вещества ВМС и растворителя. «К» определяют графически.
Все биологические мембраны проницаемы только для НМС и непроницаемы для белков полисаха.
Среди полимеров есть электролиты и неэлектролиты.
Свойства полимерных электролитов отличаются от полимеров – неэлектролитов. Полиэлектролиты, аналогично низкомолекулярным электролитам, проводят электрический ток, растворяются в полярных растворителях.
Полиэлектролиты –это полимеры, содержащие ионогенные группы.
По природе образуемых ионов полиэлектролиты можно разделить на 3 группы:
Содержат группы кислотного характера. Их поверхность заряжена отрицательно. (Желчные кислоты, растворимый крахмал, агар-агар.)
Это полимеры, содержащие группы основного типа. Например, аминогруппу. (синтетические ВМС)
Это ВМС, содержащие и кислотную и основную группу. Например, белки с группами
Знак заряда белков и его величина зависит от рН среды:
Значение рН, при котором суммарный заряд макромолекулы полиамфолита становится равным 0, называется изоэлектрической точкой (И.Э.Т.).
Методы определения ИЭТ
В буфере с рН=ИЭТ белок не будет перемещаться в электрическом поле, так как он электронейтрален в ИЭТ.
— по степени набухания(минимальное набухание будет в растворе с рН=ИЭТ);
— по скорости застудневания(быстрее всего застудневание произойдёт в растворе, рН которого соответствует ИЭТ);
— по вязкости(в растворе, с рН, равным ИЭТ белка, макромолекула белка свёртывается в клубок, поэтому вязкость будет минимальной);
—по степени коагуляции
В буферные растворы с различным значением рН вносят равные количества исследуемого белка и добавляют спирт или ацетон. Наибольшая мутность будет наблюдаться в растворе с буфером, рН которого соответствует ИЭТ данного белка.
Осмотическое давление белков плазмы крови называют онкотическим давлением. Оно значительно меньше давления, создаваемого растворёнными в плазме солями, так как белки имеют огромную молекулярную массу, и, несмотря на большее их содержание в плазме крови по массе, чем солей, количество их грамм-молекул оказывается относительно небольшим.
Онкотическое давление препятствует чрезмерному переходу воды из крови в ткани и способствует реабсорбции её из тканевых пространств, поэтому при уменьшении количества белков в плазме крови развиваются отёки тканей.
8. Элементы теории растворов слабых и сильных электролитов. Активность и коэффициент активности. Ионная сила растворов. Электролиты в организме человека.
Все вещества по способности проводить электрический ток делятся на электролиты и неэлектролиты.
Электролиты – это вещества, растворы или расплавы которых способны проводить электрический ток, то есть вещества, которые в растворах или расплавах распадаются на ионы, то есть диссоциируют (ионизируют).
Электролитами являются кислоты, основания, соли и другие вещества. В этих веществах имеется ионная химическая связь (например, NaCl) или сильнополярная и среднеполярная ковалентная химическая связь (например, HCl, H2S).
Неэлектролиты – это вещества, растворы или расплавы которых не проводят электрический ток, то есть не распадаются на ионы.
В настоящее время существуют две теории электролитической диссоциации: теория слабых и средних электролитов (классическая теория электролитической диссоциации С.Аррениуса) и теория сильных электролитов, основные положения которой разработаны П.Дебаем и Э.Хюккелем в 1923 г.
Согласно теории С.Аррениуса процесс диссоциации слабых электролитов – обратимый процесс, то есть в растворе электролита есть не только ионы, но и молекулы электролита.
Аррениус ошибочно считал, что и в растворах сильных электролитов происходит обратимая диссоциация электролита на ионы, так как найденные опытным путем значения электрической проводимости, изотонического коэффициента i, коллигативных свойств растворов сильных электролитов (осмотическое давление, ∆Тк и ∆Тз) оказываются меньше, чем следовало бы ожидать при 100%-ной диссоциации электролита, поэтому рассчитанная степень диссоциации электролита оказывалась меньше 100%.
Однако сильные электролиты в водных растворах практически полностью диссоциируют на ионы и истинная степень диссоциации для них равна 100% вне зависимости от концентрации электролита в растворе, что подтверждается физическими и физико-химическими методами исследования. Рентгеноструктурное исследование кристаллов сильных электролитов типа KCl показало, что такие ионные соединения даже в твердом виде состоят не из молекул, а из положительно (К + ) и отрицательно (Cl – ) заряженных ионов, расположенных в узлах кристаллической решетки. Кроме того, исследование концентрированных растворов сильных электролитов оптическими методами показало отсутствие молекул даже в очень концентрированных растворах. Поэтому в водных растворах сильные электролиты практически полностью распадаются на ионы. И в отличие от растворов слабых электролитов их растворы содержат большое число ионов, то есть в не очень разбавленных растворах создается большая плотность ионов и расстояние между ионами мало. В результате между ионами возникают силы электростатического взаимодействия. При этом каждый ион в растворе окружается противоположно заряженными ионами, в то время как ионы одноименного знака заряда располагаются дальше друг от друга. Каждый ион окружен шарообразным роем противоположно заряженных ионов, получившим название «ионной атмосферы». В таких растворах ионы не вполне свободны, движение их стеснено взаимным притяжением друг к другу. При этом ионы сольватируются (электростатическое взаимодействие между частицами (ионами, молекулами) растворенного вещества и растворителя), что также отражается на их свойствах.
В результате тормозящего действия «ионных атмосфер» (межионные взаимодействия) уменьшается эффективность ионов в таких явлениях, как электропроводность раствора, осмотическое давление, понижение температуры замерзания и повышение температуры кипения растворов электролитов. Если теперь рассчитать степень ионизации сильного электролита (например, KCl) по измеренной опытным путем электропроводности его растворов (или по измеренному коллигативному свойству этого раствора), то получаются заниженные значения, то есть


