трепанация черепа при кровоизлиянии в мозг
Что мы лечим Внутричерепная гематома
Внутричерепная гематома
Внутричерепная гематома
Вступление
Хотя травмы головы могут быть незначительными, внутричерепная гематома является серьезным и потенциально угрожающим жизни состоянием, которое зачастую требует немедленного лечения.
Головной мозг находится внутри черепа, окруженный жидкостью, которая защищает его от толчков при обычных передвижениях. Но иногда жидкость не в состоянии нейтрализовать силу внезапного удара или быстрой остановки. В такой ситуации головной мозг резко встряхивается и с силой ударяется о стенку черепа, вследствие чего может произойти ушиб мозга.
Внутричерепная гематома развивается при разрыве кровеносного сосуда в головном мозге или между черепом и головным мозгом. Скопление крови (гематома) сдавливает ткань головного мозга.
Лечение внутричерепной гематомы зачастую требует проведения операции по удалению гематомы. Однако небольшая по размеру внутричерепная гематома не обязательно требует операции.
Симптомы
Признаки и симптомы внутричерепной гематомы могут развиться через тот или иной промежуток времени после травмы либо непосредственно после нее. С течением времени давление на головной мозг возрастает, вызывая некоторые или все нижеперечисленные признаки и симптомы:
При большом количестве крови, заполняющей мозг или узкое пространство между головным мозгом и черепом, могут проявиться другие признаки и симптомы, например:
Причины
В результате травмы головы может развиться субдуральная, эпидуральная или внутримозговая гематома.
Это состояние развивается при разрыве кровеносных сосудов – обычно вен – между головным мозгом и твердой мозговой оболочкой (внешней из трех оболочек, покрывающих головной мозг). Изливающаяся кровь образует гематому, сдавливающую ткань головного мозга. Если гематома увеличивается, развивается прогрессивное угасание сознания, что может привести к смерти.
Существует три типа субдуральных гематом:.
Все три типа гематом требуют оказания медицинской помощи при первом проявлении симптомов и признаков, в противном случае гематома может привести к необратимому поражению головного мозга.
Риск субдуральной гематомы повышается у лиц, ежедневно принимающих аспирин или антикоагулянты, у алкоголиков, у очень молодых или пожилых пациентов.
Эту гематому также называют экстрадуральной, она развивается при разрыве кровеносного сосуда – обычно артерии – между внешней поверхностью твердой мозговой оболочки и черепом. Часто повреждение кровеносного сосуда происходит вследствие перелома черепа. Кровь протекает между твердой мозговой оболочкой и черепом и образует массу, которая сдавливает ткань головного мозга.
Риск смерти от эпидуральной гематомы является значительным, если быстро не начать лечение. Некоторые пациенты с подобным видом травмы могут оставаться в сознании, но большинство находится в сонном или коматозном состоянии с момента получения травмы.
Эпидуральные гематомы более распространены у детей и подростков. Чаще всего они являются результатом авто- или мото-аварии или других травматических происшествий.
Этот тип гематомы, также известной как интрапаренхиматозная гематома, развивается при проникновении крови в головной мозг. После травмы головы могут развиться многочисленные внутримозговые гематомы.
Травма, приведшая к появлению таких гематом, часто вызывает поражение белого вещества. Такие поражения развиваются после того, как травма буквально разрывает нейриты в белом веществе головного мозга. Нейриты – это соединения, передающие электрические импульсы или сообщения от нейронов головного мозга к остальным частям организма. При разрыве данного соединения может появиться серьезное поражение головного мозга, потому что нейроны больше не могут взаимодействовать.
Травма – это не единственная причина внутримозговой гематомы.
К другим причинам относятся:
Когда следует обращаться к врачу
Внутричерепная гематома может угрожать жизни. Часто необходима экстренная медицинская помощь.
После любого значительного удара головы с потерей сознания или при появлении любых признаков и симптомов, которые могут указывать на наличие внутричерепной гематомы, следует обратиться к врачу. Симптомы внутричерепной гематомы могут проявиться не сразу, поэтому внимательно наблюдайте за последующими изменениями физического, умственного и эмоционального состояния.
Кроме этого, сообщите родственникам или близкому другу о получении любой травмы головы. Поскольку потеря памяти часто сопровождает травму головы, вы можете забыть, что получили травму. Предупрежденный родственник, друг или коллега по работе скорее заметит угрожающие признаки и организует оказание быстрой медицинской помощи, если будет знать о том, что с вами произошло.
Обследование и постановка диагноза
Диагностирование гематомы может быть сложным. Однако врачи в основном предполагают, что прогрессирующая потеря сознания после травмы головы вызывается кровоизлиянием в череп, если не доказано иное.
Лучший способ определить локализацию и размер гематомы – это визуализация. Она включает такие методы, как:
Лечение
Лечение гематомы часто требует проведения операции. Вид операции зависит от характеристики гематомы.
Некоторые субдуральные гематомы не требуют удаления, поскольку они небольшие по размеру и не вызывают появления признаков или симптомов.
Врачи могут назначить лекарственные препараты, например, кортикостероиды и мочегонные средства, чтобы контролировать отек мозга после травмы головы.
Реабилитация
После операции врач может назначить противосудорожные препараты с целью контроля или профилактики посттравматических судорог. Судороги могут начаться даже через 24 месяца после получения травмы. Могут появиться и продолжаться в течение некоторого времени амнезия, нарушение внимания, тревога и головная боль.
Восстановление после внутричерепной гематомы может быть длительным и неполным. У взрослых восстановление занимает шесть месяцев после травмы. Дети обычно восстанавливаются быстрее и более полно, чем взрослые. Терпение – это ключ к адаптации после травм головного мозга.
Следующие советы могут помочь более быстрому восстановлению:
Хирургическое лечение инсульта
Геморрагический инсульт – грозное заболевание, требующее незамедлительной медицинской помощи. Одной из задач консультативной службы «Спецмедпомощь» в Москве является обеспечение всех этапов лечения геморрагического инсульта, в том числе хирургического.
Геморрагический инсульт – это кровоизлияние в головной мозг, возникающее чаще всего из-за высокого давления. К сожалению, около половины всех случаев данного заболевания в остром периоде заканчиваются летальным исходом, а более 2/3 выживших становятся инвалидами. Исход зависит в первую очередь от своевременности оказания медицинской помощи.
Современное хирургическое лечение при геморрагическом инсульте
Только в специализированных центрах возможно проведение тщательной диагностики и адекватного хирургического или терапевтического лечения геморрагического острого инсульта. Однако чаще всего бесплатная скорая отвезет пострадавшего в ближайшую городскую больницу, где будет оказана первая медицинская помощь, ограниченная возможностями учреждения. А хирургическое лечение инсульта, к сожалению, могут провести не во всех стационарах.
Поэтому родственники пациентов все чаще обращаются в специализированные консультативные службы, которые могут обеспечить:
Только в высококвалифицированных центрах проведут необходимые исследования, оценят все риски, и после этого выберут необходимую тактику лечения.
Еще одним важным моментом, влияющим на дальнейшую дееспособность больного, является реабилитация и уход после хирургического лечения геморрагического инсульта. От опыта специалистов и обеспеченности современной аппаратурой во многом зависит успех послеоперационной терапии.
Этиология и патогенез
Во время протекания геморрагического инсульта человек испытывает недомогание. Симптомы проявляются в различных формах:
Следствием всех тревожных симптомов становится разрыв внутримозговых сосудов под действием высокого артериального давления.
Классификация геморрагического инсульта
Кровоизлияние в мозг происходит мгновенно. Принято классифицировать геморрагический инсульт, учитывая зону кровоизлияния. Подробная классификация кровоизлияний:
Подходы к лечению
Пациент нуждается в срочной госпитализации и оказании медицинской помощи. После нормализации состояния здоровья надо пройти глубокую диагностику (компьютерная томография и МРТ, забор ликвора). После консультации нейрохирурга назначается лечение.
Существует два варианта лечения болезни:
Показания и противопоказания к хирургическому лечению инсульта
Не все случаи заболевания требуют агрессивной тактики и оперативного вмешательства. Осмотр специалистами и данные инструментальных методов диагностики позволяют адекватно оценить общее состояние пациента.
Противопоказаниями к проведению хирургического метода лечения инсульта являются:
Наши консультанты смогут в зависимости от показаний подобрать для пострадавшего лучший специализированный стационар.
Виды хирургического вмешательства
Нейрохирурги различают несколько методов, благодаря которым можно удалить гематому:
После операции пациент должен оставаться под наблюдением. Период реабилитации – длительный и тяжелый, может длиться до двух месяцев. Требуются специальные условия для восстановления пациента (комплекс процедур в реабилитационном центре).
Открытое удаление внутримозговых гематом. Показания и методика удаления гематом мозга путём трепанации
1. Внутримозговая гематома и причины ее возникновения
Внутримозговая гематома – серьезная угроза жизни и здоровью пациента, поскольку она сдавливает ткани головного мозга, нарушая функционирование серьезных мозговых центров, обеспечивающих нормальную работу систем и органов человека.
Внутримозговые гематомы могут быть как следствием черепно-мозговых травм, так и результатом патологии сосудов мозга при аневризме, гипертоническом кризе, неконтролированном приеме некоторых лекарственных препаратов, в частности – антикоагулянтов.
2. Лечение внутримозговых гематом
Вне зависимости от того, каков характер происхождения гематомы, пострадавший нуждается в незамедлительной медицинской помощи. Врач, принимающий решение об операции, учитывает целый ряд факторов, среди которых основными являются следующие:
Операцию, как правило, не проводят при глубоком коматозном состоянии больного по причине практически стопроцентной летальности, и при небольших размерах гематомы – в этом случае риск от хирургического вмешательства неоправдан.
А вот несомненными показаниями к операции являются гематомы мозжечка со сдавлением IV желудочка, гидроцефалией и тенденцией к ухудшению состояния больного. Кроме того, операции обязательно подлежат лобарные и латеральные гематомы больших размеров. В отмеченных случаях только своевременное хирургическое вмешательство способно сохранить жизнь пациента.
3. Основные методики открытого удаления внутримозговых гематом
Как уже говорилось, решение о выборе метода лечения гематомы основывается на анализе целого ряда факторов. Основным методом доступа к гематоме для последующего ее удаления является костно-пластическая трепанация. В ходе этой операции в кости черепа формируется трепанационное отверстие с помощью надпила костной пластины, через которое затем гематома удаляется методом аспирации (отсасывания). После этого выполняют коагуляцию кровоточащих сосудов, образовавшиеся кровяные сгустки удаляют специальным окончатым пинцетом, рану тщательно промывают медицинским солевым раствором (натрия хлорида) и в полость удаленной гематомы временно помещают кровоостанавливающую (гемостатическую) ткань – марлю или губку. Чем сильнее компрессия, тем шире производится трепанация.
Существует и менее травматическая методика удаления внутримозговой гематомы – стереотаксическая аспирация. Такая операция обычно показана при некоторых видах инсультов. При проведении подобного хирургического вмешательства в полость гематомы с помощью контролирующей аппаратуры вводится специальный зонд до 6 мм в диаметре, через который осуществляется аспирация излившейся крови. Несомненное преимущество этой методики, как уже говорилось, состоит в том, что она гораздо менее травматична, по сравнению с костно-пластической трепанацией, а вот ее недостатком является то, что хирург не имеет возможности провести тщательный гемостаз, что повышает риск развития рецидива гематомы.
Хирургическое лечение церебральных аневризм в остром периоде кровоизлияния

Фото справа налево: В. Доленс, А. Королев (зав. нхо КОКБ), Ю. Хернисниеми, А. Воробьев
Нетравматические внутричерепные кровоизлияния при разрывах аневризм относятся к одним из наиболее тяжелых форм нарушений мозгового кровообращения.
В России ежегодно регистрируется около 18000 субарахноидальных кровоизлияний (САК), т.е. 13 на 100000 населения в год.
Что такое аневризма и у кого она чаще встречается.
Наиболее часто САК развивается у лиц среднего и пожилого возраста. У больных в возрасте от 40 до 59 лет его частота достигает 50%.
Аневризма представляет собой выпячивание стенки артерии, обычно в области бифуркации сосуда или в месте отхождения от нее крупных ветвей. Характерным для аневризмы является отсутствие трехслойной сосудистой стенки — отсутствие мышечного слоя и эластической мембраны. Стенка аневризмы состоит из соединительной ткани, прорастающей наружную и внутреннюю оболочки. Купол представлен одним тонким внутренним слоем, поэтому кровотечение возникает именно отсюда.
По конфигурации они бывают мешотчатыми, вёретенообразными и фузиформными а также однокамерными и многокамерными. По величине аневризмы делят на милираные (до 3 мм), обычные (от 4 до 15 мм), большие (от 15 до 25 мм), гигантские (более 25 мм). Аневризмы обычно бывают одиночными, но могут быть и множественными (в 15% случаев), располагаясь на различных артериях. В подавляющем числе наблюдений (90-91%) аневризмы располагаются в переднем отделе
артериального круга большого мозга (виллизиева круга) и толь¬ко 9-10% аневризм локализуются в ВББ.
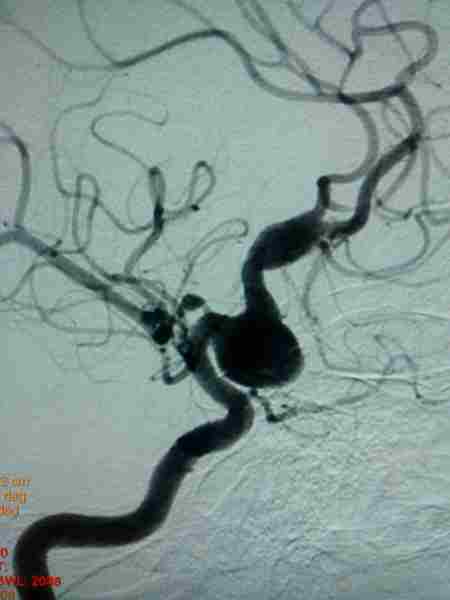
Пример множественных аневризм. Мешотчатая и фузиформная (веретенообразная) аневризмы правой передней мозговой артерии (ПМА).
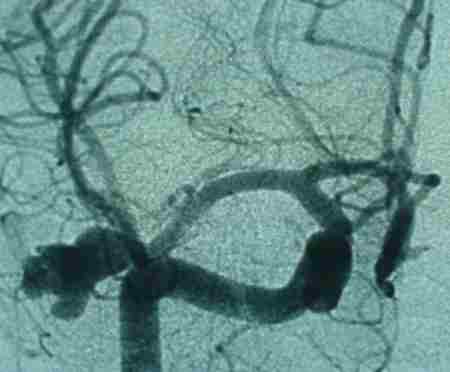
Пример многокамерной аневризмы развилки правой СМА.
При САК кровь поступает под паутинную оболочку и распространяется по базальным цистернам большого мозга. Кровь попадает также в цистерны задней черепной ямки (препонтинную, большую затылочную, мостомозжечкового угла) и далее поступает в позвоночный канал. Источник и интенсивность кровоизлияния определяют характер распространения крови по субарахноидальным пространствам — оно может быть локальным, а может заполнять все субарахноидальные пространства головного мозга с образованием сгустков крови в цистернах. При разрушении мозговой ткани в области кровоизлияния появляются участки паренхиматозного кровоизлияния в виде пропитывания мозгового вещества кровью или формирования гематомы в веществе мозга (субарахноидально-паренхиматозное кровоизлияние).

Разрыв аневризмы ПСА с массивным базальным и паренхиматозным (и немного вентрикулярным) кровоизлиянием.
При значительном поступлении крови в субарахноидальное пространство может возникнуть рефлюкс крови в желудоч¬ковую систему через вывороты IV желудочка (отверстия Мажанди и Люшка) и далее — через водопровод мозга в III и бо¬ковые желудочки. Возможно и прямое проникновение крови в желудочки мозга через поврежденную конечную пластину, что чаще бывает при разрывах аневризмы передней соединительной артерии (субарахноидально-вентрикулярное кровоизлияние). При значительном паренхиматозном кровоизлиянии на фоне САК возможен прорыв гематомы в желудочки мозга (субарахно- идально-паренхиматозно-вентрикулярное кровоизлияние).
Клиника разрыва аневризм мозга.
Клиническая картина САК при разрыве аневризмы развивается остро, иногда на фоне или после физического и эмоционального напряжения. Возникает сильная головная боль. Чаще пациенты описывают ее как головную боль «жгучего», «распирающего» характера, «как будто в голове разлился кипяток». На фоне головной боли развивается кратковременное или длительное угнетение сознания от умеренного оглушения до комы. В остром периоде кровоизлияния нередко возникают психомоторное возбуждение, гипертермия, тахикардия, повышение артериального давления. Неврологическая картина характеризуется развитием менингеального синдрома (ригидность мышц затылка, положительный симптом Кернига, светобоязнь, повышенная чувствительность к шуму и др.). Подобная типичная клиническая картина САК отмечается у 72% пациентов. Однако почти у каждого третьего больного с САК наблюдается иная клиника. Выделяют следующие атипичные варианты САК, для которых характерным является один из ведущих синдромов:
— мигренеподобный;
— ложновоспалительный;
— ложногипертонический;
— ложнорадикулярный;
— ложнопсихотический;
— ложнотоксический.
Неврологическая симптоматика которая развивается при разрывах аневризм той или иной локализации, бывает обусловлена не только эффектом самого САК или паренхиматозного кровоизлияния, но и ишемическими изменениями в мозговой ткани вследствие сосудистого спазма, и тогда клиническая картина заболевания определяется бассейном спазмированных артерий, степенью сужения артерий и особенностями коллатерального кровообращения. Кроме того, при оценке клинических проявлений необходимо учитывать и сроки заболевания, каждый этап которого характеризуется определенной частотой возникновения и формой течения осложнений (повторные кровотечения из аневризмы, внутримозговая гематома, кровоизлияние в желудочки, гидроцефалия, спазм артерий и ишемия мозга, электролитные и эндокринные нарушения, кардиоваскулярные и легочные осложнения и др.).
При всем многробразии клинической картины в практической неврологии и нейрохирургии используют классификации тяжести состояния. К настоящему времени известно более 50 классификаций, которые применяют для оценки тяжести состояния при САК. Наиболее распространенной из них является классификация, предложенная
W. Hunt и R. Hess
I. Бессимптомное течение или слабая головная боль и легкая ригидность мышц затылка.
II. Умеренная или сильная головная боль, ригидность мышц затылка, парез черепно-мозговых нервов.
III. Оглушение, сонливость, спутанность. Умеренный неврологический дефицит.
IV. Сопор, умеренный или выраженный гемипарез, ранняя децеребрационная ригидность.
V. Глубокая кома, децеребрационная ригидность, внешний вид умирающего.
Диагностика субарахноидальных кровоизлияний.
Верификацию кровоизлияния традиционно выполняют путем поясничной пункции.
Компьютерная томография (КТ) головного мозга.
Является ведущим методом в диагностике САК, особенно в первые часы и сутки кровоизлияния. С помощью КТ определяют не только интенсивность базального кровоизлияния и его распространенность по цистернам, но и наличие и объем паренхиматозного и вентрикулярного кровоизлияний, выраженность гидроцефалии, наличие и распространенность очагов ишемии мозга, выраженность и характер дислокационного синдрома.
Кроме того, с помощью КТ иногда удается диагностировать и истинную причину кровоизлияния. Выявляемость САК в первые 12 часов после кровоизлияния достигает 95,2%, в течение 48 часов 80-87%; на 3-и-5-е сутки — 75% и на 6-21-е сутки — всего 29%. Степень выявляемости сгустков крови при САК зависит не только от интенсивности самого кровоизлияния, но и от соотношения сгустков крови и плоскости срезов на КТ. Оптимальным для диагностики САК считается условие, когда плоскость сгустков перпендикулярна плоскости срезов на КТ и толщина сгустков превышает ширину среза КТ. Поэтому САК чаще обнаруживают при сгустках крови толщиной более 1,5 мм.
Наиболее распространенной КТ-классификацией кровоизлияния является классификация, предложенная С.М Fisher et al. в 1980 г.
Данные КТ четко — коррелируют с тяжестью состояния и прогнозом заболевания.
Чем выраженнее кровоизлияние по КТ, тем более вероятно развитие церебрального ангиоспазма и соответственно фатальных ишемических осложнений.
Диагностика источника кровотечения.
Непосредственная визуализация аневризмы возможна тремя методами диагностики: дигитальной субтракционной ангиографией (ДСА), магнитно-резонансной ангиографией (МРА), компьютернотомографической ангиографией (КТА).
Диагностику церебральных аневризм (ЦА) следует начинать с неинвазивных методов.
Компьютерно-томографическая ангиография.
Современная трехмерная КТА с ЗD-реконструкцией (KT-3D-A) обладает чувствительностью в пределах от 87,9 до 97% и специфичностью от 95 до 100%.
При КТА можно получать трехмерное изображение и определять пространственную конфигурацию аневризмы, взаиморасположение с близлежащими структурами.
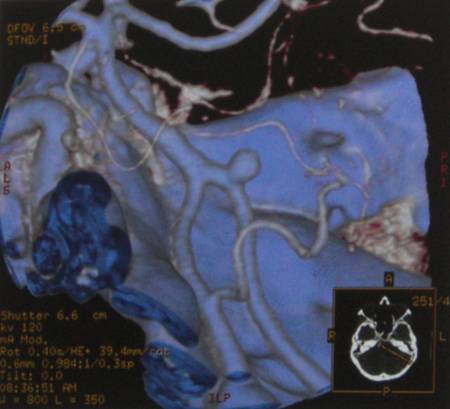
КТА. Аневризма правой позвоночной артерии.
Магнитно-резонансная ангиография.
МРА обеспечивает верификацию внутричерепных аневризм с чувствительностью в пределах от 74 до 100% и специфичностью от 74 до 100%. Чувствительность МРА в обнаружении аневризм диаметром более 3 мм составляет 86%, что сравнимо с результатами ДСА. Отмечено снижение чувствительности МРА при диаметре аневризмы менее 3-5 мм.
Имеется ряд параметров, которые влияют на способность МРА обнаруживать аневризмы: размер ЦА, скорость и направление кровотока в аневризме относительно магнитного поля, тромбоз и кальциноз, — поэтому МРА предпочтительно выполнять в первые 3 суток после кровоизлияния. В сроки от 3 суток до 3 недель после кровоизлияния ее точность снижается из-за биотрансформации молекулы гемоглобина.
Как неинвазивный метод МРА широко применяют в качестве скринингового исследования у пациентов с высоким риском наличия ЦА.
Дигитальпая субтракционная ангиография.
Селективную ДСА необходимо выполнять в следующих случаях: нет возможности проведения КТА или МРА; если эти исследования не выявили источник кровоизлияния или полученные данные недостаточны для проведения хирургического вмешательства. Исследование должно быть выполнено в следующем объеме: оба каротидных бассейна и обе позвоночные артерии. ДСА осуществляют в прямой, боковой, косой, а при необходимости в других атипичных проекциях.
Помимо выявления источника кровоизлияния, необходимо оценить степень выраженности и распространенность сосудистого спазма, особенности кровообращения.
При отсутствии визуализации аневризмы при ДСА у пациентов с типичной клиникой аневризматического САК, при ангиографических признаках сосудистого спазма целесообразно через 3-4 недели после кровоизлияния выполнить повторное ангиографическое исследование, которое позволяет выявить ранее не контрастированные аневризмы приблизительно еще у 3% больных.
Диагностика ангиоспазма.
Сосудистый спазм развивается исключительно при разрывах аневризм и практически не наблюдается при разрывах артериовенозных мальформаций и САК иной этиологии.
Под сосудистым спазмом следует понимать изменения всех слоев артериальной стенки, приводящие к сужению просвета артерии. Они возникают в ответ на кровоизлияние в церебральные цистерны.
Морфологические, изменения в сосудистой стенке следующие: отек и десквамация эндотелия, сокращение гладкомышечных клеток с их последующим некрозом и заместительным склерозом, разрушение эластических волокон наружной и внутренней эластических мембран, коллагеновых волокон адвентиции. Подобные морфологические изменения приводят к сужению просвета артерий, изменению упругоэластических свойств артерии, пристеночному тромбообразованию и иногда полному тромбозу артерий мозга (в 20% случаев). Из вышеописанных морфологических изменений следует, что, во-первых, термин «сосудистый спазм» весьма условен, более уместен термин «констриктивная ангиопатия», во-вторых, более понятным становится, почему терапия артериального спазма спазмолитическими препаратами является неэффективной.
Обычно ангиоспазм при САК развивается с 3-4-х суток от начала заболевания, его пик отмечается на 7-14-е сутки и в последующие дни наблюдается регресс.
Важную роль в оценке выраженности ангиоспазма и характера развивающейся у пациента ишемии мозга играют траскраниальная допплерография — ТКДГ, ЭЭГ и регистрация акустических стволовых вызванных потенциалов. ТКДГ является наиболее чувствительным методом диагностики спазма. При увеличении линейной скорости кровотока до 120 см/с сужение просвета определяется на ангиограммах, а при повышении линейной скорости кровотока более 200 см/с у больных обнаруживаются неврологические расстройства, обусловленные ишемией мозга.
Хирургическое лечение больных с разрывом аневризмы.
Основной целью операции у больных с аневризмами являются выключение аневризмы из кровотока для предотвращения повторных кровотечений и устранение сгустков крови из базальных цистерн для предотвращения сосудистого спазма и ишемии мозга. Учитывая, что и ишемические осложнения, и повторное кровоизлияние возникают через несколько дней после разрыва аневризмы, необходимо стремиться произвести операцию в течение первых 3 суток заболевания. В случаях поздней госпитализации больных с САК и запоздалой диагностики аневризмы, когда развиваются сосудистый спазм и ишемия мозга, операцию приходится откладывать на несколько недель до регресса ишемических осложнений.
В первые 2 недели после разрыва аневризмы повторные кровотечения происходят у 15-20% больных. В первые 6 месяцев после разрыва аневризмы они развиваются у 50% пациентов с летальностью до 60%. В последующем риск повторного кровотечения составляет 3% в год со смертностью 2% в год, что склоняет многих нейрохирургов к тактике ранних оперативных вмешательств.
Показания к проведению открытых хирургических вмешательств.
1) больные с I-II степенью тяжести САК по Hunt-Hess;
2) больные с III степенью тяжести САК по Hunt-Hess при легком или умеренном ангиоспазме (скорость кровотока в сегменте M1 менее 200 см/с);
3) больные с III-IV степенью тяжести САК по Hunt-Hess, ес¬ли тяжесть состояния обусловлена внутримозговой гематомой с развитием дислокационного синдрома.
Показаниями к отсроченному хирургическому лечению являются:
1) III-IV степень тяжести САК по Hunt-Hess при наличии умеренного или выраженного ангиоспазма (скорость кровотока в сегменте M1 менее 200 см/с), III-IV тип изменений ЭЭГ;
2) анатомически сложные аневризмы (гигантские аневриз¬мы, аневризмы базилярной артерии);
3) V степень тяжести САК по Hunt-Hess без внутримозговой гематомы.
Эндоваскулярные методы лечения аневризм.
Абсолютные показания:
1) невозможность клипирования аневризмы в ходе открытой операции.
Приоритетные показания:
1) труднодоступность аневризмы для прямого хирургического вмешательства (аневризмы кавернозного и параклиноидного отделов ВСА, вертебрально-базилярного бассейна);
2) больные старшей возрастной группы (старше 75 лет);
3) тяжелое состояние больных (III-IV степень по Hunt-Hess);
4) фузиформные и расслаивающие аневризмы.
Операции по поводу разрыва аневризм производят под общим обезболиванием, обязательно с использованием операционного микроскопа и микрохирургической техники.
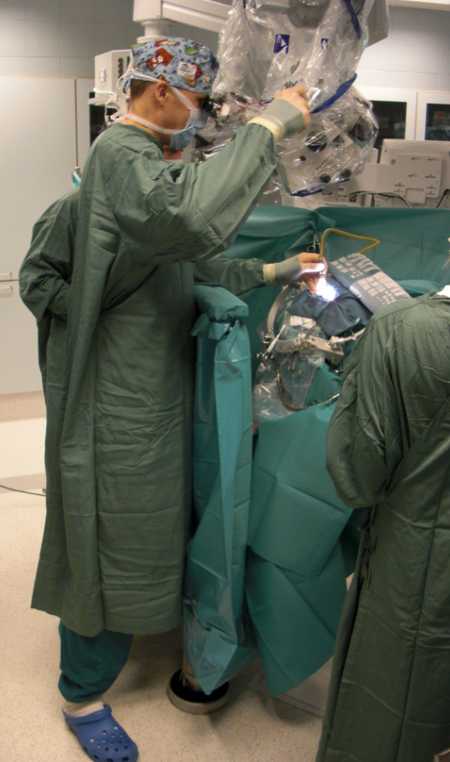
Хирург работает с микроскопом (Хельсинки, Финляндия, проф. Ниемели М.).
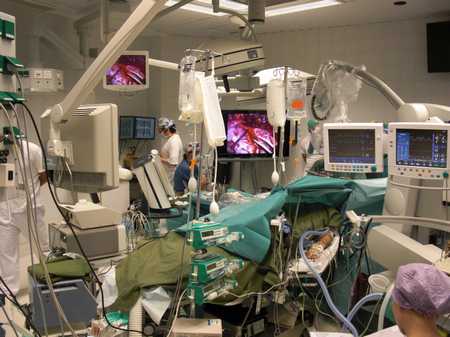
Общий вид нейрохирургической операционной (Хельсинки, Финляндия).
Операция складывается из нескольких этапов: трепанации черепа в лобно- височной области, вскрытия твердой мозговой оболочки, paссeчения арахноидальной оболочки на основании мозга и аспирации СМЖ, выделения магистральных сосудов головного мозга, выделения несущей аневризму артерии, самой аневризмы и выключения ее из кровотока путем клипирования.
Факторами риска в хирургии аневризм в остром периоде кровоизлияния являются:
— тяжелое состояние больного (IV-V степень по Hunt-Hess);
— наличие распространенного спазма и ишемии мозга;
— внутримозговая гематома объемом более 30 мл;
— прорыв крови в желудочки мозга и окклюзионная гидроцефалия;
— смещение срединных структур мозга более 5 мм.
Лечение в послеоперационном периоде.
До настоящего времени каких-либо эффективных методов медикаментозной терапии сосудистого спазма не существует. Поэтому при разрыве аневризмы для профилактики ишемии мозга или ее лечения проводят терапию, направленную на нормализацию перфузии мозга. С этой целью широко используют так называемую ЗН-терапию (hypertensia, hypervolemia, hemodilucia). До настоящего времени не установлено, какой из этих компонентов наиболее важен. Артериальное давление удерживают на уровне 15-20% выше обычного для данного больного давления, используя симпатомиметики. Гиперволемия достигается внутривенным введением альбумина и плазмы, гемодилюция — физиологического раствора. Гематокритное число не должно превышать 38-40. Подобная терапия позволяет значительно снизить риск развития ишемии мозга (до 15%) или уменьшить ее выраженность. Однако подобная терапия не позволяет предотвратить развития повторных кровотечений из аневризмы. Кроме того, при ЗН-терапии увеличивается риск развития сердечно-легочной недостаточности, почечной недостаточности, нарушений водно-электролитного баланса, коагулопатий.
Для профилактики ишемии и в ее лечении необходимо использовать антагонист кальция — нимодипин. Являясь блокатором кальциевых каналов, нимодипин препятствует поступлению ионов кальция через поврежденную мембрану в клетку и предотвращает ее повреждение. Первоначально препарат вводят внутривенно, через инфузомат, доводя скорость инфузии до 5 мл/час, под контролем артериального давления, затем назначают перорально. Иcпoльзовaниe препарата позволяет уменьшить число неврологических расстройств, обусловленных спазмом, на 12%. Необходимо помнить, что при внутривенном введении нимодипина может развиться артериальная гипотония, поэтому параллельно необходимо вводить и симпатомиметики. поддерживая нормальную перфузию мозга.
При написании статьи использованы материалы методических рекомендаций (№ 37) ДЗ Москва 2008.
Учреждение-разработчик: Научно-исследовательский институт скорой помощи им. Н.В. Склифосовского.
Составители: Академик РАМН проф. В.В. Крылов, канд. мед. наук А.Э. Талыпов.
Автор статьи: врач-нейрохирург Воробьев Антон Викторович Рамка вокруг текста
 Внутричерепная гематома
Внутричерепная гематома